混合菌株降解褐藻胶的筛选、鉴定及产酶条件优化
刘海超, 张 健, 刘 芳, 刘 奎, 王共明, 井月欣, 赵云苹
(1.上海海洋大学 食品学院,上海 201306;2.山东省海洋资源与环境研究院,山东 烟台 264006)
仿刺参(Apostichopusjaponicus)俗称刺参,属于棘皮动物门(Echinodermate)海参纲(Holothuroidea)仿刺参属(Apostichopus)[1]。仿刺参是我国重要的海洋经济物种,主要分布于山东半岛、辽东半岛和福建沿海等地区,作为传统保健食品富含多种生物活性成分,如多肽、多糖、酚类、皂苷等,具有抗癌、抗氧化、抗凝血、抗菌等多种天然生理功能[2-4]。随着养殖业的发展,仿刺参饵料问题日益凸显。仿刺参体内只有一根简单的肠道消化系统,且饵料不合适或者生长环境遭到破坏、污染都会造成仿刺参吐肠,甚至参体融化,对刺参产业造成巨大损失[5]。刺参饵料多以褐藻为主要原料,而褐藻胶是褐藻细胞中的主要多糖成分,刺参肠道褐藻胶裂解酶活力不高,对于高聚合度的褐藻多糖难以消化吸收[6]。目前,褐藻胶降解方法主要有物理法、化学法以及生物法[7]。生物酶解法相较于前两种方法具有降解产物活性高,对环境友好等优点。酶解后的褐藻胶寡糖具有促进生长[8-10]、抗菌[11-12]、抗炎[13-14]、抗肿瘤[15-17]和抗氧化[18-19]等活性,且相较于褐藻胶大分子更利于吸收利用。肠道菌群是肠道的重要组成部分,且水生动物肠道共生菌对宿主的免疫、发育及营养状况等具有密切的联系[20]。本研究从仿刺参肠道筛选可有效降解褐藻胶的协同作用菌株,研究最佳混合菌株的产酶条件,以期提高其酶活力,使褐藻在刺参饲料中的利用率最大化,为刺参发酵饵料的研发提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 仿刺参肠道菌株为山东省海洋资源与环境研究院食品中心前期驯化纯化培养后保存。
1.1.2 培养基(质量分数,%) ①固体初筛平板培养基:海藻酸钠0.5,酵母膏0.1,蛋白胨0.5,琼脂2,NaCl 3。三级纯水配制,pH自然(约为6.2)于500 mL三角瓶中,121 ℃、20 min高压蒸汽灭菌后倒入平板中,用于菌种分离。②种子液培养基:海藻酸钠0.5,酵母膏0.1,蛋白胨0.5,NaCl 3。三级纯水配制,pH自然,于15 mL试管(装液量为3 mL)中,121 ℃、20 min高压蒸汽灭菌后用于菌种种子液培养、菌种活化。③液体复筛培养基:海藻酸钠0.5,酵母膏0.1,蛋白胨0.5,NaCl 3。三级纯水配制,pH自然于250 mL锥形瓶(装液量为100 mL)中,121 ℃、20 min高压蒸汽灭菌后用于菌种复筛。
1.1.3 主要试剂 海藻酸钠(CP)、酵母膏、琼脂粉、胰蛋白胨、3,5-二硝基水杨酸、四水合酒石酸钾钠、亚硫酸氢钠、十二水合磷酸氢二钠购自国药集团化学试剂有限公司;磷酸二氢钾购自天津市恒兴化学试剂制造有限公司,叔丁醇、戊二醛25%水溶液购自西陇化工股份有限公司。以上试剂均为分析纯。
1.1.4 仪器与设备 酶标仪(1510,美国Thermo Fisher Scientific);离心机(5453 Mini Spin Plus,德国Eppendorf AG);电子扫描显微镜(S-4800,日本Hitachi);台式高速冷冻离心机(TGL-16M,湖南湘仪仪器有限公司);pH计(s210,瑞士Mettler-Toledo);立式自动压力蒸汽灭菌器(GR60DA,厦门致微仪器有限公司);生化培养箱(BSP-100F,沙鹰科学仪器(上海)有限公司);震荡培养箱(MQL-61R,上海旻泉仪器有限公司);数显电子恒温水浴锅(HH-4,常州国华电器有限公司)。
1.2 方法
1.2.1菌种活化筛选 分别挑取1环保存于-80 ℃甘油中的菌种置于种子液培养基,28 ℃恒温活化24 h。活化后的菌种涂布划线于固体初筛平板培养基中,28 ℃恒温培养2~3 d,筛选有透明圈或者培养基凹陷明显的菌落继续划线培养分离纯化。挑取1个纯化后的细菌菌落接种到种子液培养基,28 ℃、200 r/min培养24 h,按照3%(体积分数)接种量接种于液体复筛培养基中,28 ℃、200 r/min培养48 h。8 000 r/min离心10 min,取上清液测定褐藻胶降解酶的酶活力。
1.2.2 生长曲线的绘制 菌株于液体培养基中连续培养72 h,在不同时间段每次取200 μL发酵液于96孔板,利用酶标仪在600 nm下测其吸光值,记录生物量,以时间作为横坐标绘制生长曲线。
1.2.3 酶活力的测定 采用3,5-二硝基水杨酸(DNS)法[21]测定菌株酶活力。酶活力定义单位(U):每分钟释放1 μg还原糖所需的酶量为一个酶活力单位(U)。酶活力计算公式:
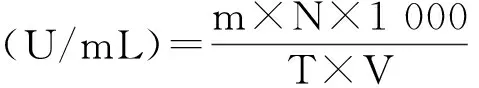
式中,m:还原糖量(mg)(根据OD值从标准曲线查得);N:稀释倍数(酶液即离心的发酵液);T:反应时间(20 min);V:酶液体积(0.2 mL)。
1.2.4 菌种鉴定 将菌株S1、S2、S10和S11纯菌落用无菌水从固体平板培养基中冲洗至离心管中,8 000 r/min离心5 min,重复3次,送至上海美吉生物医药科技有限公司进行16S rDNA基因测序,测序结果采用NCBI数据库BLAST在线程序进行分析,序列登录号分别为KXSM7U2X014、KYEJJ6M401R、KYTTNGKB014、KZ1AB8MN014,与已知种类微生物进行16S rDNA基因序列比对,选择下载较高相似性的序列利用MEGAX软件并采用邻接法(Neighbour-joining,NJ)构建发育树,Bootstrap重复1 000次检验发育树稳定性。
1.2.5 菌体形态观察 对菌株进行固定、脱水、干燥等前处理[22],扫描电子显微镜观察菌体形态。
1.2.6 产酶条件研究 对菌株S1、S2、S10和S11分别进行双菌、三菌及四菌混合发酵培养,并取最佳组合菌株的最佳混合比例进行发酵产酶优化实验。通过单因素试验对影响产酶的培养基初始pH值、NaCl质量浓度、装液量和培养温度的最优参数进行研究,各因素水平见表1。酶活力采用1.2.3方法定量测定,通过酶解后产生的不饱和糖醛酸在235 nm处有强烈紫外吸收,进而定性测量褐藻胶寡糖含量,每一步优化结果均用于后续试验,每个实验做3个平行,重复3次。

表1 单因素水平分布Table 1 Single factor horizontal distribution
1.2.7 响应面法优化产酶条件研究 基于上述单因素试验结果进行响应面优化试验设计。全面考察培养基初始pH值、NaCl质量浓度、装液量和培养温度对混合菌株酶活力的影响。根据Box-Behnken 设计,进行四因素三水平的响应面分析试验,得出最佳酶解条件。实验因素水平见表2。
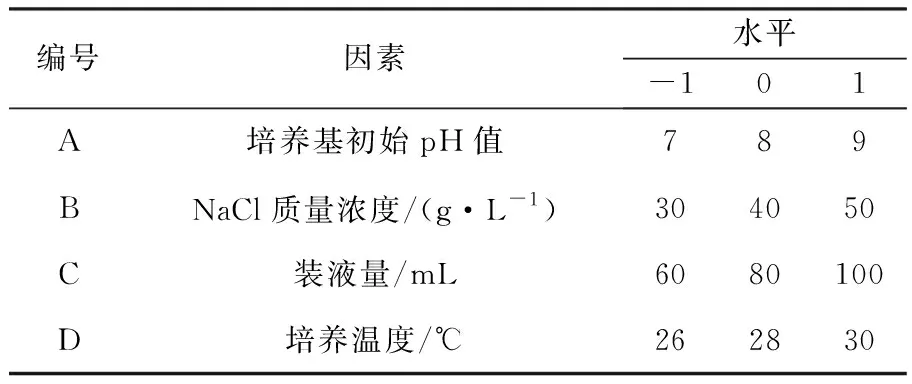
表2 试验因素水平Table 2 Test factor level
2 结果与分析
2.1 产酶菌株筛选
实验室前期以海带粉制作仿刺参饲料对仿刺参进行实验室驯化培养,将驯化后仿刺参置于无菌环境中取其肠道,将肠道菌群在以海藻酸钠为唯一碳源的培养基中进行涂布、划线纯化培养,以能在海藻酸钠固体初筛培养基中存活并产生明显透明圈的菌株作为仿刺参肠道初筛菌株,DNS法复筛,其中13株可利用海藻酸钠进行生长代谢,结果如图1所示,降解产物褐藻胶寡糖在235 nm处有紫外吸收峰,通过测量235 nm吸光度定性测量培养基中褐藻胶寡糖含量,酶活力越高气泡越大。其中菌株S1、S2、S10以及S11酶活力较高,经革兰碘液染色透明圈如图2所示。图1和图2对比可知,褐藻胶裂解酶酶活力与透明圈产生大小无正相关。
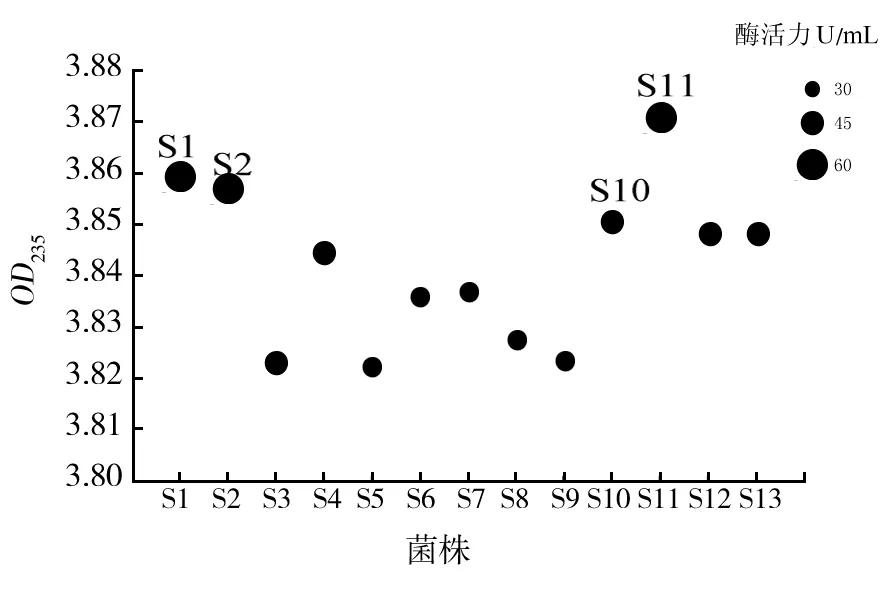
图1 活化菌株DNS法与紫外法初筛结果Fig.1 Preliminary screening results of active strains by DNS and UV
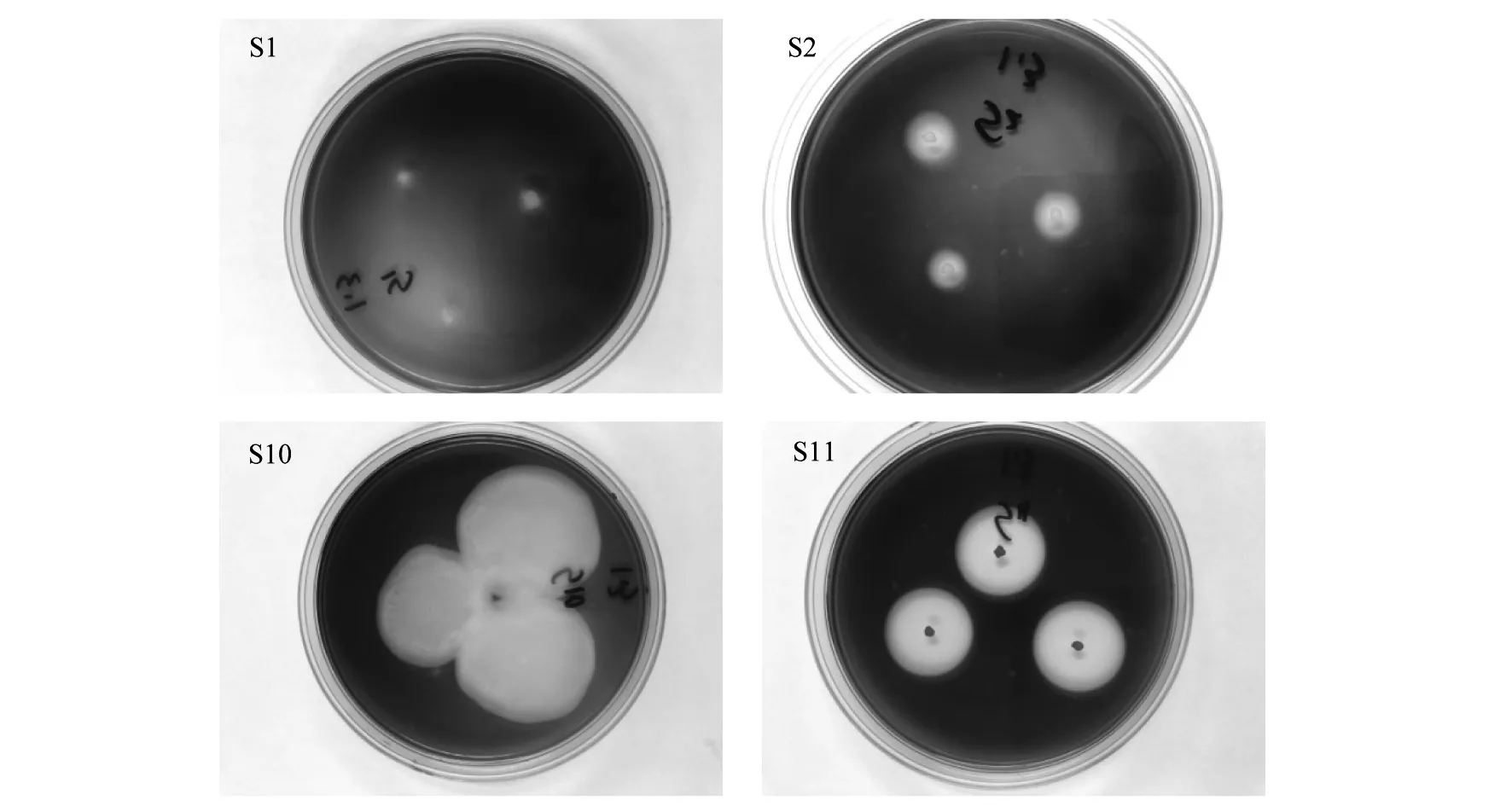
图2 固体培养基透明圈Fig.2 Transparent circle of solid culture medium
将菌株S1、S2、S10、S11分别进行双菌、三菌及四菌混合培养,测定其酶活力,结果如图3所示,发现S2与S11组合酶活力最高为63.36 U/mL,显著高于其他组别,且降解效果优于单菌株。
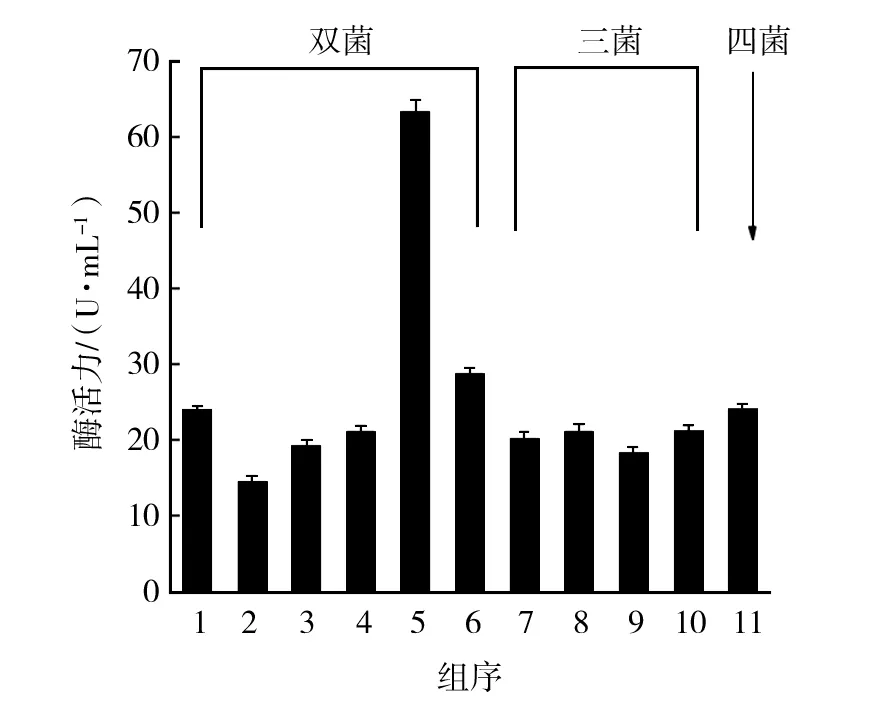
图3 多菌株混合产酶活力情况Fig.3 Enzyme activity of mixed strains
将菌株S2与S11分别按1∶5、2∶4、3∶3、4∶2和5∶1的种子液体积比接种置于盛有100 mL液体培养基的250 mL锥形瓶中,28 ℃恒温摇床培养48 h,测定酶活力及235 nm紫外吸光值,结果如图4所示,菌株S2与S11的接种比例为4∶2时,酶活力最高为65.83 U/mL,褐藻胶寡糖生成量也最多。
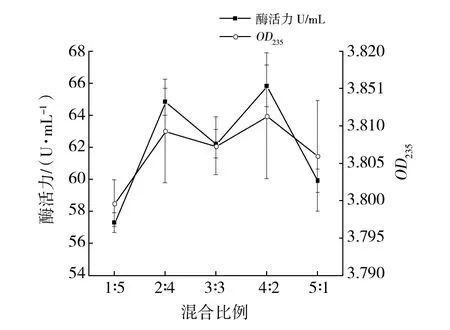
图4 混合菌株接种比例对褐藻胶降解的影响Fig.4 Effect of inoculation ratio of mixed strains on alginate degradation
2.2 菌株16S rDNA鉴定结果分析
经测序结果可知,菌株S2和S11的16S rDNA基因序列分别含有1 431 bp和1 465 bp,通过BLAST比对发现分别与微杆菌属(Microbacteriumsp.)和微小杆菌属(Exiguobacteriumsp.)的多个菌株序列相似性达到99%,故将其分别归为微杆菌属和微小杆菌属。系统发育树如图5所示。
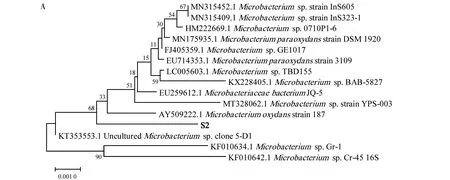

图5 基于16S rDNA序列的微杆菌属和微小杆菌属系统发育进化树Fig.5 Phylogenetic tree ofMicrobacteriumsp. andExiguobacteriumsp. based on 16S rDNA sequenceA:微杆菌属;B:微小杆菌属A:Microbacterium sp.; B:Exiguobacterium sp.
电镜扫描观察菌体形态,结果如图6所示,菌株S1、S2和S11较S10表面光滑,4株菌均呈长杆状。


图6 电镜扫描结果Fig.6 Scanning electron microscope results
2.3 混合菌株单因素试验
2.3.1 培养基初始pH值对混合菌株产酶的影响 培养基初始pH值可通过影响细胞质膜通透性、膜结构稳定性、物质溶解性或者电离性来影响培养基中营养物质的吸收和酶的分泌,进而影响菌株的生长代谢[23]。培养基初始pH值对混合菌株酶活力及还原糖的生成量影响如图7所示:培养基初始pH值为8时,褐藻胶裂解酶酶活力最高为86.2 U/mL;pH值在4~6范围内酶活力呈上升趋势;pH值为7时酶活力下降,但褐藻胶寡糖依然呈上升趋势,说明pH值为7时降低了该混合菌株的酶活力,但没有完全抑制。pH值为5的培养基中褐藻胶寡糖含量低于pH值为4的培养基,但显著高于pH值为4时的酶活力,说明该条件下混合菌株可利用褐藻胶寡糖为自身生长代谢提供能量,且褐藻胶寡糖利用率高于褐藻胶降解效率。
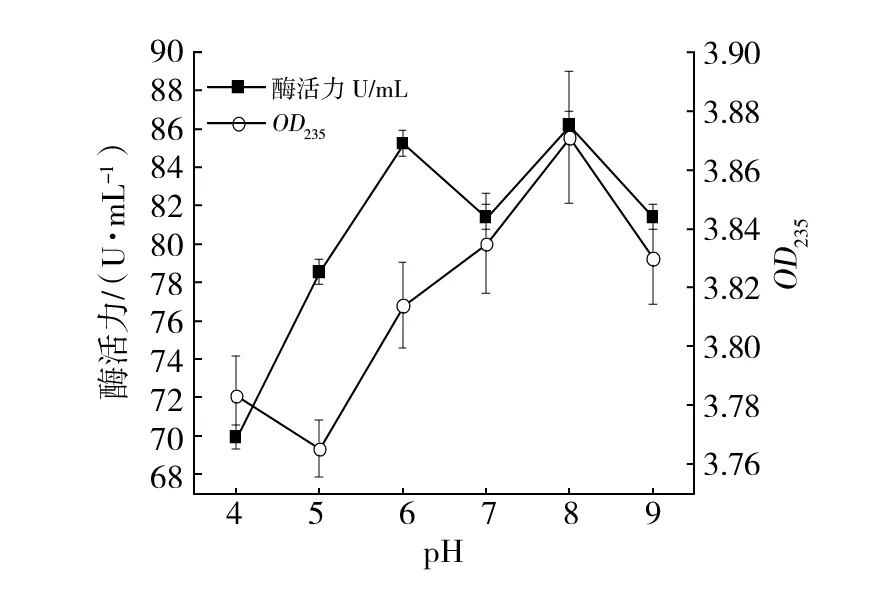
图7 初始pH值对混合菌株产酶影响Fig.6 Effect of initial pH value of culture medium on enzyme production of mixed strains
2.3.2 NaCl质量浓度对混合菌株产酶的影响 海洋来源微生物多具有嗜盐性,且NaCl可以调节菌株细胞内外电势差和渗透压,故菌株生长产酶会受NaCl质量浓度影响。据报道,多数研究学者发现海洋微生物产酶所需NaCl质量浓度多为30~40 g/L[24]。如图8所示,NaCl质量浓度在10~40 g/L之间时,酶活力呈显著上升趋势,褐藻胶寡糖含量也逐渐增加,NaCl质量浓度为40 g/L时,混合菌株酶活力最大为84.07 U/mL。随着NaCl质量浓度的增加,混合菌株酶活力呈下降趋势,褐藻胶寡糖含量显著降低。
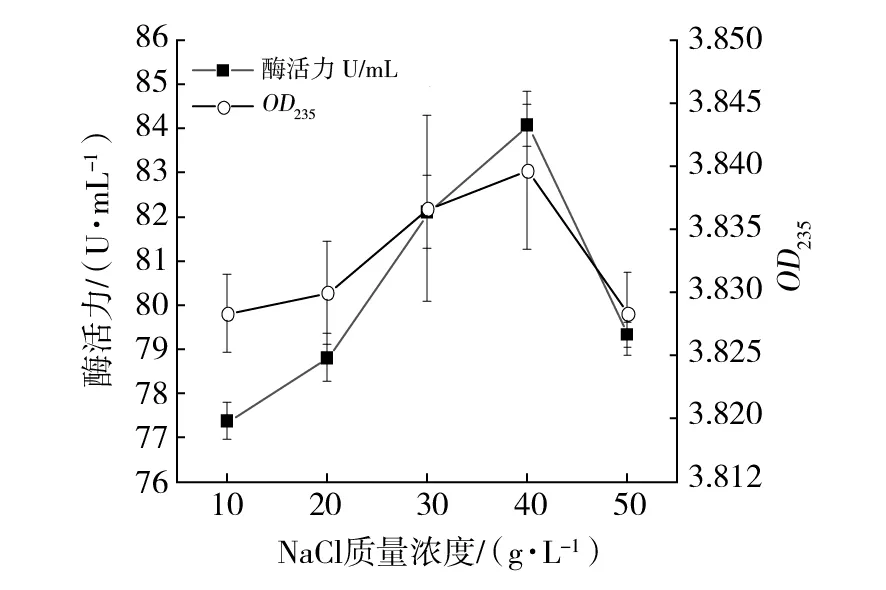
图8 NaCl质量浓度对混合菌株产酶的影响Fig.8 Effect of NaCl concentration on enzyme production of mixed strains in medium
2.3.3 装液量对混合菌株产酶的影响 需氧细胞生命活动的主要能量来源是有机物的氧化磷酸化作用,也是生物产生ATP的主要途径,故培养基中溶氧量是菌株生长产酶的重要影响因素[25]。培养基中装液量过多,会降低培养基中溶氧量,影响电子传递,降低ATP生成量,进而影响菌株生理活性及产酶活性,装液量过少,溶氧量过多,菌株生长代谢加快,代谢物增加对菌株产酶起到抑制作用,且水分蒸发加快,不利于菌株生长。如图9所示,装液量在20~80 mL时混合菌株酶活力显著上升,最高为84.80 U/mL,还原糖生成量呈先增加后平缓再增加的趋势,分析可能与菌株自身生长代谢利用有关。随着装液量继续增加,均呈下降趋势。
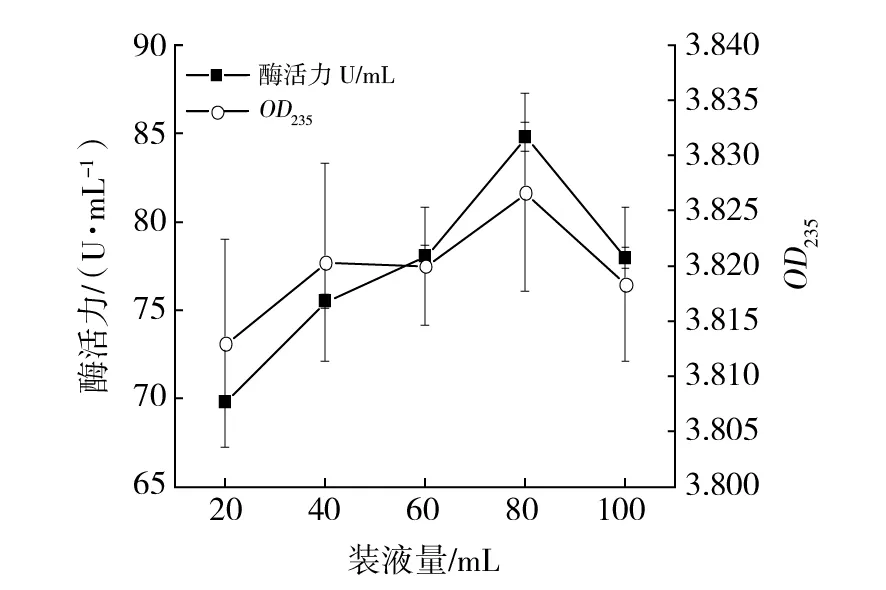
图9 装液量对混合菌株产酶影响Fig.9 Effect of liquid loading on enzyme production of mixed strains
2.3.4 培养温度对混合菌株产酶的影响 培养温度对微生物生长代谢产生多种影响,如酶的反应速率,菌株代谢产物合成方向等[26]。如图10所示,当培养温度在18~28 ℃范围内,随着温度的增加,混合菌株酶活力呈显著上升趋势,褐藻胶寡糖生成量呈先缓慢再显著增加趋势,最高酶活力为86.34 U/mL。随着培养温度继续升高,该混合菌株褐藻胶酶活力和寡糖含量均呈下降趋势,分析可能由于温度过高,抑制酶活力,褐藻胶降解速率降低,寡糖生成量减少。
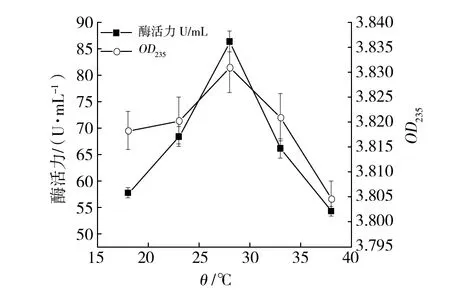
图10 培养温度对混合菌株产酶影响Fig.10 Effect of culture temperature on enzyme production of mixed strains
2.4 Design Expert优化结果分析
对混合菌株褐藻胶裂解酶产酶条件进行响应面优化可利用较少的实验次数反应各个因素之间的交互作用,以达到优化效果,提高酶活力。
采用Design Expert 8.0软件设计4因素3水平实验,实验结果如表3所示。对表中数据进行回归分析,以酶活力(Y)为响应值,对自变量培养基初始pH值(A)、NaCl质量浓度(B)、装液量(C)培养温度(D)的多元回归模型:Y=+91.99+0.38A+1.32B-0.42C-0.21D-0.88AB+0.18AC+0.38AD+ 3.14BC-0.33BD-0.10CD-10.23A2-8.90B2-6.81C2-14.76D2。
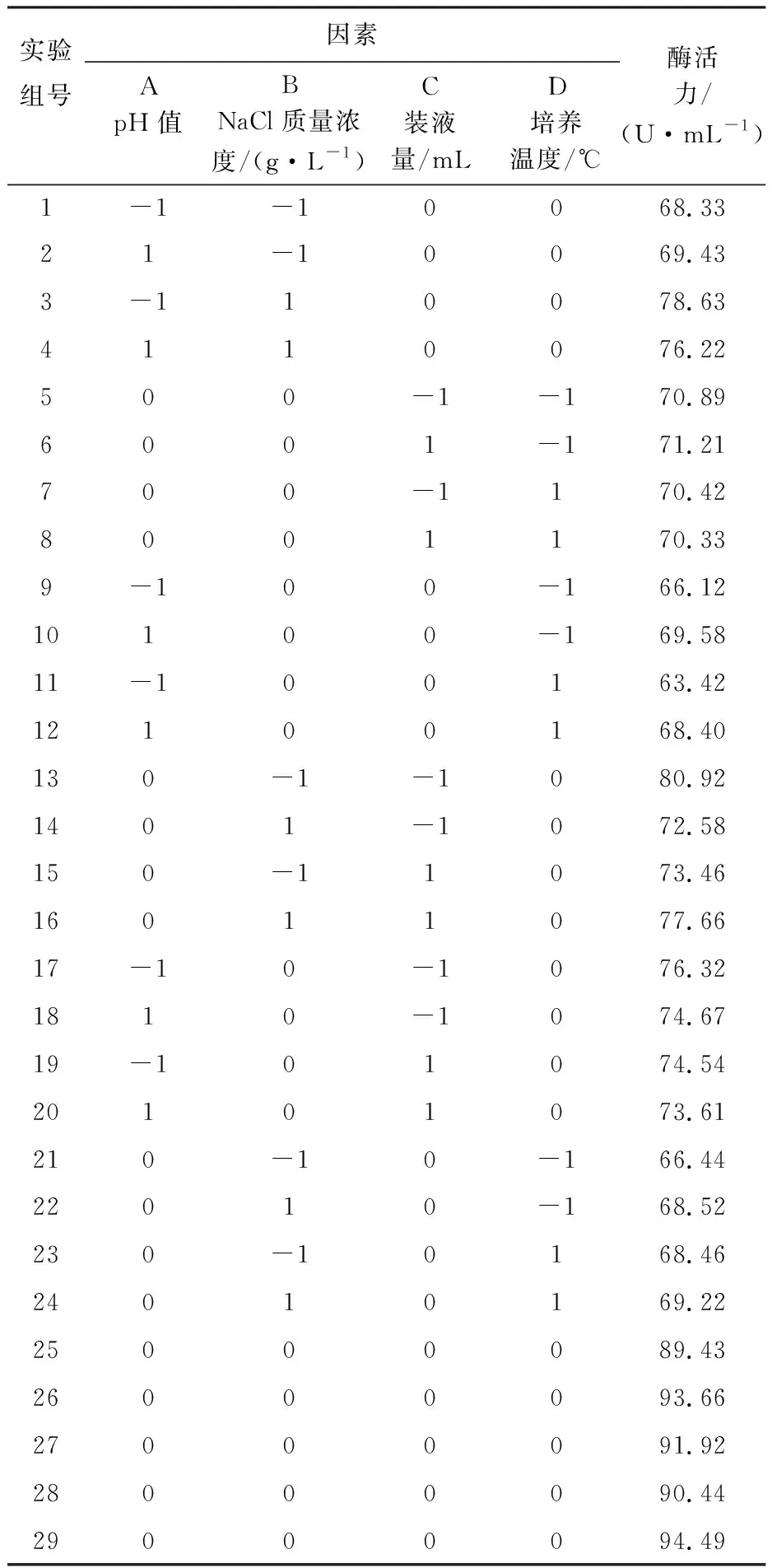
表3 试验优化模型与结果Table 3 Test optimization model and results
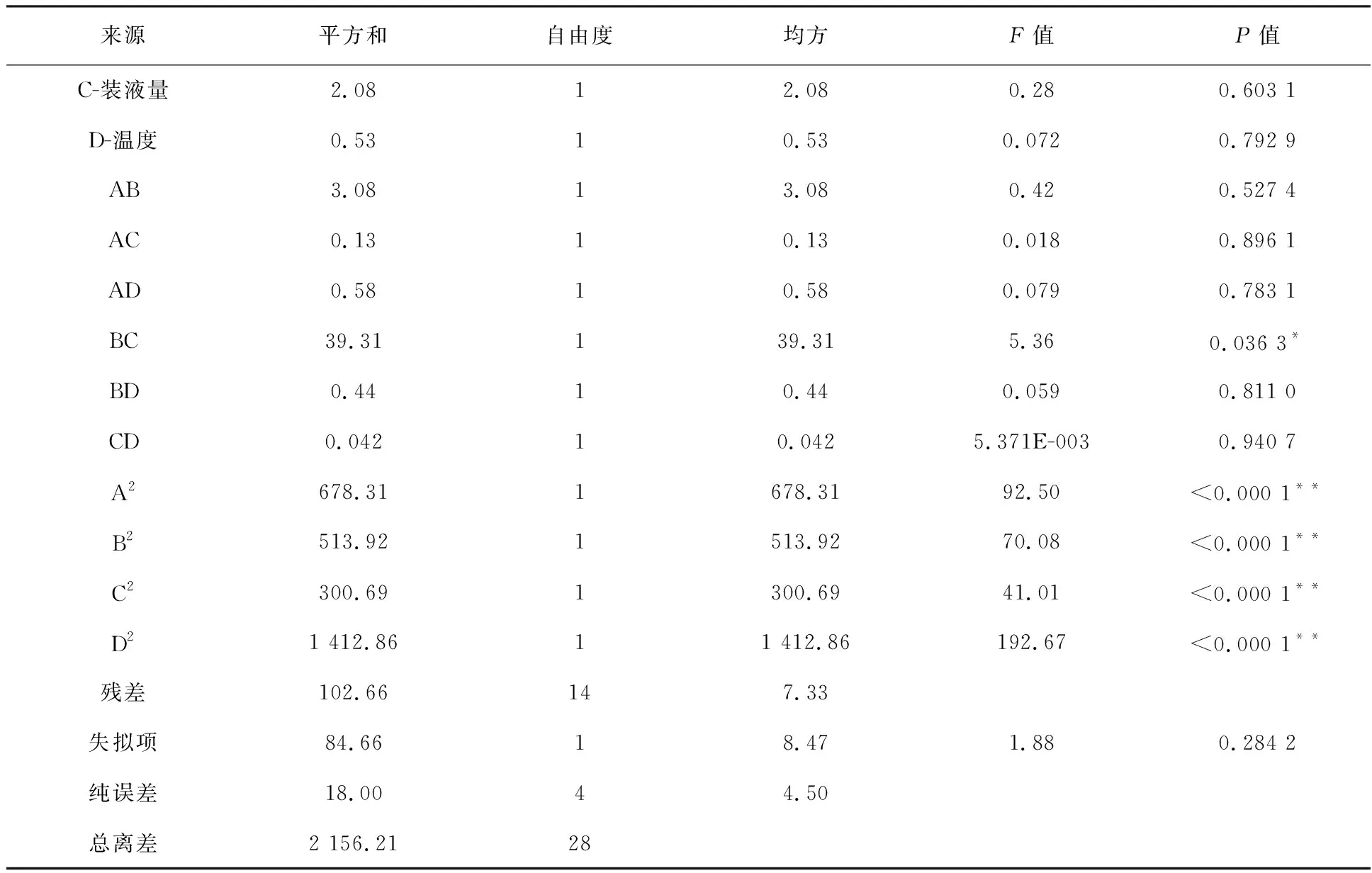
由表4可知,整体模型P<0.000 1为极显著水平,失拟项为0.284 2,P>0.05不显著,说明方程拟合程度较好,模型相关系数R2=0.952 4,说明回归方程相关性较好,校正决定系数Radj2=0.904 8,说明预测值与试验测量值相关性较高。表中交互项BC(P<0.05)交互作用显著,二次项A2、B2、C2和D2均为极显著水平(P<0.000 1)其余各项对响应值均为不显著。

表4 回归模型方差分析Table 4 Analysis of variance of regression model
续表4
由图11可直接观察响应值与自变量试验参数之间的关系,3D图可直接反应响应值随各因素的变化趋势,等高线可直接反应两因素交互作用强弱,等高线越密集说明两因素交互作用越显著,反之越不显著[27]。根据响应面回归分析绘制各因素对褐藻胶裂解酶酶活力影响的响应面及等高线图如图11所示,图(a)为以培养基初始pH和NaCl质量浓度为自变量的响应面图和等高线图,当NaCl质量浓度一定时,混合菌株产褐藻胶裂解酶酶活力随培养基初始pH的增加呈先升高后下降趋势,等高线图较密集,两因素交互作用显著。由图(b)的3D图可知,响应面开口朝下,存在响应值最高值[28],当响应值达到极值点后,随着各因素水平继续增大,响应值逐渐减小,等高线图呈椭圆形[29],说明NaCl质量浓度和装液量两因素交互作用显著。图(c)表示以NaCl质量浓度和培养温度为自变量对酶活力影响的3D图和等高线图,由图可知,两因素等高线呈近似椭圆形,两因素交互作用显著,且培养温度较NaCl质量浓度作用更显著。其余各因素交互作用不显著,图略。
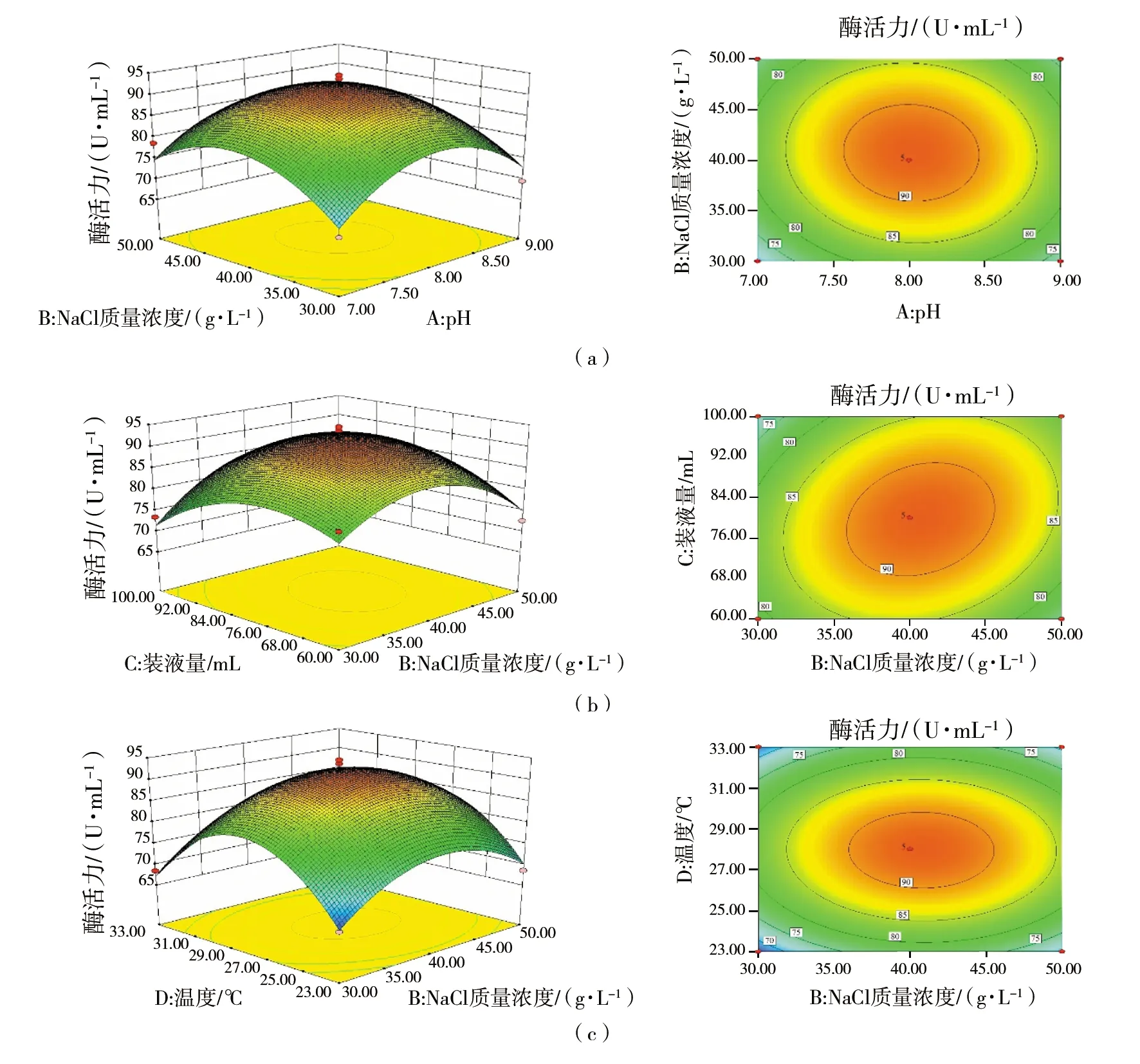
图11 各因素对褐藻胶裂解酶酶活力影响的响应面图及等高线图Fig.11 Response surface and contour map of the effects of various factors on the activity of alginate lyase
2.5 响应面优化验证试验结果分析
根据回归模型预测最佳产酶条件:培养基初始pH为8.02,NaCl质量浓度为40.71 g/L,装液量为79.73 mL,培养温度为27.96 ℃,对试验条件进行修正,调整为pH为8,NaCl质量浓度为40 g/L,装液量为80 mL,温度为28 ℃,3次重复试验,获得酶活力平均值94.78 U/mL,与预测值92.04 U/mL相近,说明试验预测值与真实值拟合度较高,比优化前酶活力提高43.9%。
2.6 混合菌株生长曲线及各菌株丰度变化
优化后混合菌株生长曲线如图12所示,0~8 h菌株生长缓慢,为混合菌株生长迟缓期,8~36 h生长迅速,为对数生长期,第36 小时达到生物量最大值,36~48 h为混合菌株生长稳定期,48 h后生物量开始呈下降趋势,进入衰亡期。分别取编号为1、6、10和13(即生长时间为0、24、36、72 h)的混合菌液利用高通量测序技术对菌群丰度进行检测,观察两菌不同时期生长动态变化。如图13所示,属级群落丰度随生长时间延长不断变化,初始微小杆菌属比重较大,占比约为96%,微杆菌属占比约为3.7%。微杆菌属与微小杆菌属两菌株初始按体积比为2∶1的比例接种,但两菌株丰度比不是2∶1,说明在相同种子液培养条件下,微小杆菌属菌株生长更迅速,菌群密度更大,随时间推移,微杆菌属生长迅速,占比逐渐增加,但微小杆菌属依然为优势菌。且其他菌株很少,说明试验较严谨,没有混入多余杂菌。
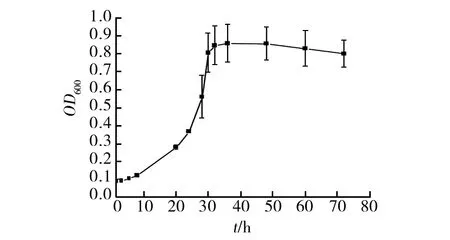
图12 混合菌株生长曲线Fig.12 Growth curve of mixed strains

图13 属级群落丰度变化Fig.13 Variation of community abundance at genus level
3 讨 论
近年来,褐藻胶生物酶解研究取得一定进展,国内外研究学者已从海洋软体动物、海洋藻类、微生物、土壤等样品中发现可分泌褐藻胶裂解酶的菌株,如弧菌属(Vibriosp.)、芽胞杆菌属(Bacillussp.)等[30]。据报道,多数褐藻胶降解菌株产酶最适温度在30~40 ℃附近[31-33],培养基初始pH多数偏弱碱性[34-35],且由于大部分褐藻胶降解菌株从海洋环境中筛选所得,NaCl质量浓度也是影响菌株生长代谢的重要因素,多数海洋褐藻胶降解菌株最适NaCl质量浓度在30~40 g/L范围内[24]。现已报道的褐藻胶降解菌株多为单株菌纯培养,鲜有混合发酵培养菌株。本研究采用实验室前期对仿刺参喂食海带粉驯化养殖后的肠道菌群进行筛选、鉴定、优化发酵条件,最终获得混合菌株最佳产酶条件:培养基初始pH为8.02,NaCl质量浓度为40.71 g/L,装液量为79.73 mL,培养温度为27.96 ℃,优化后酶活力提高43.9%,达到94.78 U/mL。周敏[36]从鲍鱼内脏中筛得Vibriosp.B4菌株并对其产酶条件进行优化,优化后酶活力提高3.67倍达到19.09 U/mL。本研究中混合菌株对发酵法降解褐藻胶的研究具有一定参考意义。对于两株菌间的协同效应及相互作用机制还需做进一步研究。本研究可进一步研究筛得混合菌株的细胞破碎上清液酶活性,探究是否存在胞内酶活性,以及混合菌株降解褐藻胶所得低聚寡糖结构及生物活性,为仿刺参益生发酵饲料的研发提供参考。

