植物内生真菌F4a次级代谢产物的分离鉴定以及降血糖、抗氧化活性的研究
石逸冰, 白 岩, 潘华奇, 胡江春,*
(1.沈阳药科大学 制药工程学院,辽宁 沈阳 110016;2.中国科学院 沈阳应用生态研究所,辽宁 沈阳 110016)
植物内生真菌是指在植物寄主中度过全部或近乎全部生命周期而不使寄主植物表现明显感染症状的一类真菌[1]。由于其生存环境特殊,在与宿主植物长期复杂的共生关系中,能够产生结构新颖以及生物活性较好的次级代谢产物[2]。自1993年Stierle等从红豆杉中分离到内生真菌Taxomycesandreanae,并从其中发现紫杉醇后[3],内生真菌作为药用先导化合物的重要来源,引起了广泛关注。在过去的二十年里,已经报道了相当数量的从植物内生真菌中分离得到的具有新颖结构的次级代谢产物,如萜类、生物碱、酯类、甾体、醌类和环肽等类型化合物[4],并且其次级代谢产物往往具有抗菌、抗病毒、抗癌、抗氧化以及降糖等生物活性[5]。Xie等[6]从三七健康根中分离出一株内生青霉菌Penicilliumsp.,从其次级代谢产物中得到大环内酯类抗生素brefeldin A的5个新衍生物,并且部分化合物表现出中等抗菌活性。郭慧娴等[7]从红树林内生真菌Penicilliumsp. SCNU-F0003的代谢产物中分离得到一种具有中等抗氧化活性的新化合物。由此可见,从植物内生真菌中寻找新颖的药物先导化合物有非常大的研究空间。α-糖苷酶抑制剂可以竞争性地抑制小肠内α-葡萄糖苷酶的活性,延缓或抑制α-葡萄糖苷酶的吸收,从而有效降低血糖[8],对机体血糖水平的调节具有重要意义。抗氧化剂通过清除外来的或内源性生成的活性氧,减缓脂质氧化,保护生物体完整性。按来源可以分为天然和合成两大类。天然抗氧化剂来源广泛、品种繁多,广泛应用在食品和化妆品行业中。中国科学院沈阳应用生态研究所农业微生物组前期研究发现,植物内生真菌布雷青霉菌(Penicilliumbrefeldianum) F4a具有产生丰富次级代谢产物的潜力,但目前仅从其中分离鉴定了一个抗真菌活性单体brefeldin A[9]。为了进一步挖掘内生菌F4a中其他的次级代谢产物,本研究对其特定培养基条件下产生的次级代谢产物进行了提取分离和结构鉴定,并对其降血糖和抗氧化活性进行评价。
1 材料与方法
1.1 材料
1.1.1 菌株 植物内生真菌布雷青霉菌(Penicilliumbrefeldianum)F4a由中国科学院沈阳生态研究所农业微生物组潘华奇等分离和鉴定[9],并保藏于本实验室。
1.1.2 培养基 ①PDA培养基;②液体发酵培养基(g/L):淀粉10,葡萄糖20,酵母提取物1,黄豆饼粉0.5,大麦提取物2.5,(NH4)2SO41,KNO30.8,CaCO34,MgSO4·7H2O 2.5,KH2PO43,CuSO40.02,蒸馏水1 L,pH 7.0。
1.1.3 主要试剂与仪器设备 硅胶(100-200目、200-300目,青岛海洋化工厂);Sephadex LH20(GE Healthcare);ODS填料(日本YMC公司);色谱甲醇(ThermoFisher);氘代试剂(美国剑桥CIL);2, 2′-连氮基-双-(3-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)(美国Sigma公司);对硝基苯-β-D-半乳糖吡喃糖苷(pNPG)(美国Sigma公司);α-葡萄糖苷酶(美国Sigma公司)。核磁共振仪(AvanceⅡ600 MHz,Bruker);高效液相色谱仪(Ultimate-3000,Thermo);立式压力蒸汽灭菌器(YSQ-LS-50S11,上海博讯实业有限公司医疗设备厂);超净操作台(BCN-1360B,北京东联哈尔仪器制造有限公司);恒温振荡器(DHL,太仓市实验仪器有限公司);旋转蒸发仪(N1100D,东京理化株式会社);酶标仪(SYNERGY-2,Biotek公司)。
1.2 方法
1.2.1 菌株培养和发酵 PDA培养基平板活化菌株F4a,28 ℃恒温培养72 h,然后用挖块法接种于装有50 mL上述液体培养基的250 mL锥形瓶,28 ℃,180 r/min恒温培养72 h后用作种子液,将种子液转接到含有1 L液体培养基的3 L锥形瓶,28 ℃,180 r/min恒温培养7 d,发酵总体积为30 L。
1.2.2 发酵粗提物制备 发酵液4 000 r/min离心20 min,每升上清液加40 g大孔吸附树脂HP20,28 ℃,180 r/min恒温振荡2 h,收集树脂,并用蒸馏水洗涤,然后用甲醇解吸,回收甲醇溶剂后得到粗提物35 g。
1.2.3 化合物分离纯化和结构鉴定 采用快速硅胶柱色谱法分离,按照V二氯甲烷∶V甲醇=(100∶0)~(0∶100)梯度洗脱,获得5个流分(Fr.1~5)。Fr.2经Sephadex LH-20纯化(甲醇洗脱),再经半制备液相色谱(40% MEOH)纯化,得到化合物2(9.5 mg)和6(8.5 mg)。Fr.3经ODS反相柱层析分离,按照V甲醇∶V水=(30∶70)~(55∶45)梯度洗脱,再经半制备液相色谱(35% MEOH)纯化,得到化合物1(16.2 mg)和4(3 mg)。Fr.4经ODS反相柱层析分离,按照V甲醇∶V水=(30∶70)~(60∶40)梯度洗脱,再经半制备液相色谱(45%MEOH)纯化,得到化合物3(8.5 mg)和5(4.2 mg)。将分离得到的化合物通过NMR进行结构鉴定。
1.2.4 α-葡萄糖苷酶抑制活性测定[10]准确吸取化合物1~6的系列浓度溶液(400、200、100、20和10 μmol/L)各20 μL,加入30 μL的α-葡萄糖苷酶溶液,再加入800 μL的0.1 mol/L磷酸盐缓冲溶液(pH 6.8),37 ℃加热5 min;加入150 μLpNPG溶液(10 mmol/L),混合均匀,37 ℃加热30 min;加入650 μL的Na2CO3终止液(1 mol/L)终止反应,使用酶标仪测样,在405 nm下测定吸光度值。每个供试品重复测定3次,阳性对照为阿卡波糖,阴性对照为DMSO。α-葡萄糖苷酶抑制率(%)=(1-(Asamp/Acont))×100%,其中Asamp代表供试品溶液的吸光度值,Acont代表阴性对照溶液的吸光度值,最终实验结果用EC50值(μmol/L)表示。
1.2.5 ABTS自由基清除活性测定[11]将配好的ABTS+溶液用0.01 mol/L磷酸盐缓冲液稀释约32倍,稀释后避光放置30 min,使测得的吸光度值准确,紫外分光光度计测定吸光度值0.7±0.02为合格,可以使用。准确吸取化合物1~6的系列浓度溶液(8、4、2、0.4 和0.1 mmol/L)各100 μL和ABTS+溶液3 mL至玻璃试管中混匀,室温暗处反应6 min,放入酶标仪,734 nm处测定吸光度,每个供试品重复测定3次,阳性对照为维生素C,阴性对照为无水乙醇。ABTS自由基清除率计算公式:清除率(%)=(1-(Asamp/Acont))×100%,其中Asamp代表供试品溶液的吸光度值,Acont代表阴性对照溶液的吸光度值,最终实验结果用EC50值(μmol/L)表示。
2 结果与分析
2.1 化合物结构鉴定
从植物内生真菌F4a的次级代谢产物中共分离得到6个单体化合物(图1),结构鉴定如下。
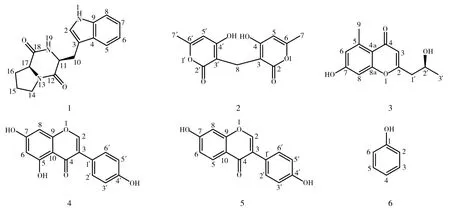
图1 植物内生真菌F4a的次级代谢产物Fig.1 Secondary metabolites of plant endophytic fungus F4a
化合物1:黄色油状物;1H NMR(600 MHz, DMSO-d6)δH:10.86(1H,s,1-NH),7.74(1H,s,19-NH),7.55(1H,d,J=7.9 Hz,H-5),7.31(1H,d,J=8.0 Hz,H-8),7.16(1H,d,J=2.1 Hz,H-2),7.04(1H,t,H-7),6.95(1H,t,H-6),4.29(1H,t,H-11),4.05(1H,t,H-17),3.36(1H,m,H-14),3.25(1H,m,H-14),3.22(1H,m,H-10),3.06(1H,dd,J=14.9, 5.8 Hz, H-10),1.96(1H,m,H-16),1.67(1H,m,H-15),1.60(1H,m,H-15),1.36(1H,m,H-16)。13C NMR(150 MHz,DMSO-d6)δC:169.0(C-18),165.0(C-12),136.0(C-9),127.4(C-4),124.4(C-2),120.9(C-7),118.7(C-5),118.3(C-6),111.3(C-8),109.3(C-3),58.5(C-17),55.3(C-11),44.6(C-14),27.7(C-16),25.8(C-10),21.9(C-15)。上述数据与文献[12]一致,故鉴定化合物为环(L-色氨酸-L-脯氨酸)(1)。
化合物2:黄色油状物;1H NMR(600 MHz, DMSO-d6)δH:5.94(2H,s,H-5,5′),3.31(2H,s,H-8),2.11(6H,s,H-7,7′)。13C NMR(150 MHz,DMSO-d6)δC:166.4(C-4,4′),165.2(C-2,2′),159.7(C-6,6′),100.7(C-5,5′),99.4(C-3,3′),19.1(C-7,7′),17.4(C-8)。上述数据与文献[13]一致,故鉴定化合物为3,3′-Methylenebis(4-hydroxy-6-methyl-2H-pyran-2-one)(2)。
化合物3:黄色油状物;1H NMR(600 MHz, DMSO-d6)δH:6.61(1H,d,J=2.3 Hz,H-6),6.59(1H,d,J=2.3 Hz,H-8),5.95(1H,s,H-3),4.01(1H,m,H-2′),2.64(3H,s,H-9),2.58(1H,m,H-1′),2.53(1H,m,H-1′),1.13(3H,d,J=6.2 Hz,H-3′)。13C NMR(150 MHz,DMSO-d6)δC:178.3(C-4),164.8(C-2),160.9(C-7),159.2(C-8a),141.4(C-5),116.5(C-6),114.5(C-4a),111.6(C-3),100.6(C-8),64.1(C-2′),42.9(C-1′),23.5(C-3′),22.5(C-9)。上述数据与文献[14] 一致,故鉴定化合物为2-(2′S-Hydroxypropyl)-5-methyl-7-hydroxychromone(3)。
化合物4:黄色粉末;1H NMR(600 MHz, DMSO-d6)δH:13.78(1H,s,5-OH),9.51(1H,s,4′-OH),8.06(1H,s,H-2),7.34(2H,d,J=8.6 Hz,H-2′,6′),6.78(2H,d,J=8.6 Hz,H-3′,5′)。13C NMR(150 MHz,DMSO-d6)δC:176.7(C-4),157.1(C-4′),155.2(C-5),151.8(C-9),150.9(C-2),130.1(C-2′,6′),122.1(C-1′),120.9(C-3),114.9(C-3′,5′),106.4(C-10),99.08(C-6),97.62(C-8)。上述数据与文献[15]一致,故鉴定化合物为染料木素(4)。
化合物5:土黄色粉末;1H NMR(600 MHz, DMSO-d6)δH:8.28(1H,s,H-2),7.95(1H,d,J=8.8 Hz,H-5),7.37(2H,dd,J=6.6,2.0 Hz,H-2′,6′),6.92(1H,dd,J=8.8,2.2 Hz,H-6),6.86(1H,d,J=2.2 Hz,H-8),6.79(2H,dd,J=6.6,2.0 Hz,H-3′,5′)。13C NMR(150 MHz,DMSO-d6)δC:174.7(C-4),162.6(C-7),157.4(C-9),157.2(C-4′),152.8(C-2),130.1(C-2′, 6′),127.3(C-5),123.5(C-3),122.5(C-1′),116.6(C-10),115.2(C-6),114.9(C-3′, 5′),102.1(C-8)。上述数据与文献[16]一致,故鉴定化合物为大豆素(5)。
化合物6:白色粉末;1H NMR(600 MHz, DMSO-d6)δH:7.95(2H,d,J=7.4 Hz,H-3,5),7.55(1H,m,H-4),7.46(2H,m,H-2,6)。13C NMR(150 MHz,DMSO-d6)δC:157.4(C-1),129.2(C-3),128.2(C-5),118.2(C-2),116.0(C-4)。上述数据与文献[17]一致,故鉴定化合物为苯酚(6)。
2.2 α-葡萄糖苷酶抑制活性
评价了化合物1~6的α-葡萄糖苷酶抑制活性。实验结果显示化合物4和5对α-葡萄糖苷酶具有中等强度的抑制活性,EC50值分别为8.3和19.0 μmol/L。其余化合物没有表现出该活性(表1)。
2.3 ABTS自由基清除活性
评价了化合物1~6的ABTS自由基清除活性。实验结果显示化合物4和5表现出较强的ABTS自由基清除活性,EC50值分别为0.6和4.2 μmol/L,活性远远强于阳性对照维生素C(18.8 μmol/L)。化合物1和2则表现出一定的自由基清除活性,EC50值分别为46.4和30.0 μmol/L。化合物3和6未见该活性(表1)。

表1 化合物1~6的α-葡萄糖苷酶抑制活性和抗氧化活性Table 1 α-glucosidase inhibitor activity and antioxidant activity of compounds 1-6
3 讨 论
本研究对植物内生真菌F4a的次级代谢产物进行了分离和鉴定,共得到6个单体化合物。化合物2最初从海洋来源真菌Leptosphaerulinasp.中发现[13],化合物3在海洋真菌Arthriniumsp. UJNMF0008和内生真菌PhomopsislongicollaHL-2232中被发现[18-19]。根据文献调研,化合物2和3均是首次从青霉属真菌中分离得到。
黄酮和异黄酮类化合物普遍被认为是植物适应长期生态环境变化而产生的多酚类次级代谢产物(如豆科植物绿豆、黄豆和黑豆等[20-21])。微生物作为这类化合物的潜在来源也时有报道[22],例如,化合物4(染料木素)和5(大豆素)均在Indonesian actinomyceteStreptomycessp. TPU1401A、lichen-associatedAmycolatopsissp. YIM 130642、Streptomycesxanthophaeus和termite-associatedActinomadurasp. RB99等放线菌[23-26]中被报道。截至目前,科学家已经在链霉菌中发现了产生类黄酮的生物合成基因,但尚未发现产生异黄酮的生物合成基因,所以很多学者认为黄酮和异黄酮可能是培养基来源的成分[22]。本研究中植物内生真菌F4a的培养基中含有千分之五的黄豆饼粉,所以推测化合物4(染料木素)和5(大豆素)更可能为培养基来源的成分。
生物活性测试结果发现,化合物1和2具有中等强度的抗氧化活性,化合物4和5表现出较强的抗氧化活性的同时还具有降血糖活性,然而化合物3和6未见抗氧化和降血糖活性。据报道,化合物1和化合物2具有中等强度的抗细菌活性[27-28]。此外,化合物1还被报道了单胺氧化酶和乙酰胆碱酯酶抑制等活性[29-30]。据文献检索可知,本研究首次报道了化合物1和2的ABTS自由基清除活性,为抗氧化药物的研发提供了新的参考。

