盐胁迫对花生种子际细菌菌群结构的调控
徐 扬, 张冠初, 丁 红, 秦斐斐, 张智猛, 戴良香
(山东省花生研究所,山东 青岛 266100)
花生是重要的油料作物,花生油产量约占植物油总产量的25%,是我国食用植物油的重要组成部分之一[1]。随着社会的发展和人民生活水平以及膳食结构的改善,食用植物油需求量每年以10%的幅度增加。加之我国对粮食需求的刚性增长,粮食作物与油料作物争地矛盾日益凸显,保持花生种植面积、提高花生产量尤为重要。我国盐碱地分布辽阔,面积约为3.6×107hm2[2],由于盐浓度和土壤水势较高、肥力瘠薄,严重制约了绝大部分作物的生长和种植。花生属豆科根瘤固氮作物,耐瘠抗旱,并具备较强盐碱耐受能力(可耐受盐浓度0.35%~0.45%),是目前盐碱地区较适宜种植的经济油料作物[3-4]。种子萌发是一个复杂变化的过程,该过程起始于种子的吸水膨胀,结束于胚根出芽,是植物生命周期的初始阶段,决定了整个生命过程的成败[5-6]。种子萌发阶段对盐胁迫最为敏感[4-7],较高的土壤盐分含量会在种子周围形成高渗透势、过度离子毒害(Na+和Cl-)[8-9],导致种子活力减弱,发芽率降低,萌发出苗时间延长,甚至被完全抑制[7,10]。种子际微生物菌群的变化也与种子萌发密切相关,但目前研究相对较少,具体分子机制尚不清楚[11]。种子际是指种子周围1~10 mm的微域环境,特指种子、土壤、微生物共同的作用区域[12]。种子萌发起始于吸胀吸水过程,种子中的养分和分泌物同时被释放到种子周围的土壤中,引起土壤中的物理和化学性质的改变,从而影响微生物的种类和数量,而微生物菌群的变化又会反效应影响种子萌发[13]。盐胁迫除能产生渗透胁迫和离子毒害外,还能够改变种子际微生物的菌群结构,从而影响种子萌发和胚根生长。之前的研究表明盐胁迫能提高萌发后期种子际芽胞杆菌属(Bacillus)和Pseudarthrobacter的相对丰度,其中芽胞杆菌属可能参与调控种子际土壤磷酸酶活性,增强盐胁迫条件下花生种子际土壤中磷营养元素的释放,从而提高盐胁迫下花生胚根伸出率[14]。张智猛等[12]研究表明盐胁迫能提高种子际微生物多样性,但不同类型盐碱土土壤微生物菌群结构差异大,可能与不同类型土壤花生种子际土壤含盐量、有机质含量、pH和电导率等因素有关。研究表明,种子萌发过程中,其分泌物数量、类型及释放速率不断变化,而分泌的第一个峰值就出现在吸胀开始后6~8 h[15]。本研究以耐盐和盐敏感花生品种为研究对象,在种子萌发初期吸胀吸水阶段设置盐胁迫处理,利用高通量测序技术对种子际土壤细菌种类和群体结构进行系统分析,旨在研究花生萌发初期种子际土壤养分和群落结构平衡对盐胁迫的响应,为盐碱地花生出苗、全苗、高产、优质栽培提供依据和技术指导。
1 材料与方法
1.1 材料
1.1.1 花生材料 选择花育25(HY25,耐盐品种)和花育20(HY20,盐敏感品种)为试验材料。供试土壤为山东省花生研究所莱西实验站耕地表层土,其基本理化性质:pH 6.7、EC 0.26 dS/m、有机质含量15.2 g/kg、全氮1.6 g/kg、速效磷(P)19.51 mg/kg、速效钾(K2O)102.5 mg/kg、土壤含水率9.7%。
1.1.2 试剂与设备 OMEGA土壤DNA提取试剂盒。智能人工气候箱(RXZ型多段编程,宁波江南仪器厂);超净工作台(hcb-900v,青岛海尔股份有限公司);自动高压灭菌锅(GF54DA,致微仪器有限公司);电子天平(AX124ZH/E,奥豪斯仪器有限公司);高速冷冻离心机(Neofuge15R,力康发展有限公司)。
1.2 方法
1.2.1 试验设计 试验在山东省花生研究所日光温室进行,土壤风干、过筛(3 mm孔径)混匀,于100 ℃烘箱中烘干至恒重后平均分成2份,一份无盐胁迫处理命名为CS,另一份设置NaCl盐胁迫处理质量比为NaCl∶烘干土壤=3∶1 000,盐胁迫处理命名为SS。将烘干后的原土和混有NaCl的土壤分别称重装入塑料盆钵,盆钵直径7 cm,高8 cm,每盆装土350 g,分别浇灭菌双蒸水80 g,置于人工培养箱(25 ℃,黑暗)中备用。播种前将种子用0.5%(质量分数)的次氯酸钠消毒,每盆播2粒,深度3 cm,保持种子横向,20次重复,于人工气候室中吸胀萌发(25 ℃,16 h光照/8 h黑暗,土壤湿度60%~70%)。播种后计时,于8 h(快速吸胀吸水阶段)后分别采集种子际土壤样本[12,16]。将盆钵土壤移至灭菌的锡箔纸上,在超净工作台上采取种子周围1~10 mm土壤至无菌袋中封存。每6个土壤样品混合作为1个生物学土壤重复样本,共进行3次生物学重复。非盐胁迫处理(对照,即不播种种子的CS土壤)重复样本分别命名为CS1、CS2、CS3,盐胁迫处理(不播种种子的SS土壤)重复样本分别命名为SS1、SS2、SS3。为了进一步区分HY25和HY20两品种的种子际样品,将HY25和HY20的种子际对照组样本分别标记为CS25-1、CS25-2、CS25-3和CS20-1、CS20-2、CS20-3,盐胁迫样本分别标记为SS25-1、SS25-2、SS25-3及SS20-1、SS20-2、SS20-3。上述所有样品的菌群结构鉴定,由北京百迈克生物科技有限公司同批次进行。
1.2.2 16S rRNA测序 利用OMEGA土壤DNA提取试剂盒对所采集的土壤样本进行DNA提取,并对提取的土壤DNA进行浓度(分光光度计)和纯度(琼脂糖凝胶电泳)检测[17-18]。以土壤样本DNA为模板,利用引物338F(5′-ACTCCTACGGGAGGCAGCA-3′)和806R(5′-GGACTACHVGGGT-
WTCTAAT-3′)进行土壤细菌V3~V4区域扩增。PCR产物进行琼脂糖凝胶电泳并纯化后,利用HiSeq2500平台高通量技术进行250PE双端测序(Paired-End)。利用Trimmomatic软件对原始数据进行质控过滤,根据重叠关系将各种短序列在PANDAseq软件中进行拼接。将拼接后的序列在数据库中进行搜索比对,按照阀值进行归类,得到多个序列聚类操作分类单元OTUs(operational taxonomic units),利用RDP(Ribosomal Database Project)Classifier算法对每个样本的OTU进行分类学注释,得到基本分析结果[19]。
1.2.3 生物信息学分析 对细菌群落进行α多样性分析和丰度分析,基于16S rRNA高通量测序数据,通过PICRUSt10(phylogenetic investigation of communities by reconstruction of unobserved states)和KEGG(Kyoto Encyclopedia of Genes and Genomes)分析,预测花生种子际细菌菌群功能丰度谱。
2 结果与分析
2.1 花生种子际细菌群落测序数据和α多样性分析
过滤筛选共鉴定到高质量序列1 179 501条,大部分序列长度在400~430 bp之间。将相似性≥97%的序列定义为同一个OTU,聚类分析共得到1 006个OTU,其中SS数量最少(901),SS20数量最多(983)(图1A)。

图1 花生种子际细菌群落测序数据和α多样性分析Fig.1 Overall sequence data and alpha diversity analysis of peanut spermosphere soilsA:不同种子际土壤OTU统计表;B:稀释性曲线显示花生种子际细菌群落多样性;C:物种积累曲线显示花生种子际细菌基因测序深度;D:Rank Abundance曲线显示花生种子际细菌群落丰度和均匀度A: Operational taxonomic units (OTUs) of different spermosphere soil groups; B: Rarefaction curve analysis showing the bacterial community diversity in peanut spermosphere soils; C: Species accumulation curves showing the depth of 16S rRNA gene sequencing of peanut spermosphere soils; D: Rank Abundance curve showing the relative species abundance and evenness of the peanut spermosphere soils
对两品种种子际细菌菌群丰度和均匀度α多样性分析结果表明,稀疏性曲线(rarefaction curve)未能接近渐近线,说明细菌菌群的多样性较高(图1B)。随着测序样本数量的增加,鉴定到的新物种的数量也随之增加,物种积累曲线逐步趋于平缓,说明测序深度已足够(图1C)。Rank Abundance曲线可用来解释物种丰度和物种均匀度,在水平方向,物种的丰度由曲线的宽度来反映,物种的丰度越高,曲线在横轴上的范围则越大;曲线的平滑程度则反映了样本中的物种均度,曲线越平缓,反应物种的分布越均匀。如图1D所示,各土壤样本微生物类群的物种丰度和均匀性都较高(图1D)。综上,本次采集的所有种子际土壤样品均具有较高的物种丰度和多样性,可用于后续菌群结构和优势菌群分析。
2.2 种子际菌群结构差异分析
2.2.1 门水平菌落结构分析 由图2可知,盐胁迫处理的所有土壤样本的优势菌门均主要包括变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)及芽单胞菌门(Gemmatimonadetes)等,其相对丰度分别为47.48%~63.50%、9.02%~20.87%、8.66%~20.09%、4.31%~10.72%和2.28%~7.62%,占总菌量的80%以上(图2A)。盐胁迫处理后使厚壁菌门和放线菌门的相对丰度高于对照,HY25品种分别升高72.34%和15.23%,HY20分别升高45.83%和28.94%(图2A)。盐胁迫处理前后,不同花生品种种子际菌群变化幅度存在略微差异,然而变化趋势在门水平大体相似。

图2 各样本细菌群落结构Fig.2 Bacterial community structure of each sampleA:门水平花生根际细菌群落丰度;B:纲水平花生根际细菌群落丰度;C:目水平花生根际细菌群落丰度;D:科水平花生根际细菌群落丰度;E:属水平花生根际细菌群落丰度A: Percent of bacterial community abundance at the phylum level; B: Percent of bacterial community abundance at the class level; C: Percent of bacterial community abundance at the order level; D: Percent of bacterial community abundance at the family level; E: Percent of bacterial community abundance at the genus level
2.2.2 纲、目、科水平菌落结构分析 纲水平的分析结果显示,优势菌纲主要为芽胞杆菌纲(Bacilli)、β-变形菌纲(Betaproteobacteria)、γ-变形菌纲(Gammaproteobacteria)、α-变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)和鞘脂杆菌纲(Sphingobacteriia)(图2B)。其中,芽胞杆菌纲在盐胁迫处理后丰度提高,而鞘脂杆菌纲的丰度则降低(图2B)。目水平的分析结果显示,优势菌目主要为芽胞杆菌目(Bacillales)、伯克霍尔德氏菌目(Burkholderiales)、假单胞菌目(Pseudomonadales)和鞘脂单胞菌目(Sphingomonadales)(图2C)。盐胁迫处理使芽胞杆菌目的丰度提高,但降低鞘脂杆菌目的丰度。科水平的分析结果显示,优势菌科主要为芽胞杆菌科(Bacillaceae),其次为草酸杆菌科(Oxalobacteraceae)、假单胞菌科(Pseudomonadaceae)和肠杆菌科(Enterobacteriaceae),盐处理提高了芽胞杆菌科的相对丰度(图2D)。
2.2.3 属水平菌落结构分析 纵观所有层次分析结果,属层次上的变化差异最为明显。菌落结构分析显示所有菌属的相对丰度均小于20%,表明菌属数量较多,种子际土壤细菌菌群在属水平上的多样性较高(图2E)。优势菌属主要为芽胞杆菌属(Bacillus)、马赛菌属(Massilia)、Pseudarthrobacter和鞘氨醇单胞菌属(Sphingomonas)。其中,有益菌芽胞杆菌属在盐胁迫下的丰度显著提高,在HY25和HY20中较对照分别提高91.32%和53.44%;而芽单胞菌属(Gemmatimonas)的相对丰度则明显降低,分别对应下降56.71%和33.01%(图2E)。据此推测芽胞杆菌属细菌可能具有较强的盐胁迫耐受性,其相对丰度的提升对盐胁迫环境下的种子萌发有利。
2.3 β多样性分析
PCA分析(Principal Component Analysis)即主成分分析,是一种有效的研究数据相似性或差异性的可视化方法,且可轻松观察个体或群体间差异。如图3A所示,不同样本间分布较分散,说明各样本间菌群结构存在较大差异,但同一样本3次重复间的分布却很紧密,说明技术重复间差异较小,同时也说明取样较合理。进一步的样品聚类结果显示,除CS25-3存在较小的实验误差外,其余所有样本3次重复均能聚集到同一分支,不同样本聚集于不同分支,距离较远,差异较大(图3B)。ANOSIM分析结果显示(图3C),不同样本菌群结构存在显著差异(R2=0.575,P=0.001)。表明盐胁迫影响种子际土壤中的细菌菌群的组成,耐盐花生品种和盐敏感花生品种间的群落结构存在差异,可能与其分泌物有关。
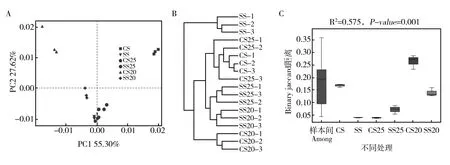
图3 花生根际细菌群落β多样性分析Fig.3 β diversity analysis of bacterial communities in the peanut rhizosphereA: 主成分分析;B: 聚类分析,每个样品3次生物学重复;C: ANOSM分析A: Principal component analysis (PCA); B: Hierarchical clustering analysis. Per soil-treatments were performed with three replicates; C: Analysis of similarities (ANOSIM)
2.4 盐胁迫对种子际菌群结构特异性调节
LEfSe(Line Discriminant Analysis (LDA) Effect Size)可以根据设定的Biomarker筛选标准(LDA score>3.5),在不同样品间寻找具有统计学差异的Biomarker,是进行组间差异显著性分析的常用方法。非盐胁迫处理未播种子的空白土壤中,拟杆菌(从门到属分别为Bacteroidetes、Sphingobacteriia、Sphingobacteriales、Chitinophagaceae和Flavisolibacter)以及芽单胞菌(从门到属分别为Gemmatimonadetes、Gemmatimonadetes、Gemmatimonadales、Gemmatimonadaceae和Gemmatimonas)显著富集;而在盐胁迫处理的空白土壤中,厚壁菌门和放线菌门的含量显著增高,说明在门水平中,厚壁菌门和放线菌门是盐胁迫响应中的重要菌群。而在不同品种的种子际土壤中的特异菌群也存在着明显差异,如HY25种子际对照土壤样本中,酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)为优势菌群,而盐处理的HY25样本中,变形菌(从纲到属分别为Betaproteobacteria、Burkholderiales、Oxalobacteraceae和Massilia)为优势菌群。HY20种子际对照土壤中,变形菌(从门到属分别为Proteobacteria、Gammaproteobacteria、Enterobacteriales、Enterobacteriaceae和Pantoea)含量丰富,而盐处理后的优势菌群变为蓝藻细菌门(Cyanobacteria)和Saccharibacteria(图4)。LEfSe分析结果显示,盐胁迫处理前后,不同花生品种的种子际土壤优势菌群变化趋势差别较大,说明盐胁迫和花生品种均与种子际菌群结构密切相关。

图4 盐胁迫下花生种子际细菌的群落组成Fig.4 Cladogram showing specific phylotypes of bacterial community compositions of peanut spermosphere responding to salt stress圆圈表示从门到属的系统发育水平(从外圈到内圈),每个圆的直径与菌群的丰度成正比Circles indicate phylogenetic levels from phylum to genus (from the outer circle to the inner circle), the diameter of each circle is proportional to the abundance of the bacterial group
2.5 16S功能预测
通过PICRUSt10对OTU丰度表进行标准化,观测不同样品间微生物群落的功能基因在代谢途径上的差异和变化,从而研究种子际菌群为适应环境变化而发生的代谢功能改变情况。一些重要的胁迫应激活动(信号转导机制、免疫系统和防御机制)在盐胁迫处理的样本中略有提高(图5),可能与种子际菌群的胁迫应激有关,该过程可能是微生物帮助花生种子应对盐胁迫的重要机制之一。

图5 花生种子际细菌代谢功能特点Fig.5 Metabolic functional features of the peanut spermosphere bacterial communityA:COG分析各花生种子际土壤类群和空白土壤类群中代谢功能相对丰度和多样性,不同的COG分组以不同的颜色显示,如右侧所列;B:KEGG分析各花生种子际土壤类群和空白土壤类群中代谢功能相对丰度和多样性,不同的KEGG分组以不同的颜色显示,如右侧所列A: Bar chart showing the relative abundance and diversity of functional groups in various peanut spermosphere soil groups and bulk soil groups in the context of the Cluster of Orthologous Groups (COG) database. Different COG groups are displayed in different colors, as listed in the right. B: The Kyoto Encyclopedia of Genes and Genomes (KEGG) database showing the relative abundance and diversity of functional groups in various peanut spermosphere soil groups and bulk soil groups. Different KEGG groups are displayed in different colors, as listed in the right
3 讨 论
种子际包括在种子表面1~10 mm内受种子萌发影响的区域,是植物种子的特殊“微生态”,其中的微生物群落在种子萌发的短暂时间内瞬息万变,并在一定程度上具有时间、品种和环境的特异性[20]。据报道,种子际细菌菌群参与调控种子胁迫应答,对种子萌发具有一定的影响,但具体分子机制并不明朗[11,21-23]。然而,种子际土壤中的绝大多数微生物是不可培养的,一定程度上加大了对优势菌群的鉴定和分离难度。16S rRNA高通量测序能在一定程度上相对真实地反应种子际中微生物组成[24]。本研究在种子的快速吸胀吸水萌发阶段,结合16S rRNA测序分析发现,不同耐盐性品种种子际优势菌门均为变形菌门、厚壁菌门、放线菌门、拟杆菌门及芽单胞菌。本研究分类到变形菌门的物种数量在6个供试土壤样品中均最多,与前人研究结果相似[21]。盐胁迫下厚壁菌门和放线菌门的丰度均升高,但在两品种间无明显差异。在属水平上,HY25和HY20种子际中的芽胞杆菌属在盐胁迫后均增高,分别提高91.32%和53.44%,并是盐胁迫处理供试土壤样品的主要优势菌属,推测抗盐品种HY25的强抗盐能力可能与该菌株的大幅提升有密切联系。本研究中6个处理均采用同一土壤,不同品种和不同胁迫环境两种因素下对原土壤微生物菌群的改变程度可能较小,很难探索增强花生耐盐能力的具体种子际细菌菌属,田间种子际土壤采集实验条件需要进一步摸索,用以研究盐碱地花生种子际微生物菌群结构。另外,不同品种种内携带的不同微生物有可能会在萌发时释放成为种子际优势菌群促进种子耐盐,因而HY25和HY20种子内源微生物菌群组成需要进一步检测,不同品种耐盐能力的差异需要深入探究。
种子际土壤中的有益菌株和有害菌株均影响种子的萌发及植物的后续生长。研究表明种子际和根际的某些有益菌株对植物的生长发育具有重要的调节作用,如地衣芽胞杆菌(Bacilluslicheniformis)和解淀粉芽胞杆菌(Bacillusamyloliquefaciens)可以灭杀有害细菌,提高作物的抗病性[25-27]。巨大芽胞杆菌(Bacillusmegaterium)可以通过降解土壤中的有机磷,促进植物对磷素养分的吸收[28]。胶冻样芽胞杆菌(JellyBacilluslicheniformis)可以加快土壤中钾肥的释放,促进植物对钙、镁等元素的吸收[29]。胶质芽胞杆菌(ColloidBacilluslicheniformis)具有固氮作用,减少氮肥的用量,同时释放土壤中的磷钾,增强植物的抗逆性[30]。本研究发现,芽胞杆菌属在盐胁迫下的丰度明显提高,因此推测芽胞杆菌属可能作为有益菌属通过改善种子际的土壤微环境,增强盐胁迫条件下花生种子际土壤中氮磷钾钙镁等营养元素的释放和种子际微环境中离子平衡,抑制Na+和Cl-的离子毒害,从而提高萌发吸胀吸水阶段抗逆性。16S功能预测显示,盐胁迫影响花生种子际菌群的功能丰度谱,包括信号转导机制、免疫系统和防御机制等重要胁迫应激活动的功能,其在盐胁迫处理样本中均有所提高,这可能与花生种子萌发对盐胁迫耐受能力的提升有关[31]。协调种子际土壤有益菌和有害菌的平衡,对种子萌发及作物稳产增产至关重要。进行种子际有益菌株分离、纯化与培养,深入解析其在种子萌发吸胀吸水阶段应对盐胁迫的机制,为通过种子包衣途径改善种子际微生态环境、提高种子萌发出苗健苗率,以及增强种子萌发阶段对盐胁迫耐受性提供参考。