添加芦荟汁对红葡萄酒发酵的抑菌效果
李 杰, 马 雷, 张 雪, 张 烨, 孙玉梅, 李宪臻
(大连工业大学 生物工程学院,辽宁 大连 116034)
葡萄酒发酵没经过原料杀菌,无论是自然发酵还是接种外源酵母的接种发酵,都有葡萄自身携带的微生物(内源微生物)参与,为了抑制危害葡萄酒发酵的微生物作用,常采用二氧化硫(SO2)做为抑菌剂。SO2不仅能控制葡萄酒的微生物腐败和氧化,还有利于释放葡萄皮中酚类化合物,稳定葡萄酒色泽[1]。但是,SO2可能会引起人肺水肿、窒息、昏迷,还会影响人体对钙的吸收。因此,SO2最大摄入量为0.7 mg/(kg·d),我国规定葡萄酒中总SO2含量不得超过250 mg/L,欧美限制其用量低于100~150 mg/L[2]。研究者们在寻找SO2替代品方面做了大量探索[3],诸如二碳酸二甲酯[4]、胶体银[1]、酚类物质[5]和一些天然替代品包括黑萝卜提取物[6]、壳聚糖[7]、那他霉素[8]、溶菌酶[5]和细菌素[9]等。近年来,天然替代品由于其环境友好性和食用安全性而受到特别关注。芦荟系百合科(Liliaceae)芦荟属(Aloe)多年生多肉植物,有500多个品种,但仅库拉索芦荟(Aloevera)、木立芦荟(Aloearborescens)和斑纹芦荟(AloeveraLinn Chinensis)等少数品种食用安全,并被广泛种植、研究和应用[10-12]。芦荟叶片含有多糖、蛋白质、氨基酸、维生素、蒽醌类、芦荟素、大黄素和酚类化合物等生物活性化合物[13-14],具有较强地抑制多种微生物、抗氧化、促进伤口愈合、镇痛、降压、通便、调节免疫系统、抗糖尿病、抗炎、抗肝炎、抗胃溃疡和抗肿瘤等生理活性[13,15-19]。因此,芦荟及其制品被广泛用于医药和食品领域[15,20]。比如,直接作为蔬果表面涂膜的芦荟叶肉凝胶,对防止蔬果腐烂和抗真菌效果良好,且A.arborescens比A.vera更有效[13,16-19];功能各异的含芦荟或芦荟制品的医药保健品、洗涤剂;芦荟表皮内的叶肉凝胶广泛用于护肤化妆品;芦荟叶或芦荟凝胶汁制成的芦荟奶、芦荟酒、芦荟葡萄酒、芦荟果蔬汁饮品、芦荟糖果等,甚至芦荟叶可直接做为菜肴[10-12];芦荟叶加糖发酵制成芦荟酒,在成品葡萄酒中加入芦荟凝胶或制品制成芦荟葡萄酒。目前还没有关于A.arborescens在葡萄酒发酵中替代SO2的报道。 鉴于芦荟的抗菌、抗氧化活性以及芦荟叶肉凝胶比表皮的色素和单宁含量少,在葡萄酒发酵中添加20、50和80 g/L的A.arborescens叶肉凝胶汁,其中添加80 g/L的芦荟汁表现出对葡萄酒发酵系统的酵母菌、细菌和霉菌最强的抑制作用以及最慢的糖消耗[21]。为了有效抑制不良微生物,避免发酵迟缓,在葡萄酒自然发酵和接种发酵中添加 80 g/L 芦荟汁和60 mg/L SO2进行进一步比较研究,通过比较发酵过程中微生物菌群变化、乙醇和乙酸含量以及酸度变化和发酵得到的葡萄酒理化指标,初步评价在葡萄酒发酵中芦荟汁替代SO2的可能性。本研究对提高葡萄酒的安全性以及开辟芦荟的应用途径具有价值和意义。
1 材料与方法
1.1 材料
1.1.1 试验材料 2015年10月5日于河北昌黎采摘的赤霞珠葡萄(Cabernetsauvignon),本实验室(大连市生物催化工程实验室)盆栽约生长5年的木立芦荟(Aloearborescens)。活性干酵母菌Zymaflore ST,法国J. lafford & Cie产品。
1.1.2 培养基 肉汤琼脂培养基;YEPD琼脂培养基;察氏琼脂培养基。所用培养基均121 ℃灭菌20 min,降温后加入0.22 μm膜过滤除菌的抗生素,在肉汤琼脂培养基添加0.012 5%制霉菌素;在YEPD琼脂培养基和察氏琼脂培养基中添加32 000 U/L青霉素和40 000 U/L链霉素,混匀后倒入直径9 cm的培养皿中,培养基厚度为5 mm。
1.1.3 主要试剂与仪器设备 实验用化学试剂分别为化学纯、分析纯及色谱纯。分光光度计(722S,上海精密科学仪器有限公司);气相色谱仪(Agilent6850,安捷伦科技有限公司);色谱柱(DB-FFAP,30 m×0.25 mm×0.25 μm,安捷伦科技有限公司);离心机(HITACHI CR21 GⅢ,日本日立工机株式会社);生化培养箱(SHP-350,上海精宏实验设备有限公司)。
1.2 方法
1.2.1 木立芦荟汁的制备 取芦荟植株的新鲜叶片,自来水冲洗,室温自然干燥。划开绿色外皮,分离出内部无色的软细胞组织,并经组织捣碎机捣碎成芦荟汁,测含水量98.43%,总糖含量0.48 g/kg(以葡萄糖计),pH值4.31。
1.2.2 活性干酵母菌的活化 将2 g活性干酵母菌溶解在10 mL无菌水中,40 ℃保温15 min,每5 min搅拌1次,补加10 mL葡萄汁,25 ℃保温1 h,每30 min搅拌1次。
1.2.3 发酵 将未破损、无病的鲜葡萄去梗破碎后,均匀分装于1 000 mL锥形瓶,每瓶装450 mL葡萄浆,棉塞封口,发酵48 h后换成发酵栓。测得葡萄浆还原糖含量167.58 g/L(以葡萄糖计),总酸度 5.25 g/L(以酒石酸计),pH值3.63。发酵分为不接种的自然发酵和添加200 mg/L商业酵母菌(即2 mL活化酵母菌)的接种发酵。两个发酵组分别添加终浓度为60 mg/L SO2和80 g/L 芦荟汁,以添加无菌水为对照,3个处理的添加总体积相等,使葡萄浆稀释度相同。15~18 ℃静态发酵28 d,每天两次手动摇瓶30 s。
1.2.4 微生物计数 在葡萄酒发酵过程中,每4 d取样测定1次,取样前,混匀发酵液,无菌条件下取样,采用平板培养菌落计数法测定样品中活菌数量(cfu/mL)。用0.85% (质量分数) NaCl溶液稀释发酵样品,取不同稀释度样品0.1 mL均匀涂布于无菌的琼脂平板上,30 ℃培养至平板上的菌落数量基本不变(平板菌落数25~250 cfu/mL)。在添加0.012 5%制霉菌素肉汤琼脂培养基中测得细菌量;分别在添加32 000 U/L青霉素和40 000 U/L链霉素的YEPD和察氏琼脂培养基中,根据菌落形态测得酵母菌量和霉菌量[19]。
1.2.5 样品处理 将发酵结束的葡萄酒4 ℃、8 000 r/min 无菌离心10 min,得到的上清液用去离子水稀释用于理化分析。
1.2.6 理化分析方法 用0.1 mol/L NaOH滴定至pH值8.2测定酸度(以酒石酸计)。3,5-二硝基水杨酸法检测还原糖含量(以葡萄糖计)[22]。苯酚-硫酸法测定芦荟多糖含量[12]。将去离子水稀释10倍的样品用1 cm比色皿于420、520和620 nm波长测定的吸光度A420、A520和A620的总和为样品色度[23],420 nm测得的吸光度A420为褐变度[24]。采用气相色谱外标法测定样品的乙醇、乙酸、乙醛、高级醇和酯含量,将2 μL固相微萃取的样品注入加热至250 ℃的进样室。FID检测器保持在250 ℃。N2为载气,柱压为0.05 MPa,流量为10 mL/min,空气流量为300 mL/min, H2为30 mL/min。分流比为10∶1。色谱柱温度在40 ℃持续5 min,以5 ℃/min提高到190 ℃,保持1 min,然后以20 ℃/min提高到230 ℃,维持2 min[22]。
1.2.7 感官品评 由受过培训的8 人对各种实验条件发酵结束后的葡萄酒进行初步感官品评,品评标准见表1,各项得分加和得到酒样的感官评价总分。

表1 发酵结束的葡萄酒感官评价标准Table 1 Sensory evaluation criteria for the final wine
1.2.8 统计分析 所有的发酵和测量均平行实验3次,测定结果表示为3个独立实验的平均值±标准差。采用IBM SPSS17.0统计软件,通过方差分析(ANOVA)确定数据差异显著性,概率水平P<0.05。
2 结果与分析
2.1 添加芦荟汁对葡萄酒发酵过程中酵母菌量的影响
由表2可知,接种发酵比自然发酵的酵母菌生长快。自然发酵和接种发酵的添加组与对照组以及添加组之间普遍无显著差异,只在自然发酵第4天,添加芦荟汁组的酵母菌量显著高于添加SO2组;仅在接种发酵16~20 d,添加芦荟汁组的酵母菌量显著高于对照组,且与添加SO2组的酵母菌量无显著差异。仅在发酵第4天,接种发酵与自然发酵间的酵母菌量差异显著,接种发酵添加SO2组和对照组的酵母菌量高于自然发酵对应组。

表2 在葡萄酒自然发酵和接种发酵过程中的酵母菌菌量变化(log cfu/mL)Table 2 The variation of yeast counts during spontaneous wine fermentation and inoculated wine fermentation (log cfu/mL)
结果表明,在葡萄酒发酵系统中,添加芦荟促进内源酵母菌和接种酵母菌生长,SO2抑制内源酵母菌生长。尽管接种酵母菌、添加芦荟汁和添加SO2使发酵过程中的酵母菌量有差异,但随发酵时间的延长,不同发酵系统的酵母菌量渐无差异。
2.2 添加芦荟汁对葡萄酒发酵过程中细菌量的影响
由表3可知,在自然发酵的前4 d,细菌量快速增加,随后减少,依对照组、添加SO2组、添加芦荟汁组的顺序而降低。在接种发酵的过程中,细菌量始终无增加,添加SO2组发酵第4天和第8天的细菌量较低,添加芦荟汁组发酵第16天的细菌量较低,其他时间各添加组间无显著差异。在发酵前12 d,自然发酵的细菌量显著高于接种发酵相应添加组,而在发酵16 d后,发酵组内添加组间和发酵组间无显著差异,发酵20 d后的细菌量减少到无检出。结果表明,在葡萄酒发酵系统中,接种酵母菌、添加芦荟汁和添加SO2显著抑制细菌生长,SO2比芦荟汁对细菌生长的抑制作用大。

表3 在葡萄酒自然发酵和接种发酵过程中的细菌量变化(log cfu/mL)Table 3 The variation of bacteria counts during spontaneous wine fermentation and inoculated wine fermentation (log cfu/mL)
2.3 添加芦荟汁对葡萄酒发酵过程中霉菌量的影响
由表4可知,在自然发酵和接种发酵过程中,霉菌均未生长,霉菌量快速减少,自然发酵12 d后和接种发酵8 d后霉菌量下降到无检出。自然发酵添加芦荟汁组和添加SO2组的霉菌量显著低于对照组,添加SO2组的霉菌量显著低于添加芦荟汁组,显著高于接种发酵的对应添加组。结果表明,在葡萄酒发酵系统中,霉菌不占据生长优势,很快被其他微生物的生长和代谢所抑制,接种酵母菌比内源微生物对霉菌的抑制作用大,SO2比芦荟汁对霉菌的抑制作用大。

表4 在葡萄酒自然发酵和接种发酵过程中的霉菌量变化(log cfu/mL)Table 4 The variation of molds counts during spontaneous wine fermentation and inoculated wine fermentation (log cfu/mL)
2.4 添加芦荟汁对葡萄酒发酵过程中乙醇和乙酸含量及酸度的影响
乙醇是葡萄酒发酵的主要产物。由表5可知,接种发酵均比自然发酵对应组的乙醇产量高。在自然发酵过程中,与对照组比,添加SO2组和添加芦荟汁组前期产乙醇较少,而后期产乙醇较多;添加SO2组比添加芦荟汁组产乙醇少。而在接种发酵过程中,添加芦荟汁组的乙醇产量普遍高于对照组和添加SO2组,添加SO2组前期乙醇产量低于添加芦荟汁组和对照组,而后期多高于对照组。可见,接种酵母菌比添加SO2和添加芦荟汁更能促进发酵产乙醇;SO2抑制发酵前期产乙醇,促进后期产乙醇;芦荟汁抑制自然发酵前期产乙醇,促进自然发酵后期和接种发酵产乙醇。添加芦荟汁和添加SO2对自然发酵产乙醇的作用基本同向,只是作用程度不同;而芦荟汁和SO2对接种发酵前期产乙醇的作用相反。芦荟汁比SO2对最终乙醇产量的促进作用大。在本研究的芦荟汁用量下,芦荟多糖对发酵系统的糖含量影响很小,主要是对微生物量和活性的影响引起的乙醇产量差别,这进一步说明芦荟汁对接种酵母菌生长和产乙醇代谢的促进作用较大,提高内源酵母菌后期产乙醇的能力,也可能提高酵母菌的乙醇耐受力。

表5 在葡萄酒自然发酵和接种发酵过程中的乙醇含量变化(g/L)Table 5 The variation of ethanol contents during spontaneous wine fermentation and inoculated wine fermentation (g/L)
由表6可知,接种发酵的乙酸产量均低于自然发酵对应组。自然发酵添加芦荟汁组的乙酸产量与对照组相近,而高于添加SO2组。接种发酵添加芦荟汁组的乙酸产量高于对照组和添加SO2组。可见,接种发酵能显著抑制微生物代谢产乙酸。SO2抑制自然发酵产乙酸,对接种发酵过程产乙酸也有抑制作用,但不影响乙酸终产量;芦荟汁不抑制自然发酵产乙酸,但促进接种发酵产乙酸。乙酸是葡萄酒发酵的主要副产物,主要由产乙酸的细菌和一些非酿酒酵母菌代谢生成[25],芦荟汁能抑制细菌和霉菌生长,但对产乙酸微生物的选择性抑制可能较弱,或对微生物产乙酸代谢途径的抑制作用较弱,而SO2和接种酵母菌对产乙酸微生物的生长和代谢均有较强的抑制作用。
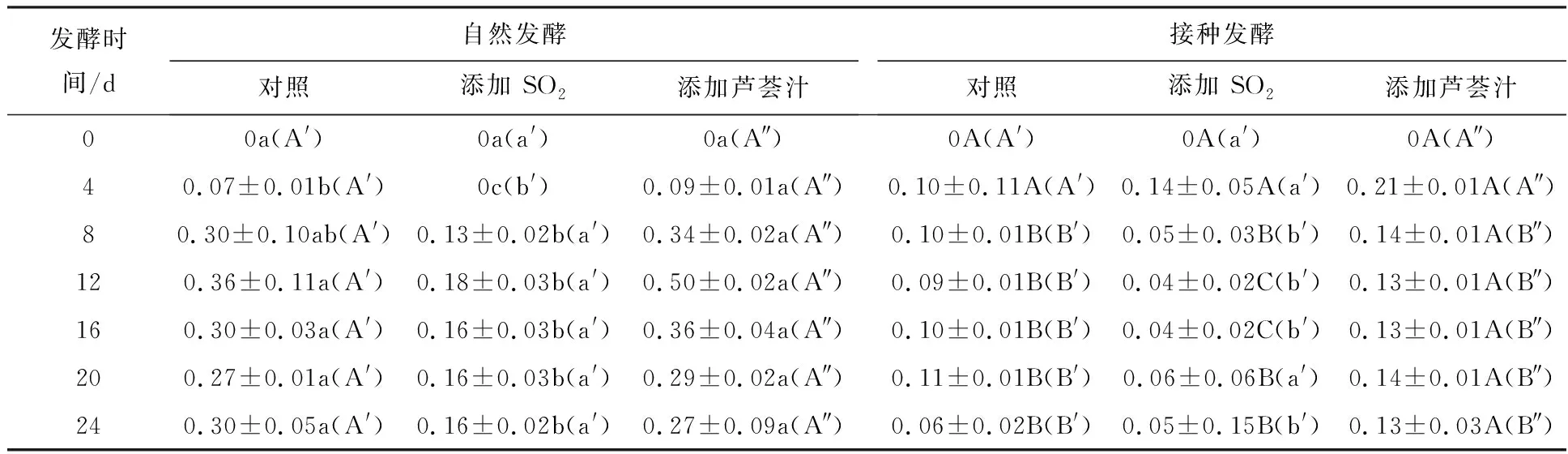
表6 在葡萄酒自然发酵和接种发酵过程中的乙酸含量变化(g/L)Table 6 The variation of acetic acid contents during spontaneous wine fermentation and inoculated wine fermentation (g/L)
由表7可知,在自然发酵和接种发酵过程中,前期酸度变化总趋势为先升高,后期酸度下降,但接种发酵酸度始终高于初始值,而自然发酵后期酸度均低于初始值。自然发酵的前期酸度升降波动较大,与对照组比,添加SO2组和添加芦荟汁组虽然酸度最大值较低,但后期酸度下降较少。对接种发酵而言,与对照组比,添加SO2组和添加芦荟汁组前期酸度升高较慢,后期酸度下降较少。添加芦荟汁组的酸度变化比较平稳,升降波动较小。接种发酵的酸度普遍高于自然发酵对应组。结果表明,SO2和芦荟汁能减小自然发酵和接种发酵的后期酸度下降,芦荟汁使酸度变化较平稳,接种发酵能提高酸度。在葡萄酒发酵过程中,微生物利用葡萄浆中的还原糖(主要是葡萄糖和果糖)经代谢途径产生多种有机酸,使酸度升高。微生物也会利用葡萄浆自身的酒石酸、苹果酸和柠檬酸,酒石酸不溶于乙醇,发酵过程中随着乙醇生成量增多,酒石酸会形成沉淀[26],这些作用又会使酸度下降。因此,发酵过程中酸度的变化是底物消耗和产物生成的综合效果。添加芦荟汁发酵酸度较高可能与芦荟汁促进产乙酸有关,接种发酵酸度较高与酵母菌量大和代谢旺盛有关。

表7 在葡萄酒自然发酵和接种发酵过程中的酸度变化(g/L)Table 7 The variation of acidity during spontaneous wine fermentation and inoculated wine fermentation (g/L)
2.5 添加芦荟汁对葡萄酒发酵结果的影响
由表8可知,与对照相比,添加芦荟汁和添加SO2同样促进发酵耗糖和提高葡萄酒的感官质量,不影响自然发酵的葡萄酒色度,促进接种发酵产高级醇和酯,添加SO2比添加芦荟汁更促进耗糖和接种发酵产高级醇和酯。添加芦荟汁降低葡萄酒褐变度和接种发酵的葡萄酒色度,而添加SO2的作用相反。添加芦荟汁促进产酯并抑制自然发酵产乙醛和高级醇,而添加SO2在相关方面无显著影响。自然发酵的总耗糖量和产酯量大于接种发酵;接种发酵的高级醇产量以及葡萄酒色度和褐变度大于自然发酵。
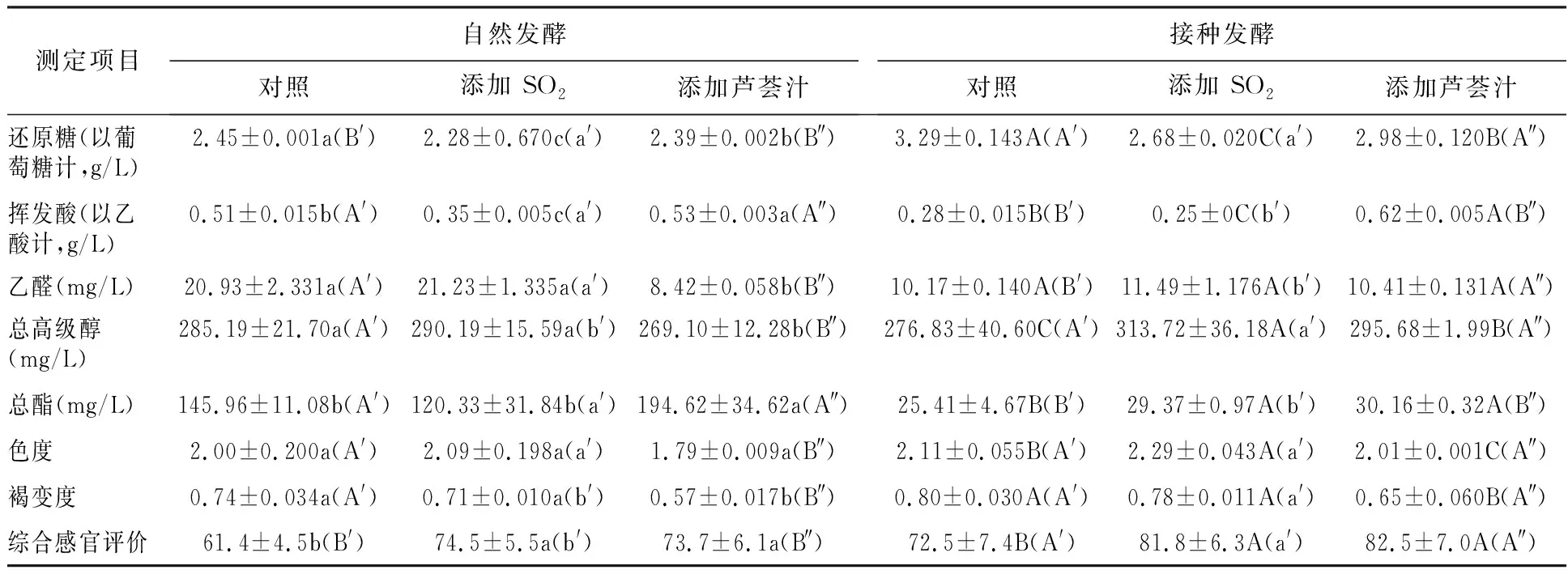
表8 通过自然发酵和接种发酵生成的葡萄酒特性Table 8 The characteristics of wine produced by spontaneous fermentation and inoculated fermentation
添加芦荟汁不仅会降低葡萄酒色度并提高乙酸和挥发酸含量,还能降低葡萄酒褐变度,促进产酯和降低自然发酵高级醇产量,更突出的是,添加芦荟汁比对照和添加SO2发酵的葡萄酒的口感更清新、爽口、苦味更淡。因此,添加芦荟汁和添加SO2发酵的葡萄酒的综合感官评价相近,甚至前者略好。
3 讨 论
葡萄酒发酵系统中的多种微生物,由来自原料葡萄的内源微生物(主要是酵母菌、细菌和霉菌)和接种的外源微生物构成。酵母菌对葡萄酒酒精发酵起主要作用,自然发酵的酵母菌均为内源的,而接种发酵的酵母菌既有内源又有外源的。SO2对葡萄酒发酵系统中的霉菌和细菌的抑制作用最大,特异性抑制醋酸菌和乳酸菌,50 mg/L SO2几乎完全抑制对发酵不利的尖端酵母菌,而酿酒酵母菌对SO2有很强的抗性,SO2对其抑制浓度可高达1 200 mg/L[1]。根据酿酒葡萄的品种及状态,发酵初期添加30~150 mg/L SO2,可抑制非酿酒酵母菌、细菌及霉菌生长,保障酒精发酵[7]。
本研究结果表明,接种的酵母菌抑制了内源细菌和霉菌生长,在接种发酵中快速生长,而在自然发酵中内源酵母菌抑制内源细菌和霉菌生长,占生长优势。添加芦荟汁有助于酵母菌生长和产乙醇代谢。添加芦荟汁和添加SO2均能显著抑制细菌和霉菌生长,且SO2比芦荟汁的作用更强。曾有报道在葡萄浆中添加1 g/kg胶体银比添加50 mg/kg SO2的酵母菌量少[16],在较低品质的葡萄浆中添加400 mg/L壳聚糖比添加50 mg/L SO2的总酵母菌水平低[7],不同于本研究结果。在本研究的葡萄酒发酵生态环境中,添加芦荟汁有利于酵母菌而抑制内源霉菌和细菌,与同类研究结果一致[13,27]。A.arborescens富含β-多糖、维生素和矿物质,有作为益生元的潜力[28]。芦荟汁添加糖酿造芦荟酒的环境适于酿造酵母菌生长[27]。添加芦荟汁和添加SO2以及接种酵母菌除直接影响发酵系统微生物生长,还会因影响微生物生长导致系统内微生物代谢的差异,从而使代谢产物的种类和同种代谢产物(如乙醇、乙醛、乙酸等)的生成量不同。在发酵过程中,葡萄浆中的一些化合物(还原糖、氨基酸等)被不断消耗,芦荟汁成分和SO2的也会发生分子转化。发酵系统物质构成的变化和差异会进一步影响微生物种群。
尽管在酿造葡萄酒过程中添加胶体银会降低红葡萄酒的色素含量,增强白葡萄酒的氧化作用,但添加胶体银与添加SO2获得的葡萄酒表现出相似的化学和感官特征[1]。添加黑萝卜提取液与添加SO2对红葡萄酒有相似的抗氧化活性和挥发酸水平,通过降低SO2添加量改善了葡萄酒感官质量[6]。本研究添加芦荟汁与添加SO2发酵的葡萄酒综合感官评价相近,甚至前者略好,与上述同类研究有相近的效果。尽管发酵到一定阶段各发酵组和各添加组的酵母菌之间、细菌之间以及霉菌之间均无显著差异,但是发酵获得的葡萄酒在影响酒质量的指标上以及酒的感官质量上仍存在明显差异,可能应归因于发酵过程中不同组的微生物菌群差异导致的微生物代谢差异。即发酵过程的微生态差异对葡萄酒的成分和质量有着重要影响。因此,可以通过添加芦荟汁减少SO2的用量。
本研究结果虽然存在芦荟品种和酿酒葡萄品种以及技术条件的局限性,但对芦荟汁应用于葡萄酒酿造的研究有一定参考价值。由于芦荟汁含水量较高,芦荟汁的用法和用量还需要进一步探索,可以考虑使用芦荟汁浓缩液和芦荟提取物。进一步深入检测分析芦荟产品对酿酒葡萄中分离的不同内源微生物的抑菌活性,并加大发酵规模为生产应用提供参考。