复合碳源培养对酒糟厌氧消化液中丙酸互营氧化菌及群落结构的影响
孙晓娇, 谢彤彤, 迟明妹, 徐 艳, 陈光辉, 张培玉, 邱艳玲
(青岛大学 环境科学与工程学院,山东 青岛 266071)
我国白酒行业年产酒量仅2020年约为740 万t,按固态法生产1 t白酒约产生5 t酒糟,据此估计白酒酒糟年产量超过3 700 万t。酒糟的处理与资源化利用对推动白酒行业可持续发展具有重要意义。白酒糟是以高粱、大米或薯类为原料生产白酒后的残渣,富含粗蛋白、淀粉、脂肪、纤维和氨基酸等大量营养物质[1]。厌氧发酵是利用厌氧微生物的代谢作用去除固体废物中的有机物,同时产生能源甲烷的一项技术,也是处理酒糟的有效途径之一。目前关于酒糟作为单一发酵原料或者作为混合发酵原料的厌氧工艺及产气性能的研究较多。严寒等[2]研究发现白酒酒糟总固体含量(TS)在2.4%~8.5%(质量分数,下同)的范围内,有机负荷提升可以提高甲烷产气率和产气量。李金娟等[3]研究表明,温度40 ℃,TS为6%是小麦酒糟厌氧发酵的最适条件。单一底物由于自身性质的局限性,在厌氧发酵过程中常常会出现营养不平衡、微生物多样性较低等问题,进而导致发酵过程中抑制物积累、产气率低[4]。因此,为提高厌氧发酵过程的稳定性与产气效率,目前多采用酒糟与畜禽粪便等其他物料进行厌氧混合发酵。López González等[5]研究发现酒糟和甘蔗滤泥厌氧共消化比单一物料消化可提高64%的沼气产率。Wang等[6]利用酒糟和餐厨垃圾进行厌氧共消化的研究发现,TS比为8∶1时,甲烷产率最高为159.74 mL/g,与单独消化相比,共消化具有良好的协同效应。目前有关酒糟厌氧降解的工艺性能研究较多,而关于菌群的研究较少。酒糟厌氧发酵是多种微生物协同作用的结果,探索厌氧发酵系统中微生物群落组成及其动态变化对沼气工程稳定运行具有重要的指导意义。Ao等[7-8]对茅台酒糟中温及高温厌氧消化的稳定性能以及产气潜力进行了研究。通过对中温35 ℃厌氧微生物群落分析发现,蛋白质及氨基酸类利用菌Proteiniphilum和糖类利用菌Ruminococcus_2为优势产酸菌,norank_f_Synergistaceae、norank_o_DTU014和Syntrophomonas为优势厌氧互营菌,Methanosarcina、Methanobacterium和Methanosaeta为主要产甲烷菌属[7];同时对高温55 ℃条件下的厌氧微生物群落分析表明,高温氨基酸及有机酸降解菌Defluviitoga、未培养候补门Candidatus “Caldatribacterium”、糖类发酵菌Hydrogenispora和Acetomicrobium为优势产酸属,Methanosarcina和Methanothermobacter为主要产甲烷菌属。Ao等[8]研究表明,蛋白质、氨基酸、糖类和有机酸降解菌在酒糟中温及高温厌氧消化系统中发挥重要作用。目前,针对酱香型白酒糟厌氧发酵过程中的微生物群落解析及功能菌群的信息较少,极大限制了酒糟沼气工程的推广利用。丙酸降解被认为是厌氧消化过程的限速步骤[9]。此外,酒糟中富含大量的蛋白质及多种氨基酸[1]。本研究基于酒糟组成及厌氧发酵的限制因素,以丙酸和混合氨基酸为复合碳源,采用传统培养方法驯化培养丙酸-氨基酸降解微生物,利用高通量测序技术对驯化培养系中的微生物群落结构进行解析,鉴定厌氧互营丙酸降解菌,为推动酒糟产甲烷过程中关键功能菌群的认知提供依据。
1 材料与方法
1.1 材料
1.1.1 接种物沼液 酒糟原始沼液(JO)取自山东省平度市500 m3中试与产业化沼气工程示范基地,以酱香白酒糟为唯一发酵原料进行中温厌氧发酵,白酒糟取自贵州仁怀市酒厂[11]。
1.1.2 培养基 widdel培养基(g/L):KH2PO40.136,NH4Cl 0.535,MgCl2·6H2O 0.204,CaCl2·2H2O 0.147,NaHCO32.52,1 mL维生素溶液,1 mL微量元素溶液,蒸馏水1 000 mL,pH值7.0[10]。以氮气和二氧化碳混合气体(VN2∶VCO2= 80∶20)曝气,培养基高温高压灭菌。接种前加入0.25 g/L半胱氨酸和0.25 g/L硫化钠。
1.1.3 主要仪器与设备 位相差显微镜(Olympus BX51,日本);微量pH值计(B-12,日本HORIBA公司);气相色谱(SP-6890,鲁南瑞虹化工仪器有限公司);离子色谱分析系统(ICS-3000,Dionex, Sunnyvale, CA);恒温培养箱(MJX,宁波东南仪器有限公司);立式压力蒸汽灭菌器(YXQ-LS-50SII,上海博讯实业有限公司);超净工作台(VS-840-1,上海博讯实业有限公司);电子分析天平(AL104,瑞士梅特勒-托利多);离心机(1-14,德国SIGMA)。
1.2 方法
1.2.1 白酒糟厌氧发酵中间产物分析 采用批次试验考察白酒糟发酵过程中挥发性脂肪酸(VFAs)及氨基酸的含量。在有效体积为560 mL的厌氧反应瓶中加入120 mL培养液,取1 L沼液,用PBS磷酸缓冲液洗涤2次,离心收集菌体,按照80%(体积分数)的比例接种浓缩沼液。设置总固体含量(TS)为5%和7%的两个梯度。10 mmol/L 2-溴乙烷酸钠(2-BES)用于抑制产甲烷菌的活性,设置添加和不添加2-BES 两个培养系,每组3个平行[11],37 ℃培养箱静置培养,并定期测定VFAs及氨基酸浓度。
1.2.2 厌氧丙酸-氨基酸培养系的驯化及发酵特性丙酸-氨基酸培养系(JO-AP)的驯化采用酒糟原始沼液JO为接种物,取0.1 L沼液,用PBS磷酸缓冲液洗涤2次,离心后收集5 mL的菌体加入到含20 mL液体培养基的60 mL血清瓶中。以10 mmol/L丙酸和0.1 mmol/L混合氨基酸(赖氨酸、亮氨酸、异亮氨酸、缬氨酸、苏氨酸、甲硫氨酸、脯氨酸、精氨酸、组氨酸、丙氨酸、半胱氨酸和色氨酸,各氨基酸浓度均为0.1 mmol/L)作为复合碳源,于37 ℃黑暗培养箱中静置培养。当甲烷产气量达到最高值的50%左右时,传代,接种量为15%(体积分数)。丙酸-氨基酸富集培养系JO-AP经过1年驯化培养,开展产甲烷特性试验。将未加碳源的接种物在相同条件下进行厌氧消化作为空白对照,每组设置3个平行。实验周期为30 d,定期测定气相中甲烷和液相中VFAs的含量。
1.2.3 微生物观察、pH值、甲烷产量、挥发性有机酸和氨基酸测定 采用位相差显微镜进行微生物观察。微量pH值计测定pH值。气相色谱测定甲烷、挥发性有机酸[12]。离子色谱分析系统测定氨基酸[13]。
1.2.4 DNA提取、PCR扩增、测序及数据处理 采用苯酚-氯仿玻璃珠研磨法[14]提取DNA。细菌和古菌用带有barcode特异性引物515F (5′-GTGYCAGCMGCCGCGGTAA-3′)和806R (5′-GGACTACNVGGGTWTCTAAT-3′),针对16S rRNA基因的V4区进行PCR扩增[15]。PCR扩增及测序由上海美吉生物医药科技有限公司完成,使用Misseq PE300进行PCR产物测序。测序后数据分析由上海美吉生物云平台 (www.majorbio.com)完成。原始测序序列使用Trimmomatic软件质控,使用FLASH软件进行拼接[16]。利用mothur version v.1.30.1进行多样性指数(Alpha-diversity)、稀释曲线(Rarefaction curve)分析。
2 结果与分析
2.1 白酒糟厌氧发酵中间产物分析
白酒糟整个发酵周期内的挥发性有机酸及氨基酸的最高累积浓度见表1。比较两组不同TS的酒糟发酵过程可以看出,随着TS的增加,VFAs累积浓度升高。添加2-BES对中间代谢产物类型无影响。酒糟TS为5%时,未添加2-BES的培养系,丙酸最高累积浓度为39.07 mmol/L、乙酸为33.56 mmol/L、丁酸为5.16 mmol/L;添加2-BES培养系中,产甲烷菌的活性被抑制,导致中间产物持续累积,丙酸最高累积浓度为33.60 mmol/L、乙酸为94.49 mmol/L、丁酸为13.29 mmol/L。酒糟TS为7%时,未添加及添加2-BES的培养系中,丙酸最高累积浓度分别为60.68和41.62 mmol/L、乙酸分别为120.32和129.42 mmol/L、丁酸分别为42.08和44.29 mmol/L。酒糟富含粗蛋白,在厌氧消化过程中检测出了精氨酸、赖氨酸、丙氨酸、苏氨酸、甘氨酸、缬氨酸、丝氨酸、亮氨酸、组氨酸、甲硫氨酸、苯丙氨酸、谷氨酸、天冬氨酸、胱氨酸和酪氨酸共15种氨基酸,所有培养系中氨基酸浓度均在0.01~0.3 mmol/L之间(表1)。酒糟TS为5%或7%时,添加2-BES的培养系中,氨基酸浓度均略高于未添加培养系,如酒糟TS为5%时,精氨酸、甘氨酸和缬氨酸在添加2-BES时,浓度分别为0.30、0.17和0.17 mmol/L,高于未添加培养系的0.02、0.04和0.08 mmol/L。

表1 白酒糟厌氧发酵过程中间代谢产物最高累积浓度Table 1 Maximum concentration of intermediates in anaerobic fermentation of maotai-flavor stillage
2.2 厌氧丙酸-氨基酸降解培养系的驯化及发酵特性
以10 mmol/L丙酸和0.1 mmol/L混合氨基酸为复合碳源,经过1年的传代培养,获得厌氧丙酸-氨基酸培养系JO-AP。产甲烷潜力实验结果表明,丙酸在1个月的培养周期内被完全降解转化为甲烷,且伴随着中间产物乙酸的短暂积累(图1)。在培养的第20天甲烷达到最大值19.3 mmol/L;乙酸在第10天达到最高积累浓度5.2 mmol/L,随后逐渐降低,第20天完全降解。实验终点时培养液pH为7.3。
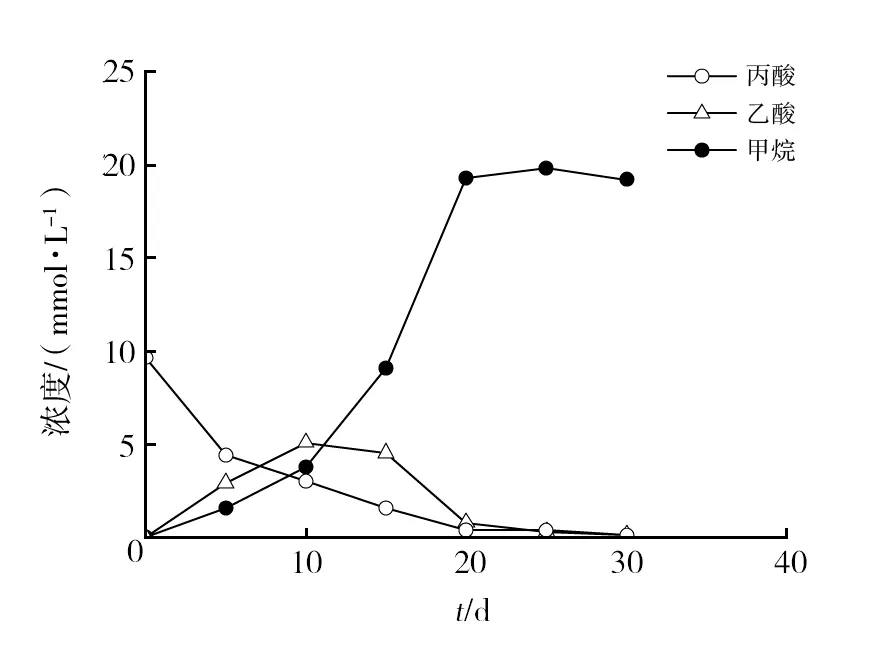
图1 丙酸-氨基酸培养系JO-AP厌氧丙酸降解过程Fig.1 Anaerobic propionate degradation by propionate-amino acid enrichment JO-AP
前期利用酒糟原始沼液JO为接种物,以丙酸为唯一碳源进行驯化培养时,10 mmol/L丙酸完全转化为18.9 mmol/L的甲烷,并且在接种后的第30天累积产甲烷量达到最大[11]。这表明复合氨基酸的加入促进了厌氧丙酸降解菌产甲烷的速率。
位相差显微镜观察结果(图2)显示,短棒状产孢子微生物占优势,推测其可能是培养系中重要的丙酸降解功能菌。

图2 丙酸-氨基酸培养系JO-AP位相差图片Fig.2 Phase contrast micrograph of propionate-amino acid enrichment JO-AP
2.3 细菌和古菌统计学分析
采用高通量测序技术分析丙酸-氨基酸培养系中的微生物群落结构。Chao指数表示微生物群落分布丰度,数值越大,表明微生物群落丰度越高。Shannon指数用于表示微生物群落的多样性,数值越大,表明样品微生物群落多样性越高。Coverage指数用于表示微生物群落的覆盖度,数值越大,群落多样性越高[17]。
对细菌和古菌16S rRNA基因的V4高变区测序,得到有效序列70 968条,Shannon指数为2.32,Chao1指数为75,所有样本的覆盖率均大于99%,说明样品序列深度足够,能全面解析厌氧发酵过程中微生物群落变化的真实情况。样品稀释曲线如图3所示。在试验的测序深度下,曲线最终趋于平缓,更深的测序量不会产生太多的新物种,表示丙酸-氨基酸培养系JO-AP中的细菌和古菌基本上都被测出。

图3 丙酸-氨基酸培养系JO-AP中丰度实际观测值(Sobs)的稀释性曲线Fig.3 Rarefaction curves of observed species of propionate-amino acid enrichment JO-AP
2.4 细菌群落解析
细菌16S rRNA基因序列通过与Silva数据库、NCBI数据库比对,样本中丰度占比小于1%的物种归为其他。丙酸-氨基酸培养系JO-AP中细菌群在门分类水平主要有互养菌门(Synergistetes)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、热袍菌门(Thermotogae)、未培养阴沟单胞菌门“Cloacimonetes”、变形菌门(Proteobacteria)和螺旋菌门(Spirochaetes)等7个类群(图4A)。属分类水平共得到12个属(图4B),分别为Acetomicrobium、Tepidanaerobacter、Pelotomaculum、JGI-0000079-D21、Proteiniphilum、Ddfluviitoga、Spirochaetaceae、Desulfovibrio、Mesotoga、Pseudomonas和未培养阴沟单胞菌门“Cloacimonetes”(WWE1)中的W5及W27。
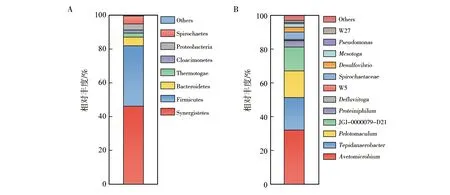
图4 16S rRNA基因在丙酸-氨基酸培养系JO-AP中门水平(A)和 属水平(B)的相对丰度Fig.4 Relative abundance of bacterial 16S rRNA gene at the phylum (A) and genus level (B) in propionate-amino acid enrichment JO-AP
丙酸-氨基酸培养系JO-AP中,互养菌门是第一大细菌类群,占细菌的47.7%,其中在属分类水平上,与醋微菌属(Acetomicrobiummobile)近源序列最多(相似性100%),在细菌中占比为33.5%。厚壁菌门是第二大细菌类群占细菌的37.0%,其中与Tepidanaerobactersyntrophicus近源序列最多(相似性100%),在细菌中占比为20.3%;与丙酸互营降解菌Pelotomaculumschinkii近源序列(相似性100%)占比为16.7%。螺旋体门是第三大细菌类群占细菌的4.02%,在属分类水平上,与螺旋体科未分类属norank_f_Spirochaetaceae近源序列(相似性100%)占比为4.01%。拟杆菌门是第四大细菌类群占细菌的3.92%,在属分类水平上,与Proteiniphilum属未培养类群相似序列(相似性93%)占比为3.82%。
微生物群落结构和功能与环境条件相关联。在厌氧反应器中,底物类型、有机负荷、pH、温度及反应器类型的变化都会引起微生物种群的演替。微生物具有丰富的物种多样性,现代分子生物学技术及新型微生物培养技术的结合,为深入研究和开发微生物奠定了良好的研究基础。通过对酒糟原始沼液JO[11]、以酒糟原始沼液JO为接种物驯化培养的丙酸培养系JO-P[19]和丙酸-氨基酸培养系JO-AP中主要菌群的相对丰度分析,发现不同的分析方法及培养方式得到的主要功能菌类型不同(表2)。

表2 酒糟原始沼液JO、丙酸培养系JO-P及丙酸-氨基酸培养系JO-AP中主要功能菌的相对丰度Table 2 Comparison of relative abundance of main functional bacteria in distiller′s grains original biogas slurry JO, propionate enrichment JO-P and propionate-amino acid enrichment JO-AP
微生物多样性表现出生理代谢的多样性及复杂性,不同的微生物生长代谢类型不同,对反应的底物要求也存在差异。前期以丙酸为唯一碳源进行驯化,获得的丙酸培养系JO-P中,存在3种互营丙酸降解菌Smithellapropionica、Syntrophobacterwolinii及Desulfobulbuspropionicus[19];本研究从丙酸-氨基酸为复合碳源的培养系JO-AP中,发现了一株不同的厌氧丙酸互营降解菌Pelotomaculumschinkii。P.schinkii是一种短棒状产孢子菌,于2005年在中温厌氧处理甜菜废料反应器中分离。其仅在与氢营养型产甲烷菌共培养的条件下利用丙酸,因此被称为“第一株真正的专性互营厌氧丙酸降解菌”[20]。
2.5 古菌群落解析
同细菌分析方法一致,JO-AP培养系中古菌序列属于广古菌门(Euryarchaeota)的甲烷微菌纲(Methanomicrobia),相对丰度占古菌总数的100%。古菌在属分类水平见图5。
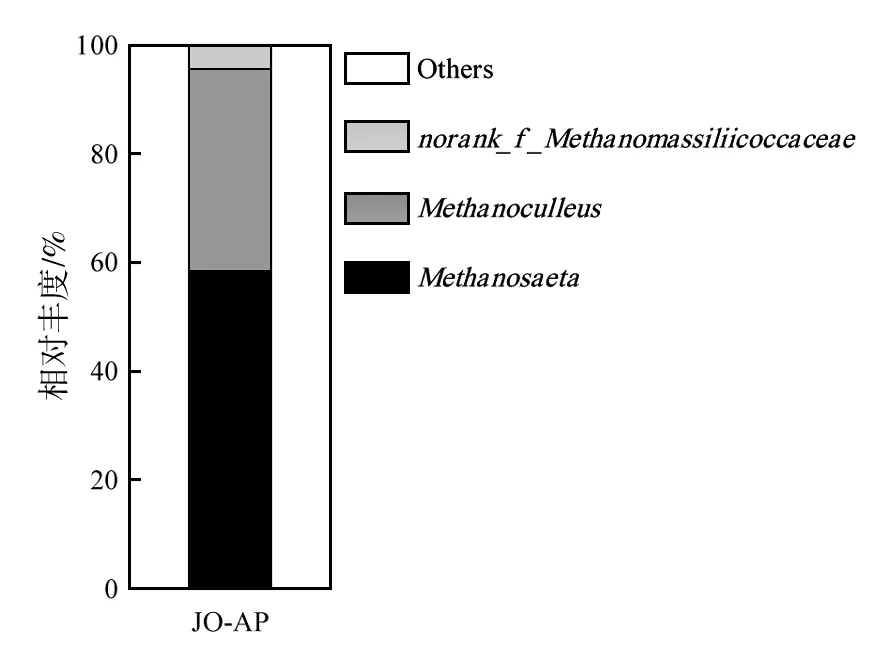
图5 丙酸-氨基酸培养系JO-AP属水平古菌群落结构Fig.5 Relative abundance of propionate-amino acid enrichment JO-AP at the genus level for archaea
丙酸-氨基酸培养系JO-AP中,甲烷鬃菌属(Methanosaeta)在古菌中占比为58.6%,为乙酸营养型产甲烷菌Methanosaetaconcilii(相似性100%);甲烷囊菌属(Methanoculleus)在古菌中占比为37.2%,为氢营养型Methanoculleusreceptaculi(相似性100%);Methanomassiliicoccaceae科未分类属norank_f_Methanomassiliicoccaceae(相似性100%)在古菌中占比为4.16%。
3 讨 论
本研究发现乙酸、丙酸等挥发性有机酸是酒糟厌氧降解过程中重要的中间产物。而丙酸厌氧消化在热力学上是高度吸能的生化反应(Propionate-+2H2O→acetate-+CO2+3H2,ΔG0=+76.0 kJ/mol)[18],比乙酸和丁酸等挥发性有机酸更难被氧化,经常在厌氧消化系统中积累,导致厌氧消化过程的失败。Ao等[7-8]分别对酱香型酒糟在不同条件下的厌氧产气性能进行了研究。中温条件下,乙酸和丙酸是主要代谢产物;高温条件下,乙酸、丙酸、丁酸和戊酸是主要的代谢产物,如果将未稀释的酒糟直接进行污水循环,会导致培养系中乳酸、琥珀酸等的积累[7-8]。严寒等[2]发现有机负荷为6.4 kg/(m3·d)时,酒糟厌氧降解过程中的丙酸积累尤为严重,最高可占挥发性有机酸的92%。因此,丙酸降解被认为是酒糟厌氧消化过程的限速步骤[19],及时去除丙酸是防止培养系发生酸抑制的关键因素。除挥发性有机酸以外,本研究发现白酒糟在厌氧发酵过程中产生多种氨基酸,浓度在0.01~0.3 mmol/L之间。李芳香等[1]研究发现,茅台酒糟中含有谷氨酸、亮氨酸、丙氨酸等16种水解氨基酸。因此,氨基酸类降解菌在酒糟厌氧发酵培养系中发挥重要的作用,富集驯化酒糟中的丙酸及氨基酸类降解菌对酒糟沼气工程稳定运行有重要的指导意义。
通过对比不同驯化培养系的主要功能菌情况,发现单一碳源和复合碳源获得了不同类型的丙酸降解功能菌群,说明反应器中底物的多样性是引起厌氧消化系统中微生物多样性的重要因素之一。产生这种差异的原因可能是混合氨基酸的加入提高了P.schinkii在丙酸互营降解菌群的种群竞争力,使其在培养系中优势生长。Zhuang等[21]研究了在产甲烷条件下不同电子穿梭体介导种间电子转移的能力,结果表明半胱氨酸能够促进丙酸降解产生甲烷,其中100 μmol/L半胱氨酸最有效。在该过程中,半胱氨酸可能充当了Pelotomaculum和Methanobacteriaceae之间的电子载体[21]。Kaden等[22]研究发现L-半胱氨酸可以在Geobactersulfurreducens和Wolinellasuccinogenes的互养共培养体系中介导电子转移,其种间电子转移不通过氢作为电子载体进行。关于氨基酸特别是半胱氨酸对互营丙酸降解菌Smithellapropionica、Syntrophobacterwolinii、Desulfobulbuspropionicus及Pelotomaculumschinkii的影响还有待进一步研究。
采用分子生物学手法对酒糟原始沼液的微生物群落进行解析,没有检测出丙酸降解菌Smithellapropionica、Syntrophobacterwolinii、Desulfobulbuspropionicus及Pelotomaculumschinkii,但存在大量蛋白质及氨基酸类降解菌,如Proteiniphilum属、Aminobacteriummobile(表2)。Ao等[8]对茅台酒糟中温厌氧微生物群落进行分析发现,蛋白质及氨基酸类利用菌Proteiniphilum和糖类利用菌Ruminococcus_2为优势产酸菌。此外Syntrophomonas为优势厌氧互营丁酸及长链脂肪酸降解菌,也没有检测出厌氧丙酸降解菌。推测其原因可能是酒糟沼液中丙酸降解微生物含量较少,而未被高通量测序技术检测出。这是由于高通量测序技术不以获取微生物活体细胞为目的[23],且采用相对丰度的表征形式使得跨样本、跨域比较存在困难,当样品微生物量存在差异时,可能导致错误的结论[24-26]。
本研究基于酒糟厌氧消化过程中主要中间代谢产物,以丙酸及氨基酸为碳源进行驯化,通过高通量测序技术分析了主要菌群。通过对酒糟原始沼液JO、丙酸为唯一碳源的丙酸培养系JO-P及丙酸-氨基酸为复合碳源的丙酸-氨基酸培养系JO-AP中菌群的比较分析,发现不同解析方法及培养方式获得的优势丙酸降解菌不同。因此需要将传统培养技术与分子生物学技术相结合,可以更加全面地了解酒糟沼气发酵系统中群落结构及功能,获得更多的微生物信息,更好地指导沼气工程稳定运行。

