一株耐盐葡萄球菌的分离鉴定及其特性分析
刘清怡, 熊海容, 张 莉
(中南民族大学 生命科学学院, 湖北 武汉 430074)
1 材料与方法
1.1 材料
1.1.1 菌株 耐盐葡萄球菌(Staphylococcuswarneri)SW-1由中南民族大学生命科学学院食品与生物工程研究所分离;大肠埃希菌(Escherichiacoli)BL21由中南民族大学生命科学学院食品与生物工程研究所保藏;金黄色葡萄球菌(Staphylococcusaureus)USA300购自杭州宝赛生物科技有限公司。
1.1.2 培养基 ①LB液体培养基;②明胶高层培养基:氯化钠5 g,蛋白胨10 g,牛肉膏3 g,明胶120 g,蒸馏水1 000 mL;③葡萄糖蛋白胨水培养基:葡萄糖5 g,蛋白胨5 g,磷酸氢二钾2 g,蒸馏水1 000 mL,调整pH值7.2~7.4。
1.1.3 主要试剂 PrimeSTAR Max DNA聚合酶、DL2000 DNA Marker购自宝日医生物技术有限公司;酵母浸粉和蛋白胨购自赛默飞世尔科技公司;细菌基因组DNA提取试剂盒购自天根生化科技有限公司;细菌微量生化鉴定管购自海博生物技术有限公司;通用引物27F/1492R由武汉擎科生物科技有限公司合成;其余试剂均购自国药公司(分析纯)。
1.1.4 仪器与设备 电子分析天平(JA5003B,上海越平科学仪器制造有限公司);可见分光光度计(V-5800,上海元析仪器有限公司);电热恒温培养箱(DNP-9052BS-III,上海新苗医疗器械制造有限公司);全温培养摇床(QYC-2012C,上海新苗医疗器械制造有限公司);高速离心机(Centrifuge 5418,Eppendorf);pH计(PHS-3C,上海仪电科学仪器股份有限公司);PCR仪(C1000TouchTM,BIO-RAD);凝胶成像系统(JS-2012,上海培清科技有限公司);冷场发射扫描电镜(SU8000,HITACHI);真空冷冻干燥机(SCIENTZ-12N/B,宁波新芝生物科技有限公司);离子溅射仪(JS-1600,北京和同创业科技有限公司);比浊仪(DEN-1,广州虹科电子科技有限公司);全自动生物分析仪(VIT-EK2,BIOME-RIEUX)。
1.2 方法
1.2.1 菌株的分离 取培养耐盐酵母菌悬液,经生理盐水梯度稀释后涂布含10%(质量分数)NaCl的LB平板,37 ℃培养24 h,从平板上挑取单菌落转接至含10%(质量分数)NaCl的LB液体培养基中,37 ℃、200 r/min培养24 h,取1 mL菌悬液保存菌种,剩余菌悬液用于各实验内容。
1.2.2 菌株的形态学观察 取1 mL菌悬液用生理盐水进行梯度稀释后涂布于LB平板,37 ℃培养24 h后观察菌株的菌落形态。取1 mL菌悬液8 000 r/min、室温条件下离心1 min,弃上清,加入1 mmol/L pH 8.0的磷酸盐缓冲液洗涤菌体3次,加入2.5%戊二醛固定5 h,然后用磷酸盐缓冲液洗涤菌体3次,随后分别使用25%、35%、50%、70%、85%、90%乙醇梯度脱水,最后使用无水乙醇脱水2次,每次脱水静置15 min。脱水处理后使用乙酸异戊酯置换乙醇2次,每次静置20 min。将样品在-80 ℃冰箱中预冷冻12 h后,放入预冷的真空冷冻干燥机中处理24 h获得干菌体,使用离子溅射仪对菌体表面进行喷金处理后,使用冷场发射扫描电镜观察并拍照[13]。对菌株进行革兰染色,取1 mL菌悬液用生理盐水稀释10倍,取适量菌体涂布于载玻片上,过火焰1~2次进行干燥和固定,滴加草酸铵结晶紫染色1 min后水洗,滴加碘液染色1 min后水洗,滴加95%的乙醇脱色处理约30 s,水洗并吸去水分,滴加蕃红染色1 min后水洗并吸去水分,显微镜观察并拍照[14]。
1.2.3 菌株的生化鉴定 对上述筛选得到的耐盐菌进行富集培养,参考《伯杰氏细菌鉴定手册》[15],对其生理生化性质进行测定,包括氧化酶试验、靛基质试验、MR-VP实验、硝酸盐还原试验、西蒙氏枸橼酸盐试验、氨基酸脱羧酶试验、明胶液化试验、山梨醇发酵试验、纤维二糖发酵试验、棉子糖发酵试验、乳糖发酵试验、麦芽糖发酵试验、血浆凝固酶试验、半固体动力试验。
1.2.4 菌株的分子鉴定 提取该菌株基因组DNA,使用细菌16S rDNA的通用引物27F/1492R(正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′;反向引物1492R:5′-GGTTACCTTCTTACGACTT-3′)进行PCR扩增,将PCR产物进行1%琼脂糖凝胶电泳检测,将切胶回收的16S rDNA基因片段,送至武汉擎科生物科技有限公司测序,测得序列与NCBI数据库中已知序列进行比对及相似性分析,利用MEGA X软件构建进化树[11]。
1.2.5 菌株的药敏性分析 将菌株在LB固体培养基上划线后37 ℃培养18~24 h至长出单菌落,用无菌棉拭子挑取单菌落至无菌盐水中,充分搅拌均匀后用比浊仪调整菌悬液浓度为0.5麦氏单位,按照AST-GP药敏卡的要求配样,打开药敏卡片,将进液小管放入配置好的菌悬液样品中,然后使用VITEK 2全自动微生物分析仪进行药敏性分析[16-17]。
1.2.6 菌株的耐盐性分析 将菌株接种至10 mL LB液体培养基中,37 ℃、200 r/min培养过夜后转接至NaCl浓度分别为0、10%、12%、15%、17%、20%(质量分数)的LB液体培养基中,控制起始OD600值为0.5,37 ℃、200 r/min培养48 h,前12 h每隔2 h取样,后36 h每隔12 h取样,测定各样品的OD600值,监测该菌株的生长情况,以金黄色葡萄球菌USA300作为对照[5,18]。
1.2.7 菌株的表面疏水性分析 利用微生物碳氢吸附能力(Microbial adhesion to hydrocarbons,MATH)测试菌株细胞表面疏水性[19]。取2 mL菌悬液,10 000 r/min室温离心1 min,弃上清,加入2 mL 1 mmol/L pH 8.0的磷酸盐缓冲液洗涤菌体3次,用相同体积的缓冲液重悬细胞,准确测定其OD600值记为A0。取2 mL细胞悬浮液于15 mL玻璃离心管中,分别加入2 mL有机溶剂,包括氯仿、乙酸乙酯和正丁醇,涡旋震荡2 min,室温静置30 min后小心吸取下层水溶液测量其OD600值记为A1,代入公式中计算细胞的疏水值[20]。疏水值(%)=(A0-A1)/A0×100%,其中A0表示处理前菌悬液的OD600值,A1表示加有机溶剂振荡处理后菌悬液的OD600值。
2 结果与分析
2.1 菌株的鉴定
在筛选耐盐酵母的过程中分离得到一株耐盐菌,将其命名为SW-1。将该菌株涂布于LB 固体平板,观察单一菌落形状为圆形,边缘整齐,菌落表面光滑且湿润,呈乳白色半透明状(图1A),菌株SW-1在LB液体培养基中为乳白色,有部分菌体絮凝现象。对菌株SW-1进行革兰染色,显微镜下观察菌体呈蓝紫色,说明该菌株为革兰阳性菌(图1B)。扫描电镜下观察该菌呈球形、葡萄串状排列,表面光滑,无鞭毛,菌体直径约0.5~1.0 μm(图1C);且该菌具有沃氏葡萄球菌裂殖过程中隔周环(peripheral ring)破裂后,子细胞与母细胞通过快速爆裂机制分离而留下来的痕迹[21](图1D)。

图1 菌株SW-1形态特征Fig.1 Morphological characters of strain SW-1A:LB固体培养基上菌落形态;B:革兰染色鉴定;C、D:扫描电镜图A:Colony morphology on LB solid medium; B:Gram staining; C,D:Scanning electron microscope
对菌株SW-1的生理生化性质进行测定,从表1中可以看出菌株SW-1可以利用葡萄糖和麦芽糖进行发酵产酸,而无法利用山梨醇、纤维二糖、棉子糖、乳糖。通过MR-VP试验可知菌株SW-1可以通过分解葡萄糖产生有机酸,而无法分解葡萄糖产生丙酮酸或无法进一步将丙酮酸脱羧成为乙酰甲基甲醇。动力试验与血浆凝固酶试验均呈阴性。以上生化反应结果符合沃氏葡萄球菌的特征[22]。

表1 菌株SW-1的生化反应鉴定结果Table 1 Physiological and biochemical identification experiments of SW-1
通过16S rDNA的同源性分析进一步对菌株SW-1进行鉴定。以提取的菌株SW-1基因组DNA为模板,经PCR扩增获得约1 500 bp的特异性产物(图2A),测序结果表明该序列为16S rDNA基因,被扩增长度为1 364 bp(图2B)。在GenBank中将测序所得序列进行在线搜索比对,结果显示菌株SW-1的基因序列与Staphylococcuswarneristrain ATCC 27836的同源性达100%。根据比对结果建立系统发育树,结果见图3。由上述鉴定结果可知菌株SW-1为沃氏葡萄球菌。

图2 菌株SW-1 16S rDNA的PCR扩增产物及测序序列Fig.2 PCR amplification products and sequences of SW-1 16S rDNAA:使用通用引物27F/1492R从菌株SW-1基因组DNA中PCR扩增产物的电泳图(M:DL2000 DNA Marker;1:PCR扩增产物);B:PCR扩增产物的测序序列A:Agarose gel electrophoresis of PCR amplified products from genomic DNA of SW-1 using universal primer 27F/1492R(M:DL2000 DNA Marker; 1:PCR amplification products); B:Sequencing analysis of PCR products

图3 菌株SW-1的系统发育树Fig.3 Phylogenetic tree of SW-1 strain
2.2 菌株的药敏特性
对菌株SW-1进行16种常见抗生素的药敏性分析,结果见表2,除克林霉素、红霉素和青霉素外,大部分医用抗生素对菌株SW-1均有较强的抑制作用。

表2 菌株SW-1的药敏实验结果Table 2 Results of SW-1 antibiotic susceptibility test
2.3 菌株的耐盐性
将菌株SW-1分别在NaCl为0、10%、12%、15%、17%、20%(质量分数)的LB培养基中培养,以金黄色葡萄球菌USA300为对照,监测两株菌的生长情况,从图4可以看出,菌株SW-1和金黄色葡萄球菌USA300均在无盐培养基中比有盐培养基中生长好,且随着盐浓度的增加,两株菌的细胞量均逐渐减少,但菌株SW-1细胞量的减少幅度明显慢于金黄色葡萄球菌USA300,且在NaCl浓度达17%和20%时,菌株SW-1仍能良好生长,而金黄色葡萄球菌USA300的OD600值已降至1以下。耐盐菌是指能够耐受一定的盐浓度,但在无盐环境中能更好生长的菌[23],上述结果表明菌株SW-1属于耐盐菌,在高浓度NaCl的条件下能快速适应环境积累生物量,高盐环境适应性强。
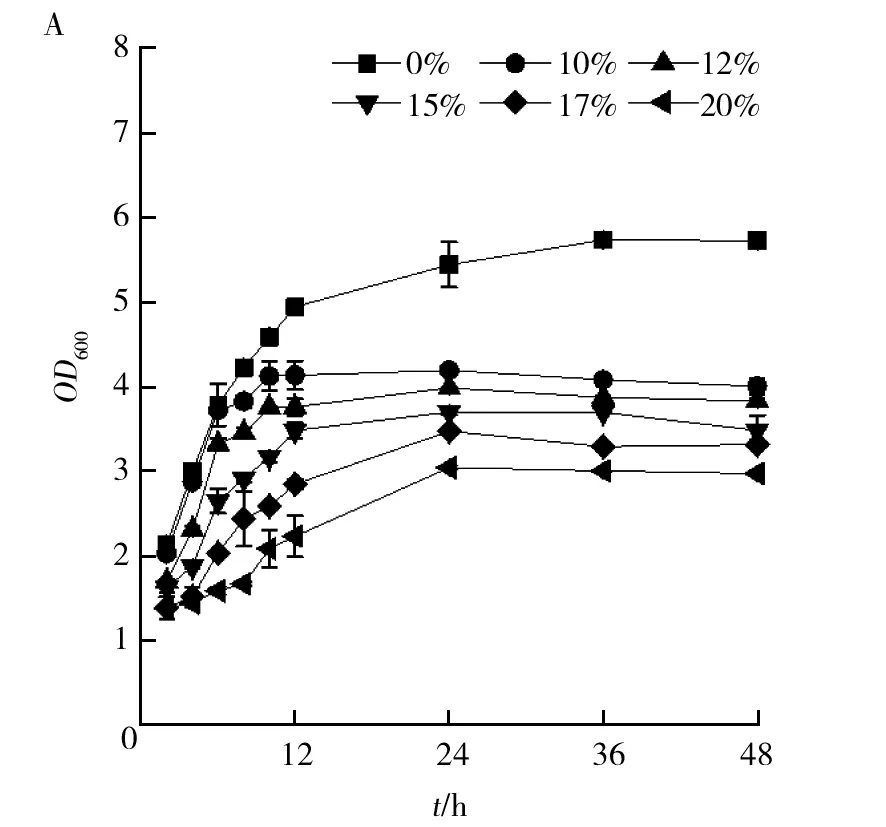
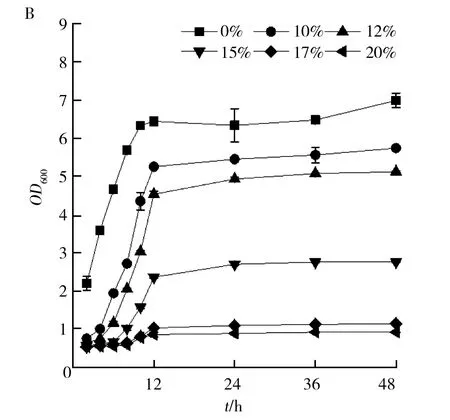
图4 两株菌在不同盐浓度培养基中的生长曲线Fig.4 Growth curves of two kinds ofStaphylococcusunder different salt concentration gradientsA:菌株SW-1;B:金黄色葡萄球菌USA300A:SW-1; B:Staphylococcus aureus USA300
2.4 菌株的疏水性
细菌表面的疏水性与其和疏水性物质的附着性能力密切相关[24],且细菌表面疏水性和烷烃分解能力之间也存在显著的相关性[19]。使用微生物碳氢吸附能力实验对菌株SW-1的疏水性进行分析,如图5所示,菌株SW-1对氯仿、乙酸乙酯和正丁醇的疏水率依次为43%、34%和39%。根据疏水率标准,疏水率>50%为高疏水性,疏水率介于20%~50%为中度疏水性,疏水率<20%为非疏水性,上述结果表明菌株SW-1具有良好的疏水性。

图5 菌株SW-1的表面疏水性Fig.5 Surface hydrophobicity of SW-1
3 讨 论
目前大部分耐盐菌都是从高盐环境中筛选、驯化获得的,本研究在筛选耐盐酵母的过程中获得一株耐盐菌菌株SW-1,结合形态观察、生理生化检测和16S rDNA分子测序,该菌株为沃氏葡萄球菌,菌株SW-1可以耐受0~20%的NaCl。多项研究表明葡萄球菌具有耐盐能力,陈俊等[25]研究发现金黄色葡萄球菌的耐盐生长特性不仅与其细胞壁的正常合成有关,还与盐应激蛋白的表达有关,而且在高盐条件下菌落及个体形态大小均发生显著变化。
本研究获得的菌株SW-1经鉴定为沃氏葡萄球菌,沃氏葡萄球菌是葡萄球菌属的一种,主要存在于环境、人与动物的皮肤和黏膜上[29],有研究报道沃氏葡萄球菌为条件致病菌[30],但本研究中的菌株SW-1对大部分医用抗生素均敏感,容易杀死去除。菌株SW-1在含高浓度盐的条件下能快速适应环境积累生物量,且在含20% NaCl培养基中仍能良好生长,具有良好的耐盐性。MATH疏水性实验结果表明菌株SW-1在氯仿、乙酸乙酯、正丁醇中的疏水率分别达43%、34%和39%,具有良好的疏水性。Fu等[31]的研究表明沃氏葡萄球菌可耐受多种有机溶剂,包括短链醇、烷烃、酯和环状芳香化合物;疏水性细菌的碳氢分解能力比亲水性细菌高,细胞表面疏水性和烷烃分解能力之间存在显著的相关性[19]。工业高盐废水中通常含有多种有机溶剂,因此筛选具有一定有机溶剂耐受性的耐盐菌更具实际应用意义,本研究为该菌在高盐废水中的应用提供了参考。

