以脑炎为首发症状的自身免疫性胰腺炎1例报告合并文献复习
姜 一, 王 诺, 吴 涛
自身免疫性胰腺炎(autoimmune Pancreatitis,AIP)是自身免疫导致的特殊类型的胰腺疾病,临床症状多样,可表现为上腹痛、腹泻、和梗阻性黄疸等慢性胰腺炎的症状,也可以血糖升高、或其他胰腺外并发症为首发症状。尤其是以胰腺外并发症为首发症状的AIP患者,若无AIP典型的腹痛和黄疸表现,未行胰腺的影像学检查,则易漏诊。本例患者以脑炎为首发症状,伴有炎症指标、血糖及肿瘤标志物的升高,本文描述其治疗过程中实验室检查和影像学检查结果的变化,并就相关文献进行复习及总结,以期提高广大临床医师对该类疾病的诊治水平。
1 临床资料
患者,男,37 岁。 因“发热1个月,头痛16 d”于2020年11月11日入住海军军医大学附属长海医院。 患者于2020年10月15日劳累后出现咳嗽咳痰,后出现发热,体温最高38.5 ℃,就诊于当地医院给予青霉素治疗后症状无改善。10 d后出现全头部胀痛。检验提示白细胞计数6.4×109/L,头部MRI未见明显异常,给予头孢治疗后,出现双眼视物模糊,头痛加重至不能入睡,全身乏力,复查白细胞计数22×109/L,行腰椎穿刺检查,脑脊液压力120 mmH2O,蛋白计数0.978 g/L,有核细胞数56×106/L。给予头孢他啶及利奈唑胺抗感染,同时给予利巴韦林及阿昔洛韦抗病毒,地塞米松10 mg/d抗炎等治疗后体温下降至37.0~37.5 ℃,头痛症状稍减轻。为求进一步诊治,2020年11月11日转至我院。入院查体:体温36.0 ℃,心率80次/min,血压125/80 mmHg,呼吸频率18次/min。 既往体健,否认高血压、糖尿病、心脏病、脑炎、癫痫等病史,无吸烟、饮酒史。 查体合作,全身浅表淋巴结未触及肿大。 神经系统查体:意识清楚,言语清晰流利;定向力、理解力、记忆力、计算力正常;脑神经检查未见明显异常; 双侧深浅感觉对称存在;四肢肌容积正常,肌张力正常,肌力 5 级,双侧腱反射对称(),病理征均未引出;四肢共济运动无异常,Romberg征阴性;脑膜刺激征阴性;自主神经功能检查未见异常。
患者入院辅助检查:(1)丙氨酸氨基转移酶(ALT)124 U/L,γ-谷氨酰转肽酶(γ-GT)182 U/L,门冬氨酸氨基转移酶(AST)64 U/L,空腹葡萄糖(GLU)7.4 mmol/L。白细胞计数(WBC) 14.02×109/L,中性粒细胞计数(NEUT) 9.9×109/L。红细胞沉降率(ESR)34 mm/H、超敏C反应蛋白(hs-CRP)13.7 mg/L、血清淀粉样蛋白(SAA) 88.9 mg/L。具体多次检测(见表1)。(2)数次腰穿检查(见表2)。脑脊液病毒抗体全套阴性,涂片未查见真菌及细菌或抗酸杆菌;新型隐球菌及曲霉菌检查均阴性,寡克隆带电泳阴性。脑脊液微生物二代基因检测见微量痤疮丙酸杆菌及棒状乳杆菌,考虑背景菌。(3)病毒抗体:单纯疱疹病毒抗体IgG阳性、IgM弱阳性;EB病毒抗体IgG阳性、IgM弱阳性;巨细胞病毒抗体IgG阳性。免疫球蛋白IgG4亚型0.26 g/L,尿粪常规、肝肾功能、血脂、淀粉酶、脂肪酶、甲状腺功能及相关抗体、抗“O”、类风湿因子、自身免疫抗体、补体C3、C4、抗肝抗原谱抗体全套、其余肿瘤相关标志物、输血前3项无异常,结核感染T细胞检测及真菌D-葡聚糖检测阴性。(4)头部MRI增强未见明显异常。初步诊断为病毒性脑炎,给予阿昔洛韦750 mg Q8H静滴;地塞米松10 mg/d静滴;对症给予控制血糖及护肝。1 w后患者体温恢复正常波动在36.5 ℃左右,头痛症状好转。但腰穿提示脑脊液蛋白计数继续升高,加用头孢曲松2 g Q12H 静滴7 d复查腰穿提示脑脊液细胞数和蛋白数有所下降,且血糖及转氨酶水平恢复正常水平,故安排出院,停止抗生素治疗,地塞米松每周递减1片口服序贯治疗。2021年1月4日患者因自觉头痛症状加重再次入院复查。入院后查脑脊液压力及蛋白、细胞数、相关炎性指标、转氨酶均较前次住院明显增高(见表1、表2),给予阿昔洛韦及头孢曲松静滴。1 w后患者出现发热,体温波动在38.0 ℃,同时出现右侧三叉神经痛,炎性指标呈继续上升趋势,调整抗生素为美罗培南2 g Q8H继续联合万古霉素1 g Q12H静滴,患者出现右侧颌面部肿胀且头痛症状较前加重,伴有视物模糊。患者肿瘤标志物中CA199由入院时10.79 U/ml 上升为111.56 U/ml(参考值<37),胸部CT提示两肺多发斑片及结节,考虑少见真菌或结核菌感染可能,完善电子支气管镜检查未见明显异常,灌洗术外送肺泡灌洗液二代测序未见明显致病菌。因此进一步完善PET-CT检查,发现胰腺及结肠代谢增高(见图1)。完善胰腺MRI增强,胰腺呈“蜡肠样”改变(见图2),考虑自身免疫性胰腺炎。
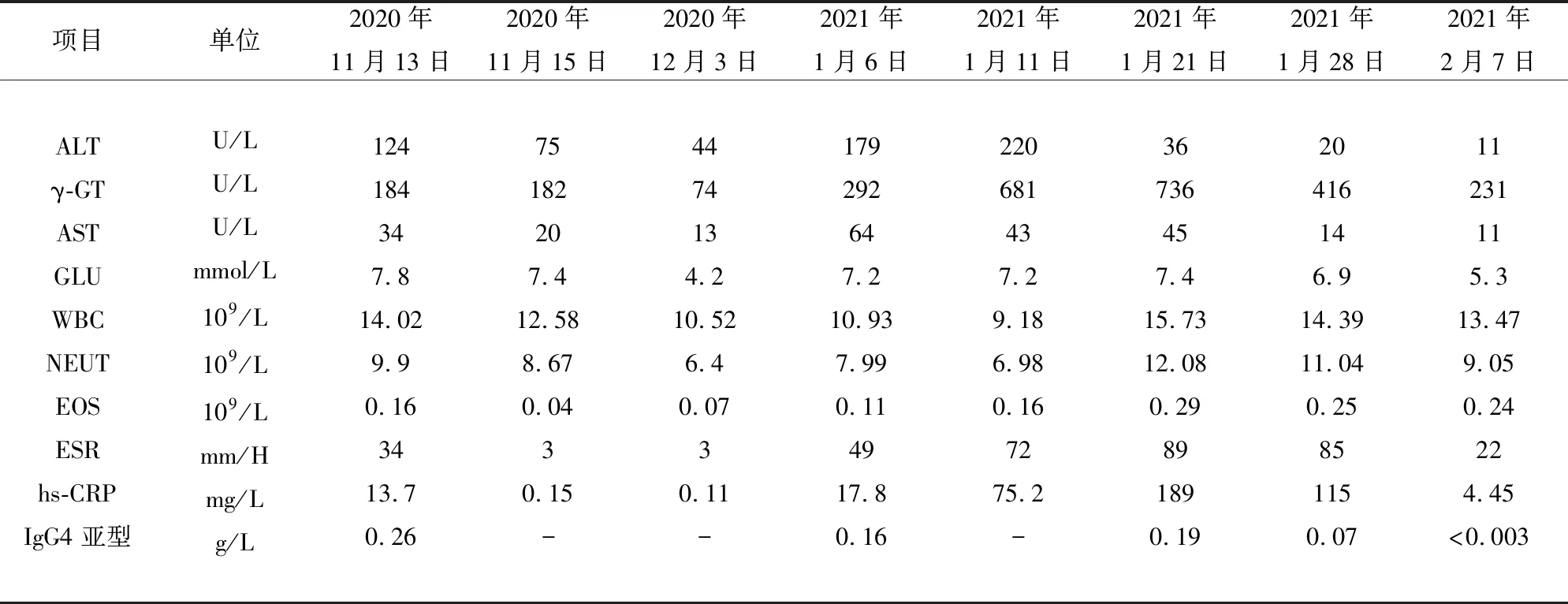
表1 患者入院后主要炎症指标变化
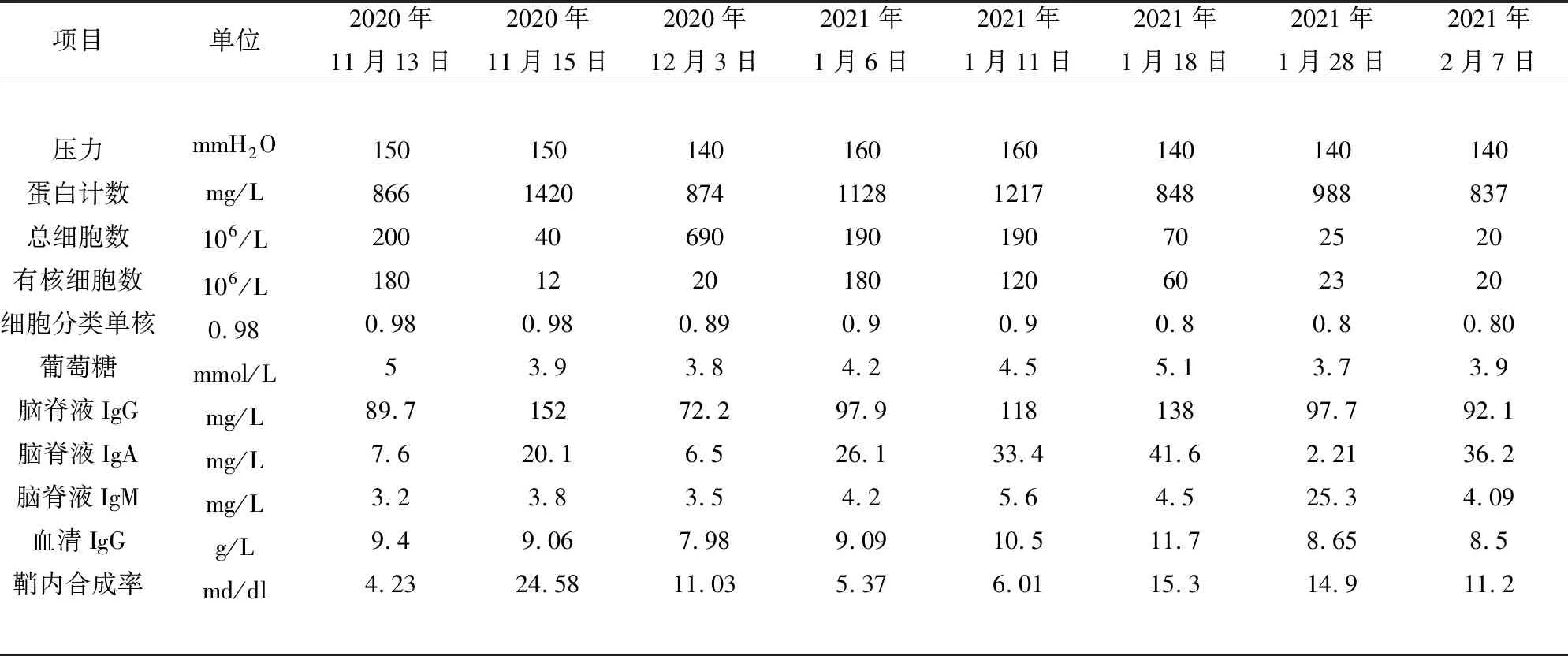
表2 患者入院后脑脊液检查
由此考虑该患者为自身免疫介导的脑炎。治疗方案调整为给予甲泼尼龙40 mg/d静滴及熊去氧胆酸750 mg/d口服,同时将抗生素降级为头孢曲松。1 w后患者头痛及视物模糊症状好转,体温也恢复正常,ESR及CRP均在正常范围内,ALT及γ-GT、脑脊液中蛋白及细胞数也呈下降趋势。安排患者出院继续口服甲泼尼龙及熊去氧胆酸,6个月随访患者基本无明显临床症状,ALT及γ-GT均恢复至在参考值范围内,胸部CT检查双肺斑块影较前明显减少,因鉴于超声内镜下胰腺穿刺风险大,患者未同意行胰腺穿刺活检。
2 讨 论
自身免疫性胰腺炎(AIP)属于罕见疾病,其发病率≤1/10 万,男女均可发病,男性居多,多发生在50岁以上人群[1]。目前,AIP分为两种类型,AIP-1型又称为IgG4 相关AIP,属于IgG4相关疾病(IgG4-relateded disease,IgG4-RD),通常与IgG4和血清自身抗体阳性相关。而2型AIP虽然与1型AIP有相似的影像学表现,但2型AIP通常无血清IgG4的升高,无自身抗体及其他器官受累,且2型自身免疫性胰腺炎发病年龄较小(一般小于40岁),并且常常伴发炎症性肠病(16%~30%)[2,3]。
临床上,由于AIP属于IgG4-RD的范畴,其他脏器受累往往是重要的支持性诊断线索[4]。一项日本研究发现AIP伴淋巴结肿大比例达80.4%,伴胆管病变占73.9%,伴泪腺和唾液腺病变占39.1%,伴甲状腺病变占22.2%,伴腹膜后纤维化占12.5%[5]。有META分析统计了自2009年-2018年我国2364例AIP患者临床特征[6],主要临床症状依次为:梗阻性黄疸、腹部不适、体重减轻、血糖升高等,仅由影像学检查发现的无症状患者相对少见。约50.13%的患者合并有胰腺外表现,主要为胆道系统受累(胆管炎或胆道梗阻)[7],淋巴结、肾脏、溃疡性结肠炎、系统性红斑狼疮、桥本氏甲状腺炎等,但无神经系统受累或以神经系统症状为首发症状的相关报道。其中实验室检查中以IgG4升高最为常见,CRP、IgG升高,血沉加快,总胆红素、ALT、AST、CA19-9等都可有升高。42.04%患者自身免疫标志物类风湿因子阳性,提示AIP与自身免疫有一定关联[8]。
2011年国际胰腺病协会 (International Association of Pancreatology,IAP)制定了AIP诊断标准国际共识(ICDC for AIP),被认为是诊断AIP最权威的标准[8]。该诊断标准突出强调胰腺实质影像学检查(CT/MRI)在AlP诊断中的首要地位。如患者有典型的影像学征象,且有实验室检查或胰腺外受累证据,即可诊断为AIP。结合我院收治的病例,该患者为37岁男性,因“头痛、发热”脑炎症状来诊,无梗阻性黄疸、腹痛等胰腺相关症状,且脑脊液生化检测符合脑炎诊断,但因抗生素治疗脑炎症状不缓解,同时合并有肝酶成倍升高、ESR及CRP持续上升等症状,一度为临床诊断带来很多难点。完善PET-CT,意外发现胰腺及结肠代谢异常,进一步行胰腺MRI才发现典型AIP影像学特点(弥漫性胰腺肿大,胰腺小叶的肿大伴随着小叶轮廓的消失,使腺体呈现出“腊肠样”的外观,密度均匀,T1加权低信号,T2加权稍高信号。在增大的胰腺周围有一个低密度的囊状“边缘”,这也是AIP的一个典型的影像学表现)(见图2)。多次化验IgG4均在正常范围,无自身抗体结果阳性。使用糖皮质激素治疗后患者的临床症状短期内就可缓解,脑脊液IgG水平、ESR、CRP、及肝酶水平均下降,6个月后随访恢复至参考范围(见表1), 因此支持 AIP的临床诊断。
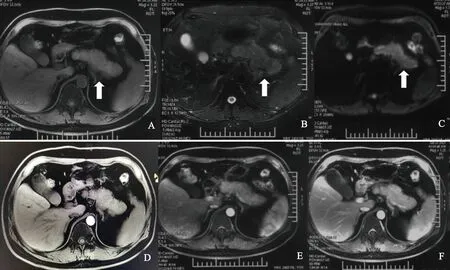
图2 所示为胰腺MRI增强:胰腺形态饱满,轻度蜡肠样改变,T2W1信号增高,弥散受限,增强后强化均匀,主胰管未见扩张,胰周脂肪间隙尚清晰。A为T1W1序列;B为T2W1序列;C为弥散序列;D为动脉期;E为门脉期;F为延迟期
AIP患者血清中IgG4 水平升高对AIP的诊断十分重要,被多个指南采纳作为诊断依据之一[9]。诊断IgG4-RD的血清 IgG4切点是135 mg/dl,其灵敏度为 90%、特异度为 60%,存在一定假阳性率。因此仅凭IgG4 升高不能单纯的作为诊断的特异性血清学指标,应结合影像学、胰腺外器官受累、病理学和激素疗效作出诊断[4]。本例患者IgG4不高,提示 IgG4升高并不是诊断AIP的必要条件和充分条件[10]。但该指标的测定对于评估疾病的治疗反应及复发仍有一定临床意义。有研究发现,使用糖皮质激素治疗后IgG4水平下降者,预示病情好转;而IgG4持续升高或波动,提示病情无好转,有复发甚至诊断错误[11]。本例患者在进行激素治疗临床症状好转的同时,IgG4值仍有进一步下降(见表1)。既往有研究认为血清CA199检测在AIP患者诊断中也具有意义[12,13],多项研究表明,CA199水平能够反映胰腺分泌功能受损状况,AIP患者血清中 CA199 水平比正常人明显升高,但升高程度显著低于胰腺癌患者。亦有相关报道少数AIP可不合并血清 IgG4 和血清CA199异常[12]。本病例患者CA199水平在病程早期属于正常值范围,随着临床症状加重,CA199水平也有所增高,但较胰腺癌患者升高程度仍偏低,这一点与相关报道相符合。
近年来,对AlP的治疗逐渐规范。2016年国际胰腺病协会发布了《AIP治疗国际共识》,对 AlP治疗的热点问题进行了详细阐释[10]。建议对于所有未经治疗或处于活动期的AIP患者,类固醇激素是无使用禁忌证患者诱导治疗的一线药物 (A级推荐)。IAP共识建议诱导缓解的每日最小需要量为泼尼松20 mg。对于部分患者(如老年及糖尿病患者),相对较小的剂量有利于减免急性激素使用相关性不良反应的发生,但过低的剂量(泼尼松10~20 mg/d)往往与明显降低的疾病缓解率相关。至于整个诱导缓解的疗程,IAP共识建议维持12 w且不推荐采用短期 (<4 w)、大剂量 (≥20 mg/d)激素诱导缓解方案。IAP共识与国内版指南相比,仅在激素诱导疗程上存在微小差异 (国内版为6~12个月)[14]。减量方案尚需更多的循证医学证据支持。国际多中心回顾性研究提示,AIP患者30%~50%经历过复发,大部分复发患者出现在激素治疗中断以后(67%),而在激素减量过程(15%)以及激素维持治疗过程(18%)中复发的比例较低[11]。2016年IAP专家共识中认为在诱导治疗成功后,部分AIP 1型患者使用低剂量糖皮质激素或者激素替代药物维持治疗可能获益(B级推荐)。许多日本专家推荐2.5~7.5 mg/d的小剂量糖皮质激素维持治疗至少3 y,当患者影像学或血清学改善时再考虑停药[15]。本病例患者在病程初期未明确为AIP针对脑炎症状时使用过10 mg/d地塞米松4 w,且停用后临床症状立即复发,这与专家共识相符。故在考虑诊断为AIP后,应用甲泼尼龙40 mg/d治疗,随访6个月,患者肝酶指标已恢复正常,脑炎症状未复发,才逐渐减量,减量过程较指南缓慢,这种方案对于AIP 预后的影响有待通过随访评估。
我国AIP常伴有胰腺外表现,影像学检查可协助诊断,但误诊率较高。而近年来自身免疫介导的脑炎报道也较前明显增多,提示临床医师对这类疾病的认识和诊断水平也在不断提高。而自身免疫性疾病存在关联性,临床医师需提高对AIP及AIE的诊治意识和水平,减少漏诊误诊。

