基于基因探针扫描技术高通量检测乳制品中赭曲霉毒素A产生菌
孔文平,李 裕,郭锦材,李 灿,朱湘成,5,陈同强,*
(1.中南大学湘雅国际转化医学联合研究院,湖南 长沙 410083;2.长沙市口腔医院,湖南 长沙 410006;3.食品安全监测与预警湖南省重点实验室,湖南 长沙 410111;4.湖南省食品质量监督检验研究院,湖南 长沙 410000;5.组合生物合成与天然产物药物湖南省工程研究中心,湖南 长沙 410011)
真菌是农业和食品行业中的主要微生物污染源之一,普遍存在于食品的生产、加工、包装、贮藏和运输等环节。真菌毒素则是真菌污染后所产生的次级代谢产物,具有强毒性、致癌性、神经毒性和免疫抑制等作用,会对人和动物的健康造成严重威胁[1]。目前已被发现的真菌毒素约有400 种,全球约25%的农作物受到真菌毒素污染的影响,每年由真菌毒素造成的经济损失高达数千亿美元[2]。与食品和农产品相关的真菌毒素主要包括赭曲霉毒素、伏马菌素、黄曲霉毒素、玉米赤霉烯酮和呕吐毒素等,常见真菌毒素的化学结构如图1所示。

图1 常见真菌毒素的化学结构Fig. 1 Chemical structure of common mycotoxins
赭曲霉毒素是全球公认在食品和动物饲料中最常见的污染物之一,根据其特征官能团的不同,可以分为赭曲霉毒素A(ochratoxin A,OTA)、OTB、OTC和OTD,OTA是赭曲霉毒素家族中毒性最强的成员,不仅可抑制人类胚胎干细胞的吸附、存活和增殖,还能够诱导细胞的程序性死亡和氧化应激,被国际癌症机构列为“2B”类致癌物[3]。由于OTA理化性质稳定,不易被降解破坏,在很多食品,如谷物、咖啡、葡萄酒、干果、坚果等食物中都有检出[4],为此世界很多国家都出台了食品中OTA含量的限量标准[5-6](表1),其中:欧盟规定,婴幼儿食品中OTA含量不超过0.5 μg/kg,谷物制品和未加工谷物中OTA含量分别不超过3.0、5.0 μg/kg;中国规定,谷物、豆类和咖啡豆中OTA含量均不超过5.0 μg/kg,葡萄酒和速溶咖啡中OTA含量分别不超过2.0、10.0 μg/kg;国际食品法典委员会(Codex Alimentarius Commission,CAC)规定,小麦、大麦和黑麦原粮中OTA含量不超过5.0 μg/kg。目前国内外对OTA的防控研究主要集中于OTA的定性和定量检测,采用的检测方法主要包括薄层色谱法[7]、高效液相色谱法(high performance liquid chromatography,HPLC)[8]、HPLC-串联质谱法[9]、酶联免疫法[10]和核酸适配体法[11]等,但是上述方法不仅操作繁琐、耗时费力、灵敏度低,而且只能靶向于OTA本身,无法在食品或农产品被污染前进行有效预警,从而避免造成经济损失。

表1 国内外食品中OTA的限量标准Table 1 Chinese and international limit standards for OTA in food
相较于对真菌毒素本身的检测,直接对产毒真菌进行检测能够前置化干预其对食品的污染及对人类、动物的危害,能够在产毒真菌污染食品早期、未产生毒素前发现问题,以便及时采取措施。食品中产毒真菌鉴定方法有形态学观察和生化鉴定等,前者存在需要对真菌纯化培养、实验操作步骤繁琐、主观依赖性强、专业性要求高和灵敏度低等缺陷。也有研究者使用飞行时间质谱仪对产毒真菌进行鉴定,而这需要非常完备的质谱数据库,但是产毒真菌的多样性给数据库的建立带来巨大挑战,因此亟需一种快速、高效的产毒真菌鉴定方法来保障食品真菌污染方面的质量与安全。
乳制品因其富含营养物质受到全世界各国人民的喜爱,据统计,在过去的25 年中,世界乳制品总产量增长37.5%[12]。而世界各国人民生活水平的提高使得各类乳制品的消费量在未来相当长的时间将依旧保持稳定增长,市场上可供选择的乳制品种类也会越来越多,如含有益生菌的乳制品越发受到消费者的欢迎,但是其在生产过程中可能受到其他真菌的污染,产生一些真菌毒素,如OTA类化合物。为了保证乳制品等食品的安全,需要对OTA的潜在污染风险进行评估,随着合成生物学的快速发展,越来越多的真菌测序完成,真菌毒素的生物合成途径被阐明[13-14]。本研究基于基因探针扫描技术建立更加高效、准确的方法对乳制品中OTA的污染进行风险评估,在OTA产生的源头进行有效监控,旨在弥补传统方法在OTA检测中存在的缺陷,更好地保障消费者的健康和安全。
1 材料与方法
1.1 材料与试剂
纯牛乳 湖南省长沙市某大型超市。
共选择6 株食品中常见的真菌,其中:赭曲霉菌(Aspergillus ochraceus)、黄曲霉菌(Aspergillus flavus)、土壤伊莎酵母(Issatchenkia terricola)和酿酒酵母(Saccharomyces cerevisiae)来源于上海保藏生物技术中心,生长于马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基;串珠镰孢菌(Fusarium moniliforme)来源于北京生物保藏中心,生长于酵母浸出粉胨葡萄糖琼脂(yeast peptone dextrose agar,YPD)培养基;冠突散囊菌(Aspergillus cristatus)为本实验室前期从茯砖茶中分离得到的菌株,生长于40%蔗糖麦芽浸膏(M40Y)培养基。
真菌基因组提取试剂盒 杭州博日科技有限公司,T3 Super Mix、琼脂糖、DNA Marker 北京擎科生物科技有限公司。
1.2 仪器与设备
FlexCycler2多功能聚合酶链式反应(polymerase chain reaction,PCR)仪 德国耶拿分析仪器股份公司;JY300C凝胶电泳仪 北京君意东方电泳设备有限公司;GelDoc XR+凝胶成像系统 伯乐生命医学产品有限公司。
1.3 方法
1.3.1 基因探针设计
从NCBI数据库(http://www.ncbi.nlm.nih.gov)中搜索有关赭曲霉毒素生物合成的相关研究,绘制赭曲霉毒素的生物合成途径(图2)。非核糖体肽合成酶(non-ribosomal peptide synthetase,NRPS)下游由OTAhal(OTA halogenase)基因编码的卤化酶可以催化OTB的氯原子加成,这被证明是形成毒性更大的OTA的关键步骤,而OTA随后可以被进一步酯化或羟基化后形成其他赭曲霉毒素衍生物OTC和OTD,因此针对特异性的卤化酶基因进一步分析研究。Aspergillus steynii3.53、Aspergillus westerdijkiaeCECT 2948、碳黑曲霉(Aspergillus carbonarius)350、黑曲霉(Aspergillus niger)3.39和Penicillium nordicumCBS 110.769为5 株产OTA的不同种真菌,OTA的产量及各自卤化酶基因的表达量相关性均已被实验验证,其卤化酶(OTAhal)氨基酸序列的GenBank登录号分别为MG701897、MG701896、MG701890、MG701892和MG701895[15]。Leptoxyphium fumago和Caldariomyces fumago为2 株含有卤化酶基因、不产OTA的真菌,其卤化酶(OTAhal)氨基酸序列的GenBank登录号分别为AJ300448.1和KM575843.1[16-17]。通过MEGA软件进行多重序列比对分析,找出OTAhal结构域特异的一段序列区域(图3),进行兼并引物设计:hal-F(5’-GCYGGYATCRCCAGCACCAAGT-3’)和hal-R(5’ATRAACCASACCCAGCCGCTG-3’)。同时,使用真菌通用引物ITS1(5’-TCCGTAGGTGAA CCTGCGGG-3’)和ITS4(5’-TCCTCCGCTTATT GATATGC-3’)验证真菌DNA的提取质量及真菌种属类别。

图2 OTA的生物合成途径推测Fig. 2 Hypothesized OTA biosynthesis pathway
1.3.2 DNA的提取和PCR扩增
将购买的菌株进行活化后,分别接种在不同的培养基中,28 ℃、220 r/min摇床培养2~3 d。待菌株生长好后用50 mL离心管收集,4 ℃、5 000 r/min离心收集菌丝体,用蒸馏水清洗除去菌丝表面的培养基。菌丝加液氮研磨成细粉,采用BioFlux试剂盒进行DNA提取,提取流程参考说明书。PCR反应体系25 μL,含有DNA模板1 μL、上游引物1 μL、下游引物1 μL和T3 Super PCR Mix 22 μL。PCR反应条件:98 ℃、2 min,98 ℃、30 s,60 ℃、30 s,72 ℃、1 min,30 个循环;72 ℃、5 min。PCR反应产物用1%琼脂糖凝胶电泳检测,用凝胶成像仪成像并观察结果。
1.3.3 人工污染牛乳检测
取1 g在28 ℃、220 r/min条件下培养好的赭曲霉菌体,加入1 mL纯牛乳,梯度稀释,在室温条件下孵育30 min,4 ℃、4 000 r/min离心去除牛乳,用30 mL无菌水清洗菌体,4 ℃、4 000 r/min离心去除上清,重复多次,直至菌体离心后上清澄清,菌体在液氮中充分研磨,分别取50 mg研磨液,采用1.3.2节方法提取基因组DNA,用于PCR实验,剩余DNA保藏在-20 ℃。
1.4 数据处理
数据处理及绘图分别采用MEGA 6和Chem Draw 20软件完成。
2 结果与分析
2.1 生物信息学分析
OTA生物合成过程中的关键酶编码基因可作为检测OTA产生菌的靶标基因。目前,OTA的生物合成途径已基本阐明,主要涉及到3 种酶:首先,乙酰辅酶A和丙二酰辅酶A在聚酮合酶(polyketide synthase,PKS)的催化下生成7-甲基蜂蜜曲霉素[13];其次,NRPS催化苯丙氨酸与7-羧基蜂蜜曲霉素环连接[18];最后在OTAhal参与下,OTB加入氯原子形成OTA[14]。虽然PKS和NRPS的编码基因也可作为基因探针来识别真菌毒素生物合成基因簇(biosynthesis gene cluster,BGC),但很容易和其他同样由PKS或NRPS合成的非毒素次级代谢产物的BGC混淆,产生假阳性结果[19],而OTAhal作为催化OTA生成的关键酶,具有一定的特异性,OTAhal是比较理想的靶标基因,但是已报道的OTA产生菌有很多,主要属于曲霉属[20]和青霉属[21]两大类,它们含有的编码OTAhal的基因也不完全相同。此外,也存在含有编码OTAhal的基因、不产OTA的菌株[16]。因此在考虑上述问题的基础上,通过对不同的OTAhal编码基因进行多重序列分析比对(图3),针对产OTA菌株中的OTAhal基因序列设计特异性引物hal-F/R,对供试菌株进行PCR扩增。

图3 OTAhal基因相似度比对分析Fig. 3 Similarity comparison of OTAhal genes in OTA producers and nonproducers
2.2 检测特异性
由图4A可知,所有供试菌株均能扩增出ITS目标条带,证明菌株DNA提取良好且均为对应菌株。在此基础上对hal基因进行PCR,由图4B可知,只有赭曲霉菌能扩增出一条约251 bp的基因条带,其他菌株未扩增出该条带,证明该引物设计的特异性和有效性。黄曲霉菌和串珠镰刀菌也扩增出一些非特异性基因条带,可能是因为hal-F/R本身为兼并引物(引物长度分别为22、21 bp),且黄曲霉菌和串珠镰刀菌总基因组太大。但是食品中常见的冠突散囊菌、土壤伊萨酵母和酿酒酵母未扩增出任何基因条带。
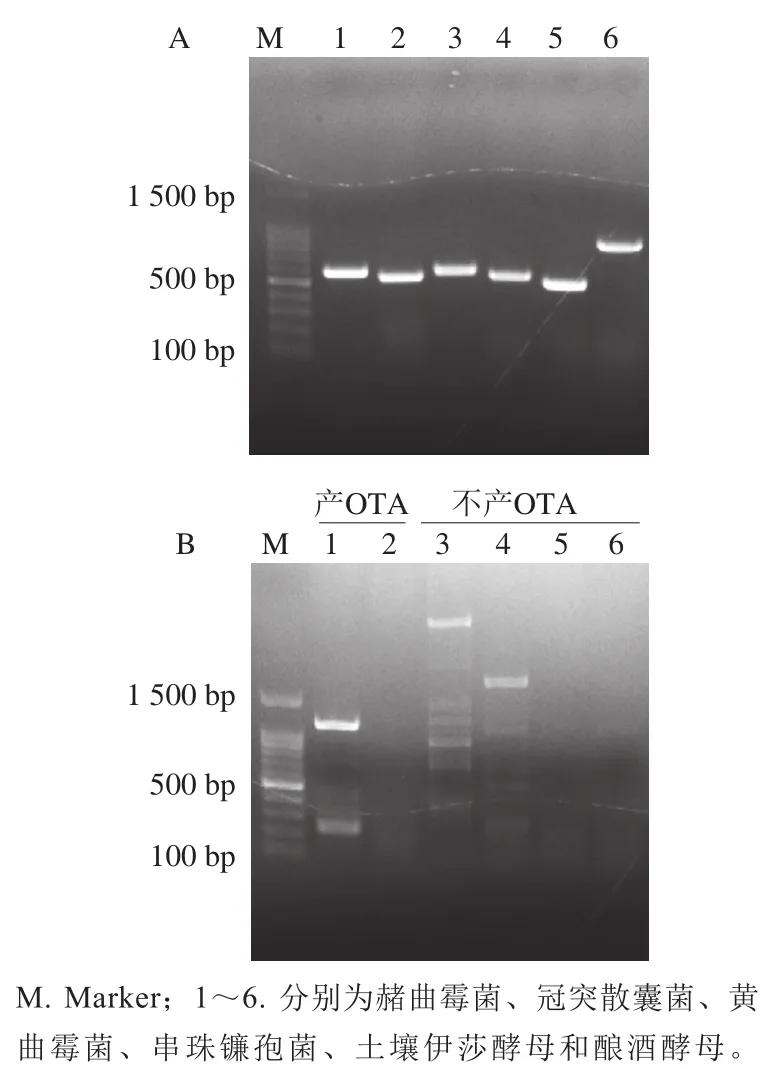
图4 引物ITS1/4(A)和引物hal-F/R(B)对供试菌株DNA的PCR扩增图谱Fig. 4 Electrophoresis images of PCR amplification products with primers ITS1/4 (A) and hal-F/R (B)
2.3 检测灵敏度
检测灵敏度关系到该方法的实用性,实验内容主要包括两方面:一是在纯培养条件下,对不同含量的赭曲霉菌基因组DNA进行PCR扩增;二是在1 ng赭曲霉菌基因组DNA中添加等量其他5 种菌株基因组DNA进行干扰,利用兼并引物hal-F/R进行目标条带PCR特异性扩增。
由图5A可知,在赭曲霉菌纯基因组DNA条件下,当DNA含量高于10-2ng时,以兼并引物hal-F/R进行PCR扩增,可以检测到目标条带,因此该方法的检出限为10-2ng。由图5B可知,当不同菌株基因组DNA和1 ng赭曲霉菌纯基因组DNA混合时,以兼并引物hal-F/R进行PCR扩增,同样可以检测到目标条带,因此该方法可以在多种菌干扰的条件下保持高灵敏度,具备推广到实际检测中的潜力。

图5 纯DNA(A)和混合DNA(B)条件下的灵敏度检测图谱Fig. 5 Sensitivity for detection of pure DNA (A) and mixed DNA (B)
2.4 人工污染牛乳检测结果
为了验证此方法能否快速、准确检测乳制品中赭曲霉毒素产生菌,向牛乳中添加不同量的赭曲霉菌,然后再从中提取基因组DNA,利用ITS1/4引物进行ITS目标条带扩增。由图6A可知,基因组DNA提取良好且为赭曲霉菌。在此基础上利用hal-F/R对OTAhal基因进行PCR扩增,由图6B可知,1 mL牛乳中,即使赭曲霉菌含量只有10-5mg/mL,也能准确地检测出OTAhal基因,进而判断出该乳制品中存在OTA的污染风险。
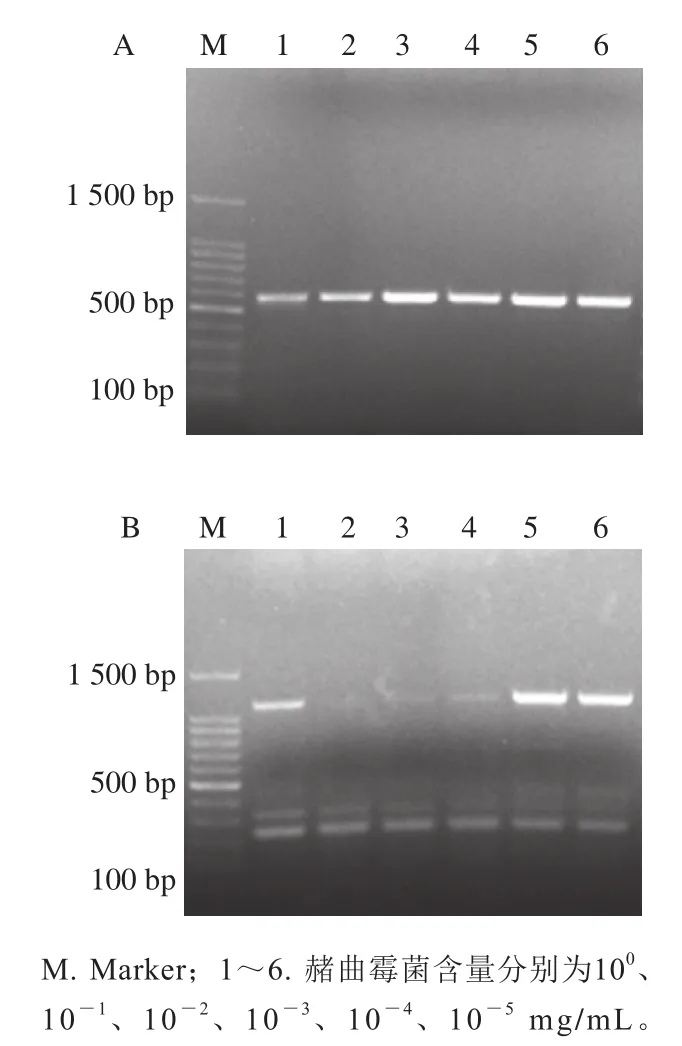
图6 引物ITS1/4(A)和引物hal-F/R(B)对样品基因组DNA的PCR扩增图谱Fig. 6 Electropherograms of PCR amplification products of genomic DNA from artificially contaminated sample with primers ITS1/4 (A) and hal-F/R (B)
3 讨 论
随着全世界范围内的食品安全问题越来越受重视,OTA的检测限量标准必将越来越严格。传统的检测方法成本高、灵敏度低,例如:王宇龙等[22]采用基于核酸适配体的侧流层析技术检测花生与葡萄干中OTA,检出限为0.51 ng/mL;李克等[23]采HPLC检测谷物中OTA,检出限为0.11 μg/kg;孙月等[24]采用HPLC-质谱检测粮食中的OTA,检出限为0.25 μg/kg;王兴龙等[25]采用稳定同位素直接稀释-超高效液相色谱-串联质谱法测定葡萄酒中OTA,检出限为0.10 μg/L。而且上述方法针对的是已被OTA污染食品的含量检测,无法在OTA污染前作出相应的预警,减少经济损失。本研究所建立的方法可弥补这方面的缺陷,不仅检测效率高,而且灵敏度也较高。虽然赭曲霉菌、黄曲霉菌和串珠镰刀菌出现了一些非特异性条带,但此问题或许可以通过延长兼并引物或者缩短延伸时间来克服。此外,在不增加实验步骤的前提下,为进一步提高准确性,还可以在OTA生物合成途径的其他关键酶编码基因上设计特异性引物,比如PKS和NRPS的相关区域,通过多重引物PCR的方法来实现更高的准确度。
4 结 论
通过在OTAhal基因区域设计探针,运用PCR技术有效检测出乳制品中OTA产毒真菌,本研究可作为乳制品中OTA潜在污染的快速、准确评判方法,为乳制品中OTA的污染提供有效预警,为保障我国乳制品安全做出贡献。
——曲霉菌

