促进学科思维建构的元素化合物教学
刘莹 黄国年
摘要:学科思维是基于学科知识,又高于知识的思维形式。中学化学元素化合物的教学是形成学科思维的重要领域。深入挖掘硝酸物理性质、硝酸不稳定性和强氧化性等化学性质中包含的知识内容,通过微观想象、联想对比、设计验证等学习手段,强化学生学科思维训练,为深入领会化学原理知识、形成知识体系和促进后续学习提供强有力支持。
关键词:化学教学;硝酸性质;学科思维;教学设计
文章编号:1008-0546(2022)01-0043-03中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.01.010
一、引言
科学技术日新月异,新领域不断开拓,新知识不断涌现。如果将化学知识一一罗列,都让学生学习的话,一来是内容不断推陈出新,学完不现实;二来是并不是所有知识都有学习的必要,要学有价值的。目前,很多学生常挂口头上的“刷题”,隐喻着知识(题目)有限性,认为全覆盖、快速地训练解题是学习有效途径。事实上,这种刷题的学习方式不仅是低效的,而且对学生身心也是有损害的。元素性质纷繁复杂,学习过程容易产生知识零散、杂乱不易记忆的困难,但门捷列夫将元素原子进行排序、比较、归类,从连续的元素性质中抽象出内在规律性,站在新的层面上对元素原子进行审视,提出元素周期律。有了元素周期律,众多的元素的一些性质就一览无余,整个化学世界一下子清楚了很多。我们的课堂教学,要从将化学知识进行前后联系,提炼出规律,形成学科思维,在学科思维的形成与运用中建构化学体系。
二、教学思想
“硝酸的性质”是人教新版第五章“化工生产中的重要非金属元素”中的重要组成部分。学习该内容前,学生已经了解硫元素相关知识,同时在氮及其化合物中也积累了大量元素化合物知识。由于知识点多,内容繁杂,部分学生无法厘清头绪,显现畏难情绪。针对这种苗头,我们认为不应该再基于知识讲知识,而应从知识中跳出来,用学科思维统领硝酸性质的学习。数学特级教师孙维刚认为:教学过程要“八方联系,浑然一体,漫江碧透,鱼翔浅底”。在硝酸性质的教学过程中,努力在不同的知识之间寻找共同点,在相似的知识点中寻找不同点,在不断比较概括中,逐渐提升到学科思维,形成知识体系。通过不断地学科思维训练,再俯看点滴知识时,就能达到“漫江碧透,鱼翔浅底”。
化学学科思维是基于学科知识,从学科知识中归纳、总结出来的,能够统领知识学习的思维方式。同时,学科思维也是化学观念形成的具体化,学科思维通过进一步提炼、升华。化学学科思维主要有微宏结合、原子守恒、有序排列、能量最低、模型想象等。在日常教学中,我们要注重从学科知识到学科思维的提炼,最终为学生形成学科观念。
三、教学过程
环节一:硝酸的物理性质
1.内容分析
硝酸是化工生产中极重要的一种强酸,物理性质与另一种刚学过的强酸——浓硫酸相差较大。常温下,浓硫酸是无色黏稠,密度相对较大的液体;浓硝酸往往略带浅黄色,易挥发的液体。不同点:浓硫酸无色黏稠,浓硝酸则显浅黄色不黏稠;浓硫酸不易挥发,但浓硝酸易挥发形成白雾,这又与浓盐酸类似。浓硫酸黏稠而浓硝酸易挥发,其本质是分子间作用力,主要是浓硫酸易形成分子间氢键,分子间作用力增加,所以黏稠;浓硝酸易形成分子内作用力,分子间作用力减少,所以易挥发。由于学生对氢键没有概念,所以这个过程通过学生近距离观察实验,通过科学想象、实物类比进行建构。
2.教学过程
【课前准备】每两位学生提供一块盖有玻璃片的点滴板,每块点滴板上滴加一滴浓硫酸和浓硝酸。
【提出任务】同学们,你们面前的点滴板里分别滴了少量浓硫酸和浓硝酸,请大家打开玻璃,观察一下两滴液体,分辨一下哪个是浓硫酸,哪个是浓硝酸?注意:浓硫酸和浓硝酸都是有强烈腐蚀性的,不可用手去触摸。
【学生1】打开后,冒白烟的是浓硝酸,无明显变化的是浓硫酸。因为浓硫酸不易挥发。
评析:虽然不熟悉浓硝酸的性质,学生根据浓硫酸的不挥发性,推断产生白雾的是浓硝酸,不挥发的是浓硫酸。教师注意纠正不是“白烟”,是“白雾”。
【学生2】用玻璃棒碰一碰液体,黏稠的是浓硫酸。
【引导】对于点滴板上的两滴液体,我们通过观察发现两种酸的不同点在于挥发性和黏稠性。为什么浓硫酸和浓硝酸的物理性质相差这么大?我们能否从分子视角来解释一下呢?
【师生合作】根据我们日常生活中曲别针的类比,一般的分子可简化为线型分子。根据浓硫酸的宏观黏性,可以想象硫酸分子就像一个个联在一起的曲别针,分子间的作用力相对线型分子更大;硝酸分子就像是一个个孤立的曲别针,分子间作用力相对线型分子更小。
3.教学评析
宏微结合、类比想象是化学学科的重要学科思维。对于化学物质物理性质的学习,教师通常以观察结合讲授的方式进行。由于教师缺乏学科思维的意识,在对物理性质的学习时,往往未能挖掘物理性质中蕴含的学科思维。如果缺乏化学学科思维意识,学生看问题、分析问题、找对策就会浮于表面无法抓住本质。本课中,化学往往以观察为起点,让学生近距离观察、对比,从而归纳出硝酸物理性质。在此基础上,引导学生透过宏观现象,如挥发性,深入到微观分子领域进行解释。此刻学生理解仍有难度,教师借助“曲别针”模型,借助类比迁移思维,到此,学生通过学科思维的运用,学生基本能够从化学视角来审视硝酸的物理性质。
環节二:硝酸的不稳定性
1.内容分析
硝酸的一个重要性质是不稳定性,在加热或光照时易分解。从能量观来看,就是硝酸分子本身蕴含能量较高。浓硝酸在一定条件下可以分解生成二氧化氮、氧气和水,联系到前面学的内容,二氧化氮、氧气和水又可以化合为硝酸。对比分析,主要在于反应物与生成物浓度的大小和反应的条件。为此,在长久保存硝酸,最好要避光、浓度不应过大,存放阴凉处。
2.教学环节
【引入】这是我刚从实验室取过来装浓硝酸的瓶子。看到这个瓶子,你获得哪些信息?
【学生】浓硝酸装在棕色瓶中,说明易见光分解。
【引导】浓硝酸在光照或加热的情况下确实会分解。我们来做个实验,请大家观察产生了什么物质,然后根据实验现象写出化学方程式。
【演示实验】如图1,在烧瓶中加入玻璃棉,加热后用分液漏斗滴入浓硝酸[1]。
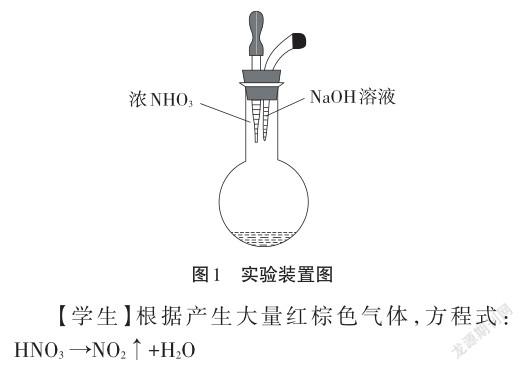
【教师】大量红棕色的气体是二氧化氮,那么,除了二氧化氮外,还有什么物质生成呢?请大家运用我们学过的哪些思维来推断。
【学生】这个反应是氧化还原反应,可以根据化合价升降来推断产物。
【总结】我们根据得失电子守恒和元素原子守恒可推知,硝酸光照或加热可以生成二氧化氮、氧气和水。
【过渡】观察这个方程式,借助前面的所学知识,二氧化氮、水和氧气也能化合生成硝酸。那什么时候硝酸分解?什么时候化合呢?
【师生合作】当硝酸保持一定浓度(控制变量)温度较高时,硝酸以分解为主,化合为次;温度较低时,以化合为主,分解为次。
【总结】分析可知,生成硝酸和硝酸分解,温度很重要。所以为了长时间保存浓硝酸,应选择在棕色瓶中,并置于阴凉处。
3.教学评析
浓硝酸的不稳定性是硝酸的重要性质。在教学过程中,通过学生观察实验,是化学学科实证思维的体现。在此基础上,运用元素守恒、电子守恒等学科思维,将化学方程式进行书写完善。教学过程并未到此为止,而是运用逆向思维和元素原子守恒,得出二氧化氮、氧气与水常温时还能化合成硝酸,与前面二氧化氮的性質进行联系。通过两个方程式符号表征上的对比分析,认为保持硝酸一定浓度时,温度改变是影响的重要因素。这些过程加深了可逆反应概念的认识,也为化学反应的限度提供了事实支撑。
环节三:硝酸的强氧化性
1.内容分析
硝酸最显著的化学性质是强氧化性。根据氧化还原思维,浓硝酸可将红热的碳发生氧化生成二氧化碳,自身还原为二氧化氮。碳与浓硝酸反应时,回顾浓硝酸的分解,并引导两个方程式进行对比分析,找出异同,从而对两反应在进一步意义上建构。硝酸的强氧化性还体现在与铜片反应上,写出化学方程式后,改写成离子方程式,并从离子角度对该反应进行建构,通过设计实验进行验证。
2.教学环节

碳与浓硝酸反应和浓硝酸的分解,这两个反应有什么内在关系么?(提示:可将碳与浓硝酸中的碳元素挡一挡)。
【学生】碳与浓硝酸反应,可以看作浓硝酸先分解,其分解的氧气再与单质碳反应。
【教师】我们能否再从能量角度来看一看,猜想下碳与浓硝酸反应的能量变化,是不是和浓硝酸的分解所需要的能量,碳与氧气反应放出的能量之和?这里面的关系,值得我们去探索。
【教师】除了金和铂外,硝酸氧化绝大多数的金属。请大家运用氧化还原反应原理来尝试书写铜与浓硝酸、稀硝酸的方程式,并预测实验现象。
【学生】书写并校对。
【教师】根据氧化还原反应原理写出了方程式。下面我们通过实验看看反应式是否正确?请用胶头滴管吸一小滴浓硝酸和稀硝酸分别滴在铜板上观察实验现象,要特别注意产生气体的颜色。
【过渡】过量的铜与稀硝酸反应后,如果加入稀盐酸,能否继续反应?
【学生讨论】不会。
【教师】在刚才铜板与稀硝酸反应后的溶液中,滴加稀盐酸,观察反应能否继续?
【实验】竟然还能继续反应,且生成无色气体。

【教师启发】硝酸是强电解质,在溶液中完全电离。在过量铜与硝酸反应后的溶液中,氢离子消耗贻尽。当我们加入稀盐酸时,本质是加入氢离子,根据离子方程式可知,铜就能与氢离子、硝酸根离子继续发生反应。我们原来判断不能反应,其错误的原因在哪儿?
【学生】未能认识到溶液中的反应其实是离子的反应。
【教师】刚才我们进行了铜与浓硝酸、稀硝酸的反应,虽然量比较少,但确实放出了有害气体。大家能否设计实验,防止这些反应不对环境造成危害?
【学生】(略)
3.教学评析
由于碳与浓硫酸反应学生已经学过,通过浓硫酸和浓硝酸强氧化性的相似点,学生不难写出碳与浓硝酸反应的方程式。在此基础上,教师将浓硝酸的分解与该反应式进行比较,不仅加深了两个反应的认识,而且为后续盖斯定律的学习埋下伏笔。铜与浓硝酸、稀硝酸反应的学习时,通过学生亲自进行实验,且是微量的浓硝酸和稀硝酸,不仅能让学生近距离观察到实验现象,而且也能直接闻到产生的微量NO和NO2,印象更加深刻,这又为后续设计铜与硝酸反应的绿色实验设计,保护环境提供了现实原因。为培训学生溶液反应中微粒(离子)观,教师提出问题引发学生提出假设,支持学生实验引发认知冲突,通过离子反应方程式来进行解释,引导学生要见宏知微,不能仅盯着宏观物质,要有化学思维。
三、后记
元素化学蕴含着丰富的知识、技能和学科思想方法,以及化学基本观念等教育价值[2]。元素化合物知识的教学,是形成有序的思维线索和结构化的知识体系相辅相承的过程。在传统的教学中,我们注重知识的传授,对学科思维的培养不够重视。或许很多年后,大部分化学知识都会遗忘,但看世界的化学视角却由于化学思维的训练而根植于学生体内。基于学科思维的元素化合物教学,要求化学教师要站在更高的层面上审视化学知识,不断归纳总结,比较分析,不仅为反应原理教学预留接口,也为挖掘学科思维提供方向。我们相信,当学科思维系统化、有序化后,化学观念就会逐渐形成,这对于提升学生生活水平和未来可持续发展都是大有裨益的。
参考文献
[1]付小勤.用“情境—问题—启发—讨论—探究”式教学方法设计硝酸的性质教学[J].新课程研究,2011(7):28-30.
[2]宋心琦.课程标准高中化学(必修)元素化学教学之我见[J].中学化学教学参考,2011(6):3-6.

