走向真实情境的项目式学习的教学实践
丁浩 黄金泉 韩竹海
摘要:鉴于传统高三复习中存在的一些弊端,重构以培养学生化学核心素养为主旨,探讨多模块知识融合,选择将知识情境化、情境问题化的高三复习教学模式,形成了走向真实情境的项目式学习的教学手段。文章以“灭菌剂ClO2的学习”为总任务,分解成“实验室制取ClO2”和“ClO2的用途及其工作原理”两个子任务,围绕“ClO2的制备原理、实验装置、测定ClO2水溶液的纯度”以及“ClO2结构及其性质、ClO2水体消毒原理及其副产物、水体除锰优化条件探究”等方面探索高三复习课实施项目式学习的教学方法,以期体验理论与实践相结合的物质制备及性质的探究过程,提升学生的学科关键能力。
关键词:真实情境;项目式学习;高三复习;二氧化氯
文章编号:1008-0546(2022)01-0010-06中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.01.003
*本文系江苏省“十三五”教育科学规划课题“‘教学做合一’思想下高中化学项目式学习的研究”(批准号:TY-c/2020/04)阶段性成果。
一、问题的提出
1.高三化学复习课现状
高三复习课堂普遍存在着“乏味”的“题海战术”,一方面教师“滔滔不绝”,另一方面学生却“昏昏欲睡”,复习效率低下。老师们总喜欢凭借自己固有的经验上课,喜欢按现成复习资料编排的體系上课,即所谓一轮复习梳理知识、二轮复习专题复习、三轮模拟训练,但这种做法耗时费力;更有甚者江苏高考近几年来根本不涉及的内容,有的老师却还在乐此不疲地进行“拉网式”复习,过度教学严重,造成了时间和精力的浪费。这种“以题代练”的复习方式,高耗低效,把活生生的学生当“做题机器”,结果是做了一些与高考不太相干的废题,学生一旦遇到新情境的题目依旧是“一筹莫展”,甚至“无从下手”,显然,高三的化学复习课堂令人堪忧。
2.项目式学习
高中化学新课程标准(2017年版)倡导真实问题情境的创设和基于综合性问题解决的主题式教学。而项目式学习是通过设置一个真实情境化的任务,学生作为项目学习的主体在完成项目任务的过程中与教师不断对话来诊断其学习障碍点,发展其核心素养,同时解决问题的综合能力得到提升[1]。项目式学习是秉承“做中学”的理念,让学生在真实、复杂问题的解决过程中提升理解和运用化学知识的综合能力,有效帮助学生将知识内化为能力和素养,从而实现“知识、能力、素养”一体化的教学。
3.项目式学习在高三复习中的意义
针对高三复习课堂上“炒冷饭”的现象,实施项目式学习就显得很有必要。一则项目式学习是基于真实情境,能使学生感受到自己在学真实的化学,感受到化学知识的实用性,增强了学化学的内驱力;二则学生在创设的“以任务为驱动,以问题为导向”的真实情境中,时时刻刻面临新的问题新的挑战,他们在解决一个个真实问题的过程中收获了知识、提升了学科能力、培养了学科素养;再则项目式学习重视学科内核心知识的融合,学生通过项目式学习,能内化学科内核心知识,体验真实问题的复杂性、综合性,在项目式学习过程中学生既能独立思考又能共享交流,学生的思维不断碰撞,思维品质得以提升。
二、走向真实情境的项目式学习的教学案例设计与实施
1.项目设计意图
本节内容选择“灭菌消毒剂ClO2”作为项目主题,引领学生走向真实情境的项目式学习。在实验室制备ClO2过程中,体验从原理到实验设计再到实验改进的过程,培养“科学探究与创新意识”的核心素养;在性质及应用的学习过程中,体验“结构-性质-用途”的化学学科思想,培养“宏观辨识与微观探析”“科学态度与社会责任”的核心素养。
2.项目学习目标
(1)通过ClO2制备原理的分析以及工业上制备方法的介绍,体验实际生产的丰富性,深刻体会到基础理论的重要性。
(2)通过模拟工业生产进行实验室制备ClO2的设计,掌握并应用“价-类”二维图设计无机物转化的一般方法,构建实验室制取气体的一般模型,培养学生的工程思维能力。
(3)通过ClO2消毒剂性质及应用的学习,进一步理解“结构-性质-用途”的化学学科思想,树立正确的科学态度和社会责任感。
3.项目流程设计
项目流程设计见图1。
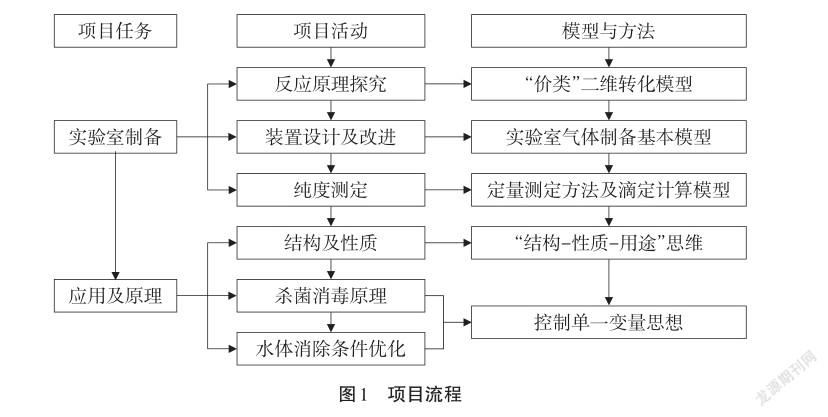
4.项目实施过程
引入:二氧化氯在杀菌消毒、水体处理、漂白除臭等方面具有安全、高效、环保和广谱性,那么,何谓二氧化氯?
过渡:ClO2因为具有杀菌能力强,对人体及动物没有危害以及环境不造成二次污染等特点而备受人们的青睐。主要用途在自来水的消毒和面粉、木质纸浆的漂白等。但是,ClO2极易分解发生爆炸,受热、光照或遇有机物等能促进氧化作用的物质时,均会促进分解甚至引起爆炸,因而需随制随用。实验室如何来制备二氧化氯?
任务一:实验室制取二氧化氯
活动1:探究二氧化氯的制备原理
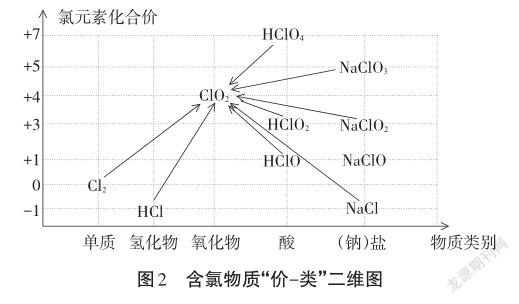
交流研讨:常见的较稳定的含氯物质有HCl、Na? Cl、Cl2、HClO2、NaClO2、NaClO、HClO4、NaClO3等。请以上述含氯物质为原料,利用”价-类”二维图讨论二氧化氯的制备方案(见图2)。
学生:从“价-类”二维图中可知,上述含氯物质转化为二氧化氯均发生了化合价变化。从价态角度看,二氧化氯中氯元素价态为+4,处于中间价态,可以寻找较强的氧化剂,将低价态的氯元素氧化为二氧化氯;也可以寻找合适的还原剂,将高价态的氯元素还原成ClO2。
设计意图:“价类二维图”是以元素为核心,从类别和价态两个角度来认识物质性质和转化的二维坐标图。高三复习阶段,让学生从价类二维图的角度分析物质间可能的转化,有助于学生构建知识体系,形成多角度认识物质转化的思维模型。
提出问题:如何寻找合适的氧化剂和还原剂?
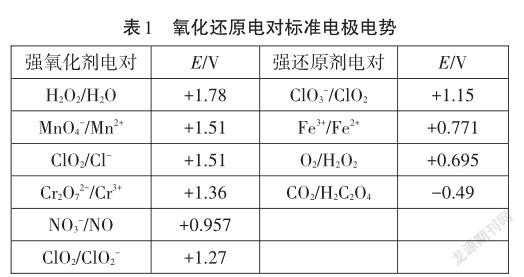
知识链接:根据热力学定义,在标准状况下,可以根据电极电势的大小判断氧化剂、还原剂的相对强弱和氧化还原反应的方向。


交流研讨:上述“价-类”二维图中物质的转化均能实现吗?请根据以下表1中常见氧化剂、还原剂电极电势的大小[2],从热力学角度分析可能发生的制备二氧化氯的反应原理,并解释原因。






ClO2为黄绿色有强烈刺激性臭味的气体,沸点为11℃;极易溶于水但与水不反应,水溶液相对稳定;溶于碱溶液生成亚氯酸盐和氯酸盐;空气中的浓度超过10%便有爆炸危险。
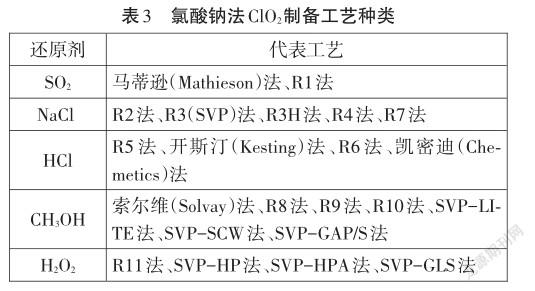
学生汇报实验思路:先使用亚硫酸钠和中等浓度的硫酸制备SO2,然后将SO2气体通入盛有氯酸钠溶液和稀硫酸的烧瓶中进行反应,再用向上排空气法收集产生的ClO2气体,最后进行尾气处理。
提出问题:用排空气法收集ClO2是否存在安全隐患?如若存在安全隐患,如何进行改进?
学生:会产生安全隐患,根据信息当空气中的体积分数超过10%时便有爆炸危险。考虑到ClO2易溶于水,不与水反应,且其水溶液较稳定,因此我觉得可以用水直接吸收ClO2,这样既可以防止爆炸,又便于课堂观察。
提出问题:用水直接吸收ClO2的想法不错,是用冰水好还是用常温下的水好?
学生:肯定是用冰水好,因为它的沸点只有11℃,温度越低越好。
教师展示整套装置(见图3)并课堂演示:
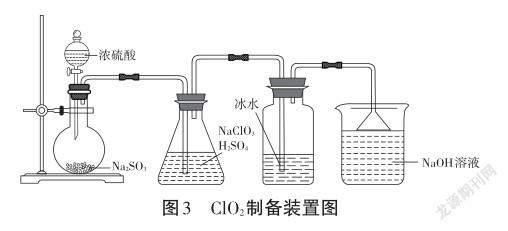
活动三:测定ClO2水溶液的纯度
交流研讨:请设计定量测定ClO2溶液纯度的实验方案
学生1:(沉淀质量法)将ClO2转化为Cl-,然后加入足量的经硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,通过测定生成的AgCl质量计算ClO2的纯度。
学生2:(气体质量法)将ClO2转化为Cl2,用过量的碱石灰吸收,通过测定碱石灰反应前后的质量差,测定Cl2质量,计算ClO2纯度。
学生3:(气体体积法)将ClO2转化为Cl2,用排饱和食盐水法测定Cl2体积,通过测定生成的Cl2的体积,计算ClO2含量;
学生4:(滴定法)利用ClO2的氧化性,用已知浓度的标准液直接或间接滴定,找到标准液与ClO2的比例关系,通过测量标准液消耗的量,计算ClO2纯度。
教师一一点评,然后按照学生4的方案进行演示(具体操作如下):

学生:不清楚
教师:一般用作指示剂的淀粉通常是直链淀粉,是笼状结构,它会吸附I2,把它藏起来,如果不这样操作,即使溶液的蓝色消失,也不能说明滴定达到终点,产生的误差比较大。
设计意图:意在引导学生重视真实实验情境下的问题解决,如实验过程的分析与理解,实验现象的判断与预测,实验条件的控制与优化,实验方案的设计与评价等。培养学生实验探究的综合能力,帮助学生综合运用化学实验原理和方法,设计实验方案解决简单化学问题。
任务二:ClO2的用途及工作原理
活动1:ClO2结构及其性质
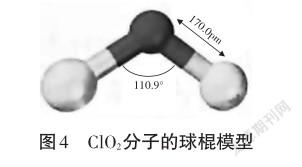
交流研讨:ClO2为V型分子,键角110.9°,氯原子的价电子排布为3s23p5,只有一个未成对电子,怎样才能结合两个氧原子的呢?ClO2中心原子的杂化方式、分子中的共價键的类型以及分子的空间构型是怎样的?
学生:ClO2中,中心原子Cl为sp2杂化,其中两个杂化轨道与O原子形成σ键,另一个杂化轨道有一孤电子对。根据价电子对互斥理论可知,排斥力:孤电子对-孤电子对>>孤电子对-成键电子对>>成键电子对-成键电子对,故氯氧键键角小于120°,为110.9°。这就决定了ClO2的空间构型是V型或角型。
教师点评:回答得很好!投影ClO2分子的球棍模型(见图4)。
提出问题:ClO2的高效杀菌消毒能力和Cl2相比如何体现?
活动2:ClO2水体消毒原理及其副产物
过渡:用传统的液氯和氯气处理自来水会产生三氯甲烷、氯酚、氯胺等致畸致癌物质,而ClO2不会与水中的有机化合物反应产生这类有毒物质,除了消毒、杀菌、除去金属离子外,ClO2在自来水的除臭脱色等方面也有较好的效果。

二氧化氯发生过程中,原料反应不充分,氯酸盐随着二氧化氯一起被投到待处理水中;二氧化氯不稳定,暴露在阳光下、高温或者其他条件下自身分解,同时产生亚氯酸盐和氯酸盐;二氧化氯与被处理的水体作用时,发生氧化还原反应,生成亚氯酸盐和氯酸盐;在碱性水体中,二氧化氯发生歧化反应生成亚氯酸盐和氯酸盐。
过渡:认识副产物的转化过程的规律,有助于进一步正确评价ClO2消毒工艺的安全性,为正确使用ClO2提供理论依据。

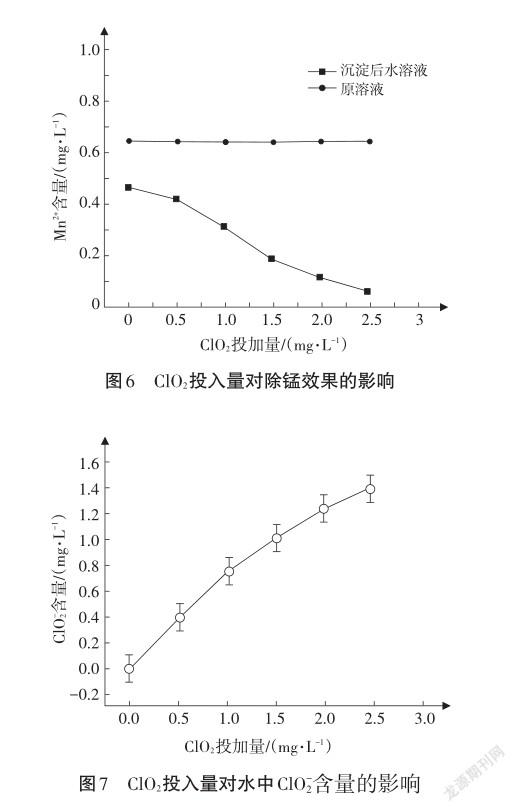
控制pH為7.0~8.0,调节ClO2的投入量,沉淀后水溶液Mn2+含量和ClO-2含量如图6、图7所示:
提出问题:从上述图像的变化趋势中,你能得出什么结论?
学生1:锰的含量基本上随pH升高而降低,故pH越高,越有利于Mn2+的去除。
学生2:ClO2浓度的增大一定程度上能增大Mn2+的去除率,pH在7~8时,ClO2的浓度越大,越有利于Mn2+的去除,但同时也会使副产物ClO-2的含量越来越高。
过渡:碱性溶液中,ClO2会歧化,如何控制二者的量以及ClO2的投加点?
探究二:ClO2投加时间点对除锰效果和亚氯酸盐含量的影响(提示:同时是指ClO2和絮凝剂同时间点投加)
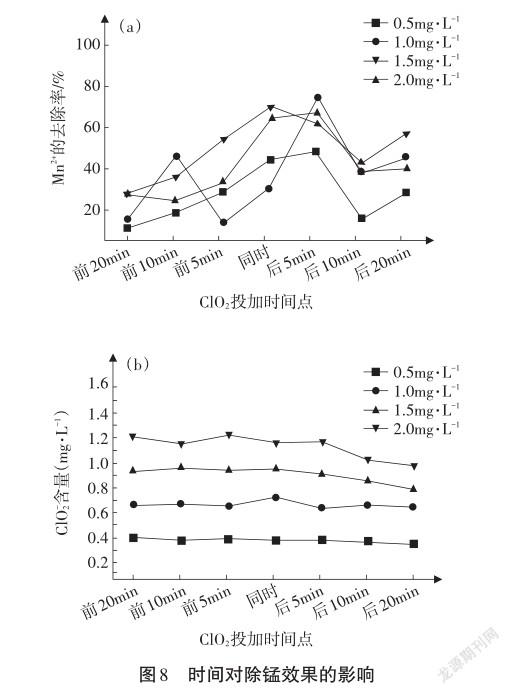
过渡:在其他条件相同的情况下,进行不同投加时间点的预氧化除锰实验,测定Mn2+的去除率和ClO-2含量如图8所示。
提出问题:请根据图像分析变化趋势,由此你能得出什么结论?
学生1:由图8(a)可知,投加时间点与絮凝剂投加时间点接近时,除锰效果较好,而在加入絮凝剂5min后投加ClO2的除锰效果相对最好。
学生2:由图8(b)可知,亚氯酸盐生成量主要取决于ClO2投加量,ClO2投加量越大,亚氯酸盐生成量越大。随着投加点越来越靠后,亚氯酸盐生成量有减少趋势。
教师总结:碱性条件下(较高pH)有利于ClO2和Mn2+反应,即Mn2+易被氧化成四价锰而沉淀,从而提高除锰效果;同时,二氧化氯是一种酸性气体,溶于水又会在一定程度上降低水的pH。
设计意图:综合应用化学学科知识与方法解决复杂、陌生情境问题,是学生化学学科能力的综合体现。解决综合探究性问题首先要具有良好的信息素养,能有效地获取和加工信息,建立情境信息与已有知识和问题指向之间的联系。其次要能准确分析问题情境,确定问题指向,通过分析比较、类比迁移、概括推理等方法,确定解决问题的方向和途径。高三复习阶段如果一味单纯地简单重复知识对大多数学生而言是无效的,只有经过深度理解和构建的知识,把知识转化为解决问题的能力,才能在新的复杂情境中迁移运用。如何培养学生在新情境中获取、加工并处理信息的能力,平时教学中就要多多挖掘新素材、新情境加以训练。
小结:ClO2的用途,如杀菌消毒、脱色漂白、水处理剂、除臭、重金属去除、保鲜、石油井去堵、灭藻等。
三、实践反思
从本项目实施情况和课堂上学生的表现来看,学生的成就感和参与度明显提升。究其原因一方面环环相扣的驱动性问题激发了他们极大的兴趣,引发他们的思维碰撞,在面对真实的化学问题情境时,他们充分运用所学的化学知识,努力尝试着去解决,在一个个真实问题的解决过程中收获了知识、提升了学科关键能力、培养了学科素养;另一方面,教师通过有效的追问促进了学生不断反思其认识思路和角度,外显其思维过程,诊断了学生的学习发展障碍点,提升了其解决问题的能力,并潜移默化地指导学生在后续的元素化合物的学习中,主动调用“价-类”二维图模型去解决问题,自觉形成用二维图工具复习其他元素及其化合物的思路和方法。
参考文献
[1]江合佩.促进学生核心素养发展的项目式学习研究与实践——以“废旧锂离子电池回收利用”为例[J].教育与装备研究,2019(9):60-67.
[2]江合佩.走向真实情境的项目化学习[M].济南:山东科学技术出版社,2020:4.
[3]江合佩.走向真实情境的项目化学习[M].济南:山东科学技术出版社,2020:30.
[4]江合佩.走向真实情境的项目化学习[M].济南:山东科学技术出版社,2020:31.

