SOCS3 在弥漫大B 细胞淋巴瘤患者外周血单个核细胞中的表达及其对OCI-LY7 细胞自噬和凋亡的影响
孙文雄, 李 蒲
(南昌大学第一附属医院国家药物临床试验机构血液科,江西 南昌 330006)
弥漫大B 细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL) 是最常见的非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL),约占每年NHL新发病例的24%[1]。DLBCL 具有侵袭性,患者通常表现为淋巴结迅速肿大和全身症状,需要立即治疗[2]。虽然大多数患者表现为淋巴结病,但结外病变的发生率较高。最常见的前期治疗是R-CHOP化疗(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松),可治愈50%~60% 的患者[3]。但对于在前期治疗中难以治愈的或缓解后复发的患者,预后较差,采用利妥昔单抗治疗后,只有少数患者获得了长期缓解[4]。信号传导抑制因子3(suppressors of cytokine signaling 3,SOCS3) 是信号传导抑制因子(suppressors of cytokine signaling,SOCS) 家族的成员之一,作为重要的肿瘤抑制因子,SOCS3 的表达或功能受损在各种肿瘤的发生发展和转移过程中起着关键作用[5-6]。研究[7]显示:SOCS3 的异常表达或功能异常在胰腺癌的调控、进展和转移中起关键作用。此外还有研究[8]显示:SOCS3 通过调节Janus 激酶(Janus kinase,JAK) /信号转导和转录激活因子(signal transducer and activator of transcription,STAT) 信号通路介导的细胞炎症反应,对细菌性炎症疾病和动脉粥样硬化的治疗有重要意义。但SOCS3 在DLBCL 中作用的研究较少且机制尚不明确。因此,本研究通过检测SOCS3 在DLBCL 患者外周血单个核细胞和DLBCL 细胞中的表达,同时观察过表达SOCS3 对DLBCL 细胞增殖、 自噬和凋亡的影响,以期为DLBCL 的治疗提供新的靶点和科学依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人B 淋巴细胞和人DLBCL 细胞(OCI-LY7 细胞) 购自中国科学院上海细胞生物学研究所。人淋巴细胞分离液(上海博升生物科技有限公司),RPMI-1640 培养基和胎牛血 清( 美 国Gibco 公 司),pcDNA3.1-NC 和pcDNA3.1-SOCS3 (上海吉玛制药技术有限公司),LipofectamineTM3000 (美国Invitrogen 公司),5-溴-2-脱氧尿嘧啶(5-bromo-2-deoxyuracil,EDU)试剂盒和Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒(美国Abcam 公司),HEPES 缓冲液(美国Thermo Fisher 公司),TRIzol 试剂、RIPA 裂解液和BCA 试剂盒(北京索莱宝生物科技有限公司),PrimeScriptTM1st Strand cDNA Synthesis 试剂盒和TB GreenTMPremix Ex Taq Ⅱ试 剂 盒( 日 本TaKaRa 公司),SOCS3、 微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)、 Janus 激酶2 (Janus kinase 2,JAK2)、 磷酸化JAK2 (p-JAK2)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3 (p-STAT3)、GAPDH和IgG-HRP 抗体(美国Cell Signaling Technology公司),Alexa Fluor 488 标记羊抗兔IgG (H+L)二抗(美国Thermo 公司)。徕卡DM750 显微镜(德国徕卡公司),流式细胞仪(美国BD 公司)。
1.2 标本来源选取2018 年6 月—2020 年1 月于南昌大学第一附属医院就诊的DLBCL 患者100 例作为研究对象,其中男性54 例,女性46 例,患者平均年龄(55.2±6.43) 岁;生发中心B 细胞样型53 例,非生发中心B 细胞样型47 例。同时选取50 名健康志愿者为对照组,性别构成和平均年龄与DLBCL 患者具有可比性。受试者均签署知情同意书,研究方案获得南昌大学第一附属医院伦理委员会的批准。采集所有DLBCL 患者和健康志愿者的外周静脉血,利用淋巴细胞分离液提取外周血单个核细胞,加入TRIzol 溶液1 mL,-80 ℃条件下保存备用。
1.3 细胞培养和分组人B 淋巴细胞和OCI-LY7细胞用含10% 胎牛血清的RPMI-1640 培养基,置于37 ℃、5% CO2的细胞培养箱中培养,2 d 更换1 次培养基。OCI-LY7 细胞分为pcDNA3.1-NC 组和pcDNA3.1-SOCS3 组,待细胞生长融合至60%时,按照LipofectamineTM3000 转染试剂说明书进行转染,将pcDNA3.1-NC 或pcDNA3.1-SOCS3转染至OCI-LY7 细胞中,最终转染浓度为100 nmol·L-1。转染后在37 ℃、5% CO2的培养箱中培养6 h,更换新鲜培养基继续培养。48 h 后结束培养,收集各组细胞进行后续实验。
1.4 实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法检测不同细胞中SOCS3 mRNA 表达水平TRIzol 试剂提取受试者外周血单个核细胞、人B 淋巴细胞、OCI-LY7 细胞和转染组OCI-LY7 细胞总RNA。使用紫外分光光度计检测总RNA。采用PrimeScriptTM1st Strand cDNA Synthesis 试剂盒将提取的RNA 逆转录成cDNA,采用TB GreenTMPremix Ex Taq Ⅱ试剂盒进行RT-qPCR,步骤严格按试剂盒说明书完成。经StepOnePlus 实时PCR 系统完成实验后,采用2-△△Ct法计算SOCS3 mRNA 表达水平。SOCS3 引物:上游引物序列5′-CCTGCGCCTCAAGACCTTC-3′,下游引物序列5′-GTCACTGCGCTCCAGTAGAA-3′; GAPDH 引物: 上游引物序列5′-CATGTACGTTGCTATCCA-GGC-3′,下游引物序列5′-CTCCTTAATGTCA-CGCACGAT-3′。
1.5 EDU 实验检测2 组细胞中EDU 阳性细胞率OCI-LY7 细胞接种于24 孔板中,置于37 ℃、5%CO2的细胞培养箱中培养。待细胞生长融合至60%时,按上述方法进行转染分组。48 h 后,每孔中加入100 μL 含100 μmol·L-1EDU 的完全培养基,继续在37 ℃、5% CO2的细胞培养箱中孵育2 h,吸取培养基后,将细胞在4% 多聚甲醛溶液中固定15 min,PBS 缓冲液洗涤细胞2 次,在0.5%Triton X-100 溶液中孵育20 min,PBS 缓冲液洗涤细胞2 次,在黑暗中与Apollo 染色液孵育30 min,PBS 缓冲液洗涤细胞2 次,并用Hoechst 33342 染色30 min。PBS 缓冲液洗涤细胞2 次,在荧光显微镜下观察,随机选择5 个视野,记录在该范围内染成红色的阳性细胞数,计算EDU 阳性细胞率,代表细胞增殖能力。
1.6 细胞免疫荧光染色检测2 组细胞中LC3 阳性细胞率将OCI-LY7 细胞按照1×105/孔的密度接种于24 孔细胞培养板,每孔置有细胞爬片,转染pcDNA3.1-NC 和pcDNA3.1-SOCS3 质粒48 h 后,将细胞培养基吸走,PBS 缓冲液洗3 次,每次5 min;4% 多聚甲醛固定细胞15 min,PBS 缓冲液洗涤3 次,每次5 min; 破膜液(PBS 缓冲液+0.2% Triton X-100) 室温处理细胞30 min,封闭液(PBS 缓冲液+0.2% Triton X-100+10% 驴血清) 室温处理细胞1 h,LC3 一抗(1∶500) 4℃孵育过夜;次日,回收一抗,细胞用PBS 缓冲液洗涤3 次,每次5 min; 室温避光孵育荧光二抗(IgG,1∶1 000) 1 h,PBS 缓冲液洗涤3 次,每次5 min。最后用含有荧光淬灭剂的封片剂封片。在荧光显微镜下随机选取10 个视野,计数绿色的LC3 阳性细胞数并计算LC3 阳性细胞率,以LC3阳性细胞率代表细胞自噬水平。
1.7 流式细胞术检测2 组细胞凋亡率和不同细胞周期细胞百分率OCI-LY7 细胞转染48 h 后,用冷PBS 缓冲液洗涤3 次,1 000 g 离心5 min 弃去上清液。检测细胞凋亡率时将HEPES 缓冲液、Annexin-Ⅴ/FITC 溶液和PI 溶液(50∶1∶2) 混合,使细胞在室温黑暗环境下用混合溶液染色15 min,然后用1 mL HEPES 缓冲液处理,震荡混匀后,利用流式细胞仪在激发光波长为488 nm 处检测细胞凋亡率。检测不同细胞周期细胞百分率时先用PBS 缓冲液将细胞密度调整为1×105mL-1,然后将悬浮液依次用1 mL 预冷的75% 乙醇处理1 h,1 000 g 离心5 min 弃上清,PBS 缓冲液洗涤3 次,100 μL RNase A 处理,在37 ℃黑暗环境下孵育3 min,在4 ℃条件下用400 μ L PI 染色30 min,再利用流式细胞仪在激发光波长为488 nm处检测不同细胞周期细胞百分率。
1.8 Western blotting 法检测2 组细胞中SOCS3、LC3 Ⅱ、LC3 Ⅰ、p-JAK2 和p-STAT3 蛋白表达水平OCI-LY7 细胞转染48 h 后,RIPA 裂解液裂解细胞,收集总蛋白,通过BCA 法测定总蛋白含量,并将配对的样品调节至相同浓度。样品经变性后,10% SDS-PAGE 电泳并转移到PVDF 膜上。室温下,PVDF 膜在5% 脱脂奶粉中封闭1 h,在4 ℃条件下与SOCS3 抗体(1 ∶1 000)、 LC3 抗体(1 ∶1 000)、p-JAK2 抗体(1∶1 000)、 JAK2 抗体(1∶1 000)、 p-STAT3 抗 体(1∶1 000)、STAT3 抗 体(1 ∶1 000) 和GAPDH 抗 体(1 ∶2 000) 孵育过夜。PVDF 膜在TBST 中洗涤3 次,并与IgG-HRP 抗体(1∶4 000) 在室温下孵育1 h。PVDF 膜在TBST 中洗涤3 次,显影曝光,采用Image-Pro Plus 图像分析系统对蛋白条带的灰度值进行分析。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。计算LC3Ⅱ/LC3Ⅰ比值,以LC3Ⅱ/LC3Ⅰ比值代表细胞自噬水平;p-JAK2 蛋白表达水平以p-JAK2 与JAK2 比值表示,p-STAT3 蛋白表达水平以p-STAT3 与STAT3 比值表示。
1.9 统计学分析采用SPSS 20.0 统计软件进行统计学分析。细胞中SOCS3 mRNA 表达水平、EDU 阳性细胞率、LC3Ⅱ/LC3Ⅰ比值、LC3 阳性细胞数、细胞凋亡率、不同细胞周期细胞百分率和细胞中JAK2/STAT3 信号通路蛋白表达水平均符合正态分布,以xˉ±s表示,2 组间样本均数比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组受试者外周血单个核细胞、人B 淋巴细胞和OCI-LY7 细胞中SOCS3 mRNA 表达水平与对照组(1.15±0.18) 比较,DLBCL 组患者外周血单个核细胞中SOCS3 mRNA 表达水平(0.52±0.23) 明显降低(P<0.01); 与人B 淋巴细胞(1.09±0.12) 比较,OCI-LY7 细胞中SOCS3 mRNA 表达水平(0.63±0.25)明显降低(P<0.01)。
2.2 2 组细胞中SOCS3 mRNA 和蛋白表达水平与 pcDNA3.1-NC 组(1.05±0.05) 比较,pcDNA3.1-SOCS3 组细胞中SOCS3 mRNA 表达水平(1.56±0.21)明显升高(P<0.01); 与pcDNA3.1-NC组(0.08±0.03) 比较,pcDNA3.1-SOCS3 组细胞中SOCS3 蛋白表达水平(0.45±0.09) 明显升高(P<0.01)。见图1。

图1 2 组细胞中SOCS3 蛋白表达电泳图Fig.1 Electrophoregram of expressions of SOCS3 protein in cells in two groups
2.3 2 组细胞中EDU 阳性细胞率与pcDNA3.1-NC组(35%±2%) 比较,pcDNA3.1-SOCS3 组细胞中EDU 阳性细胞率(8%±3%) 明显降低(P<0.01)。见图2。
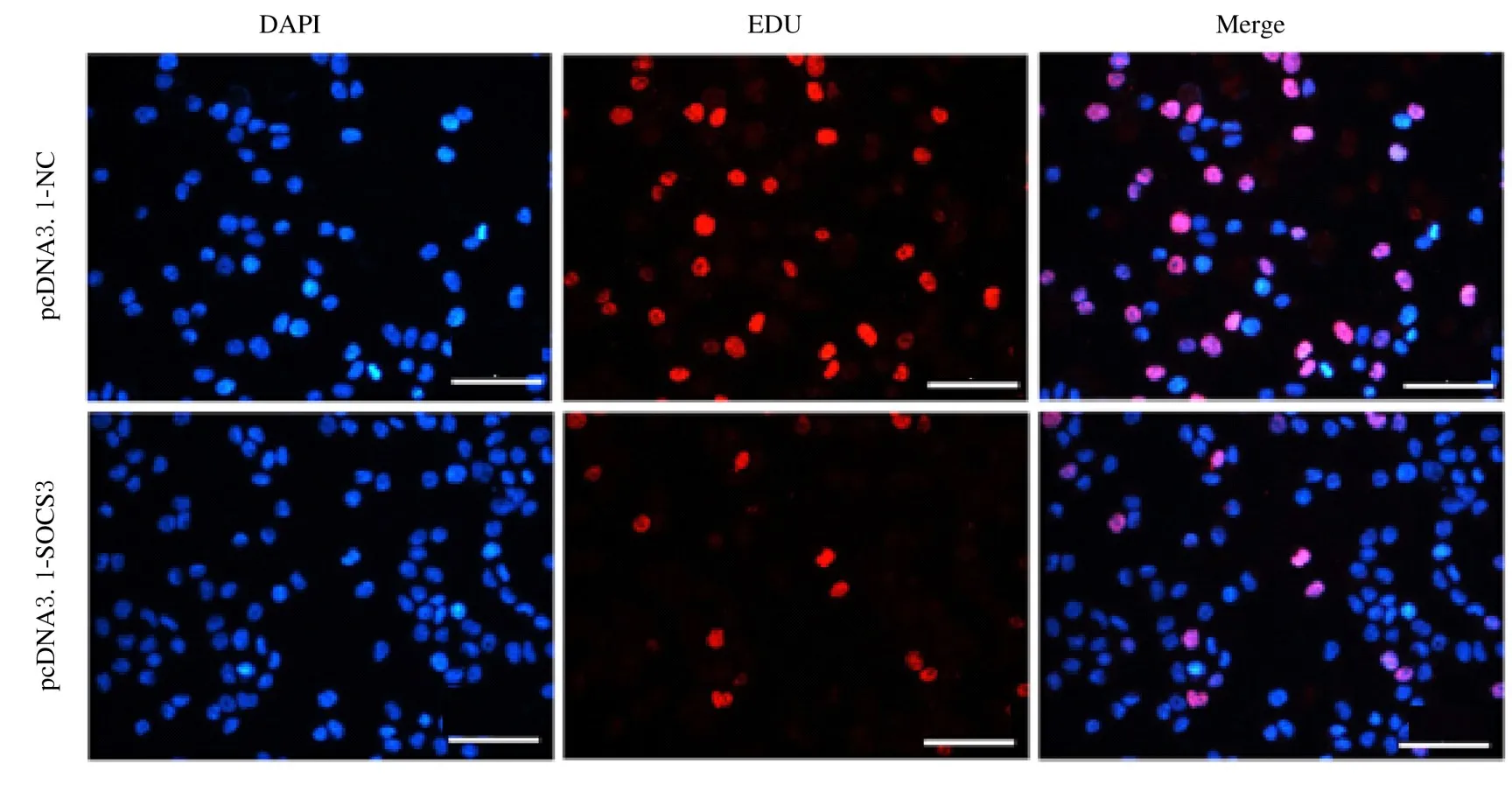
图2 2 组细胞EDU 染色结果(Bar=50 μm)Fig.2 Results of EDU staining of cells in two groups(Bar=50 μm)
2.4 2 组细胞中LC3 Ⅱ/LC3 Ⅰ比值和LC3 阳性细胞率与pcDNA3.1-NC 组(2.23±0.21)比较,pcDNA3.1-SOCS3 组 OCI-LY7 细胞中LC3Ⅱ/LC3Ⅰ比值(0.97±0.25) 明显降低(P<0.01)。与pcDNA3.1-NC 组(36%±3%) 比较,pcDNA3.1-SOCS3 组细胞中LC3 阳性细胞率(18%±2%) 明显降低(P<0.01)。见图3 和4。

图3 2 组细胞中LC3 Ⅰ和LC3 Ⅱ蛋白表达电泳图Fig.3 Electrophoregram of expressions of LC3 Ⅰand LC3Ⅱproteins in cells in two groups
2.5 2 组细胞凋亡率和不同细胞周期细胞百分率与pcDNA3.1-NC 组(9.23%±2.54%)比较,pcDNA3.1-SOCS3 组OCI-LY7 细胞凋亡率(32.89%±2.21%) 明显升高(P<0.01)。见图5。与pcDNA3.1-NC 组(G0/G1期40.32%±3.45%、S 期45.94%±2.87% 和G2/M 期14.75%±2.28%) 比较,pcDNA3.1-SOCS3 组细胞中G0/G1期细胞百分率(69.18%±2.54%) 明显升高(P<0.01),S 期细胞百分率(15.35%±2.68%)明显降低(P<0.01),而G2/M 期细胞百分 率(15.26%±2.48%) 差异无统计学意义(P>0.05)。见图6。

图5 流式细胞术检测2 组细胞凋亡率Fig.5 Apoptotic rates of cells in two groups detected with flow cytometry
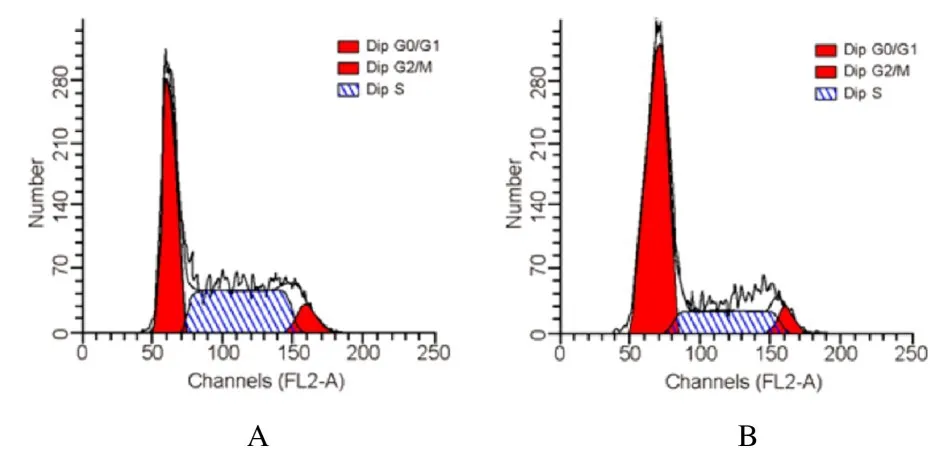
图6 2 组不同细胞周期细胞百分率Fig.6 Percentages of cells at different cell cycles in two groups
2.6 2 组细胞中p-JAK2 和p-STAT3 蛋白表达水平与pcDNA3.1-NC 组(0.72±0.12 和0.72±0.12) 比较,pcDNA3.1-SOCS3 组细胞中p-JAK2和p-STAT3 蛋白表达水平(0.21±0.08 和0.22±0.06) 明显降低(P<0.01)。见图7。

图7 2 组细胞中JAK2/STAT3 信号通路相关蛋白表达电泳图Fig.7 Electrophoregram of expressions of JAK2/STAT3 signaling pathway related proteins in cells in two groups
3 讨 论
DLBCL 是高度异质性的恶性淋巴瘤,是NHL最常见的组织学亚型[9]。DLBCL 最常发生于60~70 岁老年人,在儿童中也可以看到[10]。对于晚期DLBCL 患者,使用环磷酰胺、阿霉素、长春新碱和泼尼松的化学疗法是最佳治疗选择,但有30%~40% 的患者会复发[11-13]。因此,为更好地了解DLBCL 的发生发展和改善DLBCL 患者的预后,确定新的分子靶标具有重要意义。
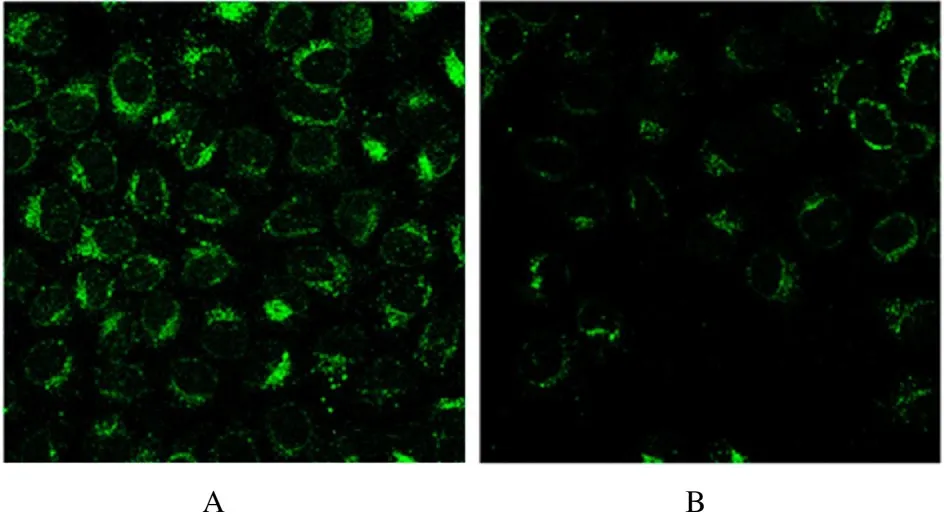
图4 2 组细胞LC3 免疫荧光染色结果(×400)Fig.4 Results of LC3 immunofluorescence staining in cells in two groups (×400)
SOCS3 是SOCS 家族的重要成员,是细胞因子和生长因子相关信号通路中的负调控蛋白,在JAK/STAT 信号通路中充当负调节剂,可防止肿瘤细胞发生恶性转化并促进肿瘤细胞凋亡[14]。因此,SOCS3 的激活和过表达在肿瘤生长中具有潜在作用[15]。SOCS3 作为肿瘤抑制基因,其异常表达在多种肿瘤的发生发展、转移和预后中发挥着重要的作用。CHU 等[16] 研究发现:SOCS3 在结直肠癌组织中表达下调,而过表达SOCS3 的可抑制结直肠癌细胞增殖、迁移、侵袭和致瘤能力,同时增加细胞凋亡率,且SOCS3 高表达的患者通常预后相对较好。但SOCS3 对DLBCL 作用的研究甚少且作用机制尚不明确。本研究结果显示:SOCS3 在DLBCL 患者外周血单个核细胞和OCI-LY7 细胞中低表达;通过在OCI-LY7 细胞中过表达SOCS3,OCI-LY7 细胞增殖能力降低,表明过表达SOCS3 可抑制OCI-LY7 细胞的增殖能力。自噬在肿瘤的发生发展和癌症化疗期间经常发生。自噬是一个连续的过程,其主要吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,借此实现细胞本身的代谢需要和某些细胞器的更新[17]。研究[18-19]表明:下调LC3Ⅱ/ LC3Ⅰ比值可抑制细胞自噬,进而抑制结肠癌、卵巢癌等肿瘤细胞的增殖和侵袭,进一步影响相关疾病的进展。本研究结果显示:过表达SOCS3 能明显下调OCI-LY7 细胞中LC3 Ⅱ/ LC3Ⅰ比值,同时降低OCI-LY7 细胞中LC3 阳性细胞率,表明过表达SOCS3 可抑制OCI-LY7 细胞的自噬能力。细胞凋亡与细胞坏死不同,细胞凋亡不是被动的过程,而是主动过程,涉及一系列基因的激活、 表达和调控等作用[20]。研究[21-22]表明: 抑制膀胱癌和乳腺癌细胞增殖,触发细胞周期停滞和细胞凋亡,可抑制肿瘤的发生发展。本研究结果显示: 过表达SOCS3 能诱导OCI-LY7 细胞凋亡,增加G0/G1期细胞百分率,减少S 期细胞百分率,因此过表达SOCS3 可促进OCI-LY7 细胞凋亡。
JAK/STAT 信号通路是一种在哺乳动物的各种组织和细胞中发挥重要作用的信号通路,参与调节细胞存活、增殖、迁移和侵袭等多种生物学过程[23]。SOCS3 是JAK/STAT 信号通路的关键负反馈调节剂[24]。LI 等[25]研究表明:在非小细胞肺癌组织中SOCS3 表达水平降低,上调SOCS3 表达水平可通过抑制JAK/STAT3 信号通路来降低人肺癌A549 细胞凋亡率,进而对肺癌进展有一定延缓作用。本研究结果显示: 过表达SOCS3 可抑制JAK2/STAT3 信号通路的激活,但其是否与凋亡和自噬相关尚有待进一步研究。
综上所述,SOCS3 在DLBCL 患者外周血单个核细胞和OCI-LY7 细胞中低表达。过表达SOCS3可以抑制OCI-LY7 细胞的增殖和自噬,并促进OCI-LY7 细胞凋亡,抑制JAK2/STAT3 信号通路的激活。因此,SOCS3 具有作为DLBCL 诊断生物标志物的潜在价值,也可能是DLBCL 治疗的潜在靶标。

