C3a-C3aR 轴通过巨噬细胞向M1 型极化对慢性牙周炎模型小鼠炎症反应和组织损伤的影响
任飞龙, 罗环宇, 郑适泽, 范心怡, 任春霞, 孟 圆, 赵 红, 史 册, 孙宏晨
(1.吉林大学口腔医院病理科,吉林 长春 130021;2.吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
慢性牙周炎是以牙菌斑为始动因子的发生于牙周支持组织(包括牙龈、牙周膜、牙槽骨和牙骨质) 的慢性进行性破坏性疾病。牙周炎不仅危害口腔健康,而且可以增加许多系统性疾病的患病风险[1],如糖尿病[2]、关节炎[3]、不良妊娠[4]和阿尔兹海默病[5]。目前临床上常用的牙周炎治疗方法多数是针对清除牙周微生物设计的,如牙周药物治疗、牙周基础治疗和牙周手术治疗等。但是由于药物滥用和耐药、手术适应证少及治疗周期长导致患者不能坚持维护,造成牙周炎治疗效果并不理想。因此积极探索牙周炎发生发展的详细机制,寻找关键的治疗靶点可能会给牙周炎的治疗提供新思路和新方法。研究[6]表明:造成牙周组织破坏的主要原因不是牙周致病菌的直接作用,而是宿主为防御牙周致病菌的入侵而产生的过度的免疫反应引起的。补体系统作为免疫系统的重要组成部分,在牙周炎的发生发展过程中具有重要作用。研究[7]显示:补体C3a 在牙周炎患者的牙周组织和龈沟液中表达升高,且与牙周炎的严重程度有关联,但其参与牙周炎发生发展的具体机制尚不清楚。此外,牙周炎发生过程中巨噬细胞浸润增加,其中以M1 型巨噬细胞为主[8]。M1 型巨噬细胞作为巨噬细胞的一种亚型,通过表达多种受体(补体受体及模式识别受体等) 和分泌多种炎症因子[肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β) 和干扰素(interferon,IFN) 等] 发挥吞噬和杀伤细菌及介导免疫炎症过程的作用。巨噬细胞高表达C3a 受体(C3a receptor,C3aR),因此推测C3a-C3aR 轴通过介导M1 型巨噬细胞极化促进牙周炎小鼠牙槽骨丧失。本研究以C3ar基因敲除的丝线结扎诱导的牙周炎小鼠为研究对象[9-10],采用显微计算机断层扫描(micro computerized tomography,Micro-CT) 评价小鼠牙槽骨的吸收,采用HE 染色观察小鼠牙周组织的改变,采用免疫组织化学染色检测M1 型巨噬细胞相关因子诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS) 和M2 型巨噬细胞相关因子精氨酸酶1 (arginase 1,Arg1) 在牙周组织中的表达,探讨C3a-C3aR 轴在慢性牙周炎中的作用及其机制,为牙周炎的防治提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器基因修饰的无特殊致病菌(specific pathogen free,SPF) 级8 周龄C57BL/6 雌性小鼠18 只,体质量18~22 g,由江苏集萃药康生物科技有限公司提供,动物生产许可证号:SCXK (苏) 2018-0008,饲养于吉林大学基础医学院动物实验中心,动物实验研究经吉林大学医学伦理委员会批准。重组人补体C3a (美国R&D System 公司),iNOS 和Arg1 抗体(中国圣克鲁斯生物技术有限公司),逆转录试剂盒和TRIzol (中国翊圣生物科技有限公司),iNOS、TNF-α、IL-1β 和β-actin 引物[生工生物工程(上海) 股份有限公司],UltrasensitiveTMSP (兔和鼠)免疫组织化学试剂盒(福州迈新生物技术公司),DAB (北京中杉金桥生物技术公司)。实时荧光定量PCR (Real-time fluorescence quantitative PCR,RT-qPCR) 仪和高速低温冷冻离心机(美国Thermo 公司),荧光显微镜(日本Olympus 公司),厌氧培养箱(日本SANYO 公司),涡旋混合器(江苏海门市其林贝尔仪器制造厂),Micro-CT 系统(瑞士ScancoMedicalAG 公司)。
1.2 实验动物分组和建模18 只小鼠以基因型不同分为C3ar+/+组、C3ar+/-组和C3ar-/-组,每组6 只。建立慢性牙周炎模型: 5% 水合氯醛(1 mL/100 g 体质量) 麻醉小鼠,在体视显微镜下,采用4-0 的聚酰胺尼龙线结扎小鼠上颌左侧第二磨牙,并于颊侧打结,以上颌右侧第二磨牙为自身对照,术后11 d 处死小鼠。
1.3 小鼠牙槽骨吸收情况评价处死小鼠后,分
离上颌骨,4% 多聚甲醛固定24 h 后,micro-CT 扫描并进行三维重建,Image J 软件分别测量上颌左侧第二磨牙颊、 腭侧近远中位点釉牙骨质界(cementum enamel junction,CEJ) 至牙槽嵴顶(alveolar bone crest,ABC) 距离,单位为mm,取4 个位点的平均值,判断牙槽骨吸收程度。
1.4 HE 染色观察小鼠牙周组织病理形态表现固定的单侧上颌组织经15% EDTA 溶液脱钙,梯度乙醇脱水,石蜡包埋,制成3 μm 切片。行常规HE 染色,封片后显微镜下观察牙周组织结合上皮完整性、炎症细胞浸润、附着丧失水平和牙槽骨吸收情况。
1.5 免疫组织化学染色检测小鼠牙周组织中iNOS和Arg1 蛋白表达水平牙周组织标本常规脱蜡至水,透明质酸酶抗原修复,3% H2O2阻断内源性过氧化物酶,血清封闭; iNOS 抗体(稀释比例为1∶200) 和Arg1 抗体(稀释比例为1∶200) 37 ℃水浴锅孵育2 h,根据免疫组织化学试剂盒说明书滴加生物素标记的二抗、辣根过氧化物酶标记的链霉素生物素工作液;DAB 显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。免疫组织化学染色结果半定量方法:采用Image Pro Plus 5.1 图像分析软件,经校准后检测牙周组织棕色部分的累计光密度(integrated optical density,IOD)值,再除以所测的面积,即代表蛋白表达水平,重复3 次取平均值。
1.6 倒置显微镜观察各组细胞形态表现体外培养RAW264.7 巨噬细胞系,以5×104cm-2密度将细胞接种至6 孔细胞培养板,培养至细胞贴壁后分为空白组、LPS 组、C3a 组和LPS+C3a 组,分别以100 μ g·L-1LPS 和200 μg·L-1C3a 处理细胞24 h 后,倒置显微镜(×400) 观察各组细胞形态表现。
1.7 RT-qPCR 法检测各组细胞中M1 型巨噬细胞相关因子mRNA 表达水平细胞分组同“1.6”。采用TRIzol 试剂常规提取培养后各组细胞的总RNA,按逆转录试剂盒说明书将总RNA 逆转录为cDNA 进行扩增,RT-qPCR 反应的总体系为20 μL。引物均由生工生物工程(上海) 股份有限公司合成。反应条件: 预变性95 ℃、 30 s;95 ℃、 5 s,60 ℃、 30 s,共40 个循环;溶解曲线95 ℃、15 s,60 ℃、 1 min,95 ℃、 15 s。以β-actin为内参照,采用2-△△Ct法计算各组巨噬细胞中TNF-α、IL-1β 和iNOS mRNA 表达水平。
1.8 统计学分析采用GraphPad Prism 8.0 统计软件进行统计学分析。各组小鼠牙槽骨ABC 至CEJ 距离,牙周组织中Arg1 和iNOS 蛋白表达水平,各组细胞中TNF-α、 IL-1β 和iNOS mRNA 表达水平均符合正态分布且方差齐,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠牙槽骨吸收情况Micro-CT 检查结果显示:与自身对照侧比较,C3ar+/+和C3ar+/-组小鼠结扎侧牙槽骨明显吸收,C3ar-/-组小鼠结扎侧牙槽骨吸收明显减轻。C3ar+/+组、C3ar+/-组和C3ar-/-组小鼠结扎侧CEJ 到ABC 距离分别为(0.883 5±0.272 5)、(0.900 8±0.103 2) 和(0.490 2±0.321 2) mm; 与C3ar+/-组 比 较,C3ar+/+组小鼠结扎侧CEJ 至ABC 距离差异无统计学意义(P>0.05); 与C3ar+/+组和C3ar+/-组比较,C3ar-/-组小鼠结扎侧CEJ 到ABC 距离明显缩短(P<0.01)。见图1。
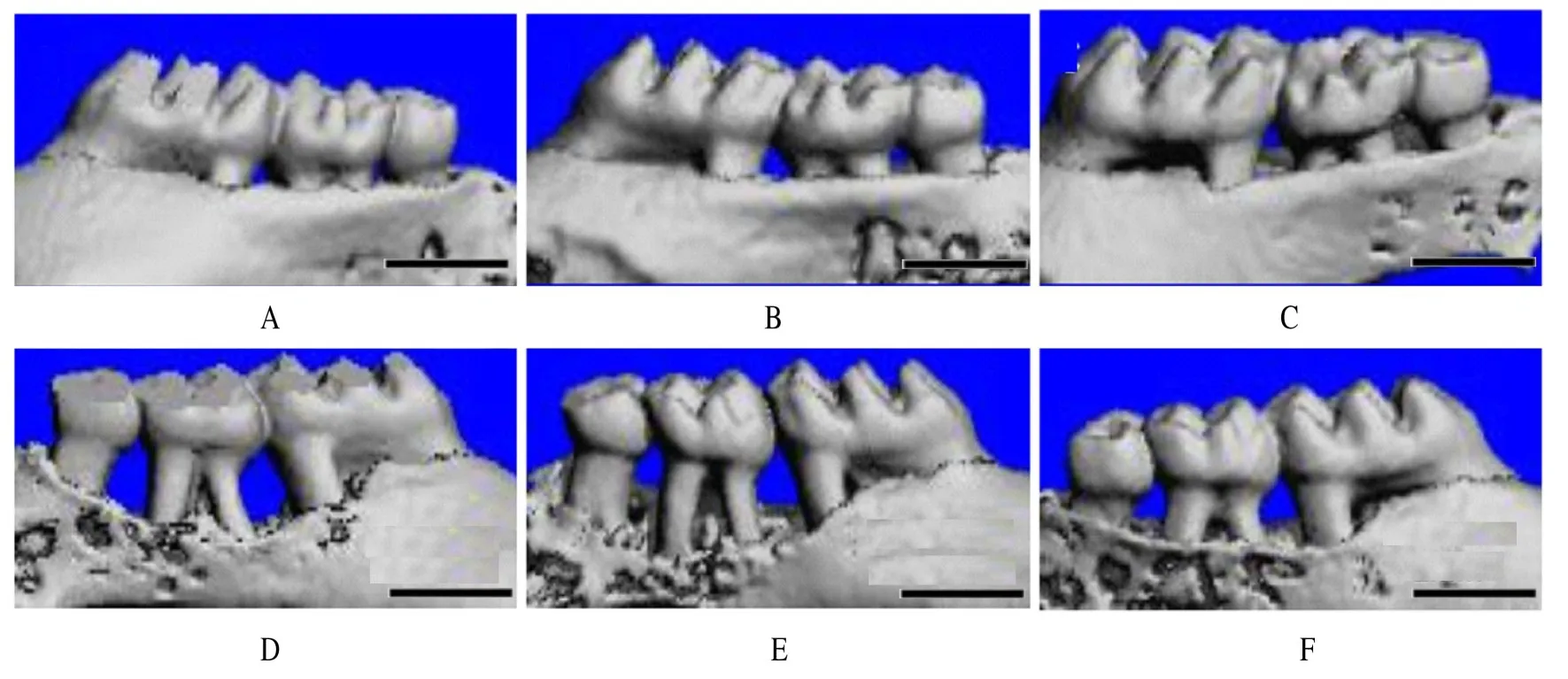
图1 Micro-CT 三维重建观察3 组小鼠牙槽骨吸收情况(Bar=1 mm)Fig.1 Resorption of alveolar bone of mice in various groups observed with three dimensional reconstruction of Micro-CT images (Bar=1 mm)
2.2 各组小鼠牙周组织病理形态表现HE 染色结果显示:C3ar+/+组和C3ar+/-组小鼠牙周结合上皮完整性被破坏,附着远离釉牙骨质界,结缔组织内有大量的炎性细胞浸润,牙槽骨吸收明显; 与C3ar+/+组和C3ar+/-组比较,C3ar-/-组小鼠结合上皮完整性破坏,附着靠近釉牙骨质界,上皮下结缔组织中炎性细胞浸润中等,牙槽骨吸收较少。见图2。

图2 各组小鼠牙周组织病理形态表现(HE,×100)Fig.2 Pathomorphology of periodontal tissue of mice in various groups (HE ,×100)
2.3 各组小鼠牙周组织中iNOS 和Arg1 蛋白表达水平iNOS 和Arg1 主要表达于小鼠牙周上皮下结缔组织巨噬细胞的细胞质中,染色强度中等。与C3ar+/-组比较,C3ar+/+组牙周组织中Arg1 和iNOS 的表达水平差异均无统计学意义(P>0.05); 分 别 与C3ar+/+组 和C3ar+/-组 比 较,C3ar-/-组小鼠牙周组织中iNOS 蛋白表达水平明显降低(P<0.01),Arg1 蛋白表达水平明显升高(P<0.01)。见图3 和4。
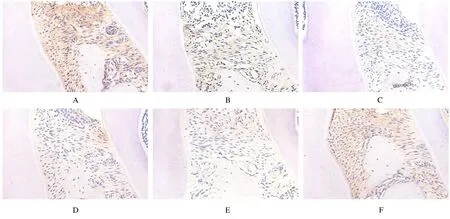
图3 各组小鼠牙周组织中iNOS(A—C)和Arg1(D—F)蛋白表达情况(IHC,×400)Fig.3 Expressions of iNOS and Arg1 proteins in periodontal tissue of mice in various groups (IHC,×400)

图4 各组小鼠牙周组织中iNOS(A)和Arg1(B)蛋白表达水平Fig.4 Expression levels of iNOS(A)and Arg1(B)proteins in periodontal tissue of mice in various groups
2.4 各组细胞形态表现 倒置显微镜下观察:空白组细胞多为圆形且呈分散状生长;LPS 组细胞形态多变,圆形细胞明显减少,约90% 以上细胞伸出伪足呈树枝状、放射状或长梭形,与M1 型巨噬细胞形态类似;与LPS 组比较,C3a 组细胞中圆形细胞有所减少,约50% 细胞变为梭形或放射状,说明部分细胞可能发生极化;与LPS 和C3a 组比较,LPS+C3a 组细胞几乎无圆形,且聚集呈团生长,大部分细胞可能发生M1 极化。见图5。

图5 各组细胞形态表现(×100)Fig.5 Morphology of cells in various groups (×100)
2.5 各组细胞中M1 型巨噬细胞相关因子mRNA表达水平与空白组比较,LPS 组、 C3a 组和LPS+C3a 组细胞中iNOS 和TNF-α mRNA 表达水平明显升高(P<0.05),LPS 组和LPS+C3a 组细胞中IL-1β mRNA 表达水平明显升高(P<0.05),C3a 组细胞中IL-1β mRNA 表达水平差异无统计学意义(P>0.05); 与LPS 组比较,C3a 组细胞中iNOS 、IL-1β 和TNF-α mRNA 表达水平明显降低(P<0.05),LPS+C3a 组细胞中iNOS 、IL-1β 和TNF-α mRNA 表达水平明显升高(P<0.05);与C3a 组比较,LPS+C3a 组细胞中iNOS 、IL-1β 和TNF- α mRNA 表达水平明显升高(P<0.05)。见表1。
表1 各组细胞中iNOS 、IL-1β 和TNF-α mRNA 表达水平Tab.1 Expression levels of iNOS, IL-1β and TNF-α mRNA in cells in various groups (n=3,±s)
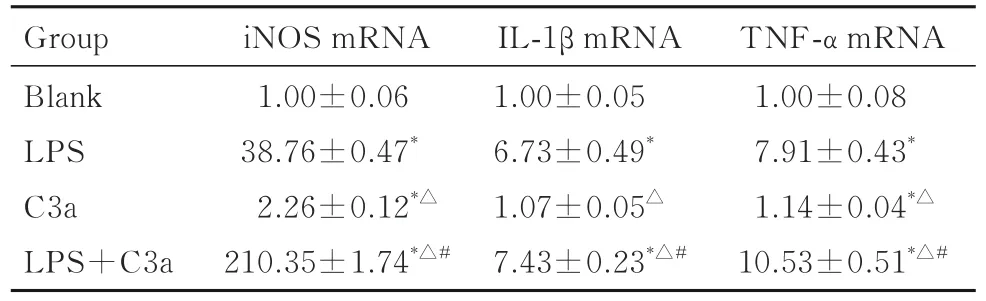
表1 各组细胞中iNOS 、IL-1β 和TNF-α mRNA 表达水平Tab.1 Expression levels of iNOS, IL-1β and TNF-α mRNA in cells in various groups (n=3,±s)
*P<0.05 vs control group;△P<0.05 vs LPS group;#P<0.05 vs C3a group.
Group Blank LPS C3a LPS+C3a iNOS mRNA 1.00±0.06 38.76±0.47*2.26±0.12*△210.35±1.74*△#IL-1β mRNA 1.00±0.05 6.73±0.49*1.07±0.05△7.43±0.23*△#TNF-α mRNA 1.00±0.08 7.91±0.43*1.14±0.04*△10.53±0.51*△#
3 讨 论
鉴于牙周炎所造成的软组织损伤和牙槽骨丧失主要是由过度的免疫炎症反应引起的,因此从免疫角度探索牙周炎发生的相关机制可能为有效治疗牙周炎带来希望[11]。研究[12-14]表明:在牙周组织中许多细胞可以表达C3a 和C3aR,如各种免疫细胞(包括单核细胞、中性粒细胞、巨噬细胞、T 细胞、B 细胞和肥大细胞等)、成骨细胞和破骨细胞及其前体细胞等,其中免疫细胞中的巨噬细胞是主要表达C3a 和C3aR 的细胞类型。由于巨噬细胞极化在牙周炎的发生发展过程中发挥重要作用[15],因此本研究探讨了C3a-C3aR 轴是否能通过影响巨噬细胞的功能在小鼠牙周炎发生发展过程中发挥生物学作用。
研究[16-18]表明:C3a 与C3aR 结合后会介导一系列的生物学效应,通过增加细胞外蛋白调节激酶1/2 (extracellular regulated protein kinases 1/2,ERK1/2) 的磷酸化调控ATP 外流和促进NOD 样受体蛋白3 (NOD-like receptor protein 3,NLRP3) 凋亡小体的活化,进而介导人单核细胞、巨噬细胞和树突状细胞分泌炎症因子IL-Iβ;通过调控Ca2+的释放促进肥大细胞脱颗粒和分泌趋化因子进而在超敏反应中发挥作用,通过趋化巨噬细胞浸润至肌肉损伤部位促进骨骼肌损伤后修复。此外,C3a-C3aR 轴能够通过ERK1/2、 核因子κB(nuclear factor-κB,NF-κB) 和信号传导及转录激活蛋白1 (signal transducer and activator of transcription,STAT1) 等信号通路促进M1 型巨噬细胞极化,在小鼠单侧输尿管阻塞中加快肾脏的纤维化[19]。与以上结果相类似,本研究结果显示:C3a-C3aR 轴能够增加牙周炎症组织中M1 型巨噬细胞的数量及M1 型巨噬细胞标志物的表达,进一步证明了C3a-C3aR 轴在调控巨噬细胞极化方面的作用,并且可能通过调控巨噬细胞的极化状态介导牙周炎症和软组织破坏。
由于牙周炎的主要特征是牙槽骨丧失,而破骨细胞是牙周组织中唯一能够导致牙槽骨破坏的细胞。体外研究[20]表明:C3a 可以与破骨细胞前体细胞表面的C3aR 结合直接促进破骨细胞的分化,该生物学效应可能参与了慢性牙周炎牙槽骨破坏,而本研究结果提供了另外一种可能,即C3a-C3aR轴可能通过调控M1 型巨噬细胞极化进而导致牙槽骨丢失,一方面是因为M1 型巨噬细胞能够分泌多种炎症因子,如白细胞介素6 (interleukin-6 ,IL-6)、 白细胞介素1 (interleukin-1,IL-1)、TNF-α和前列腺素E2 (prostaglandin E2,PGE2) 等,可以作为破骨细胞分化和激活的刺激因子,在骨吸收中发挥作用[21-22];另一方面是因为M1 型巨噬细胞可以刺激Th17 的分化,而Th17 细胞能够大量表达核因子κB 受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL),进而增加破骨细胞的形成导致牙槽骨破坏[23]。研究[24]显示:诱导M2 型巨噬细胞极化能够明显减轻牙周炎模型小鼠的牙槽骨丧失。本研究结果显示:C3ar敲除后,代表M1/M2 型巨噬细胞的蛋白表达水平比例降低,同时小鼠牙周炎的牙槽骨丧失减少,进一步证明了C3a-C3aR 轴可能通过调控巨噬细胞极化介导破骨活动导致牙槽骨破坏。
综上所述,本研究通过分析C3ar敲除的牙周炎小鼠影像学和组织学表现,证明C3a 可能通过促进巨噬细胞向M1 型极化介导牙周组织炎症和牙槽骨丧失。证实了作为宿主抗牙周致病菌的前沿,补体系统和M1 型巨噬细胞介导的过度免疫炎症反应会加速牙周炎的发生发展,提示以补体C3a 作为靶点治疗牙周炎的潜在可能性。但是在牙周炎微环境中,补体系统和巨噬细胞的活化及功能受多种因子的调节,如何更好地调控二者的免疫反应强度进而有效发挥各自的免疫防御作用,仍需进一步探索。

