人参组培不定根蛋白对小鼠的抗疲劳作用及其机制
王曼莹, 付宝玉, 徐晓浩, 李香竹, 陈 红, 孙立伟, 赵大庆
(1.长春中医药大学 吉林省人参科学研究院,吉林 长春 130117;2.长春中医药大学附属医院中医药研究中心,吉林 长春 130021;3.吉林省通化本草生物科技有限公司,吉林 通化 134000)
随着生活及工作节奏的加快和工作压力的增加,亚健康状态人群数量逐年上升。疲劳是亚健康状态最主要和最典型的表现,所占比例约为78.7%,严重影响人们的生活质量,成为近年来备受关注的问题之一[1]。当机体长时间处于疲劳状态时,体内就会发生一系列生理生化变化,加重疲劳状态,导致机能下降甚至引发各种疾病。因此开发具有抗疲劳功能的保健食品对于人们生活和工作质量的提高有重要意义。人参作为 “百草之王”,具有 “大补元气” 等功效。但近年来,长白山作为野山参的唯一产区,连年采挖使其储量和产量均明显减少,且由于野山参较长的成熟年限限制了其应用[2]。人参组培不定根是野山参经过组织培养得到的,在遗传信息方面与野山参具有高度相似性,而且其生长速度快、周期短且易培养,人参组培不定根易于提取出与野山参相似的活性成分。许多人参提取物如皂苷、多糖[3]和蛋白[4]等均被报道具有抗疲劳作用。但是现阶段关于人参组培不定根的研究报道多集中在体系建立[5]、工艺优化[6]和品质评价[7]等方面,关于人参组培不定根的活性研究仅发现其能保护四氯化碳(carbon tetrachloride,CCl4) 诱导的大鼠肝损伤[8]和缓解糖尿病大鼠的高血糖[9]。人参组培不定根蛋白(ginseng adventitious root protein,GARP) 作为人参组培不定根的重要组分,其抗疲劳作用的研究对于其开发应用十分必要。本实验以野山参为原料,经组织培养等方法得到人参组培不定根,提取GARP 后喂养疲劳模型小鼠,探讨GARP 的抗疲劳作用,并通过小鼠成肌细胞(C2C12 细胞) 探讨其相关作用通路,为GARP 的进一步开发应用提供实验数据。
1 材料与方法
1.1 细胞、实验动物、药物、主要试剂和仪器小鼠成肌C2C12 细胞购自美国ATCC 细胞库。40 只昆明种清洁级小鼠,体质量18~22 g,购自吉林大学基础医学院实验动物中心,动物使用许可证号:SYXK (吉)-2018-0001。人参组培不定根由通化本草生物科技有限公司提供。葡萄糖(分析纯) 购自天津市滨海科迪化学试剂有限公司,血乳酸(blood lactic acid,BLA)、 血尿素氮(blood urea nitrogen,BUN)、 糖原、 谷胱甘肽(glutathione,GSH) 和总超氧化物歧化酶(superoxide dismutase,SOD) 检测试剂盒均购自南京建成生物工程研究所,腺苷酸激活蛋白激酶(AMPactivated protein kinase,AMPK)、 磷酸化AMPK(phosphorylated AMPK,p-AMPK)、 葡萄糖转运蛋白4 (glucose transporter 4,GLUT4 ) 和β -Tubulin 抗体购自美国Cell Signaling Technology公司,羊抗兔和羊抗鼠抗体购自武汉博士德生物制品公司。Infinite M200 PRO 多功能酶标仪购于瑞士TECAN 公司,UV765 紫外可见分光光度计购于上海精密科学仪器有限公司,FluorChem HD2 化学发光凝胶成像系统购于美国ProteinSimple 公司。
1.2 GARP 的制备新鲜人参组培不定根用蒸馏水清洗,在10 倍体积的0.01 mol·L-1PBS 缓冲液(pH7.2) 中匀浆1 min,然后用300 目滤布进行固液分离,8 500 r·min-1离心10 min,将溶液在相对分子质量为10 000 的超滤膜上进行超滤,然后通过0.22 μm 微孔滤膜过滤除菌待用。
1.3 实验动物分组及给药昆明种清洁级小鼠40 只,随机分为对照组,低、中和高剂量(0.25、0.50 和1.00 g·kg-1) GARP 组,每组10 只;笼内环境温度为(25±5) ℃,相对湿度为55%,小鼠喂养普通饲料,自由进食和饮水适应1 周后进行正式实验,GARP 组小鼠灌胃给予相应剂量GARP,对照组小鼠给予等量蒸馏水,每天1 次,连续给药30 d。
1.4 负重游泳实验末次灌胃给药30 min 后,各组小鼠于尾部负5% 体质量的铅块,置于游泳箱中进行负重游泳实验,水深35 cm,水温(25±2) ℃,记录小鼠自游泳开始到沉入水面下10 s 不能浮出水面为止的时间,即小鼠游泳时间[10]。
1.5 分光光度法检测各组小鼠血清中BLA 和BUN 水平各组小鼠末次灌胃给药30 min 后摘眼球取血,静置1 h 后3 000 r·min-1离心10 min 分离血清。参照测试盒说明书中的方法,结合紫外可见光分光光度计在波长520 和530 nm 处检测吸光度(A) 值,根据公式计算血清中BLA 和BUN 水平,BUN/BLA (mmol·L-1)=(测定A 值- 空白A 值) /(标准A 值-空白A 值) ×标准品浓度×稀释倍数[11]。
1.6 分光光度法检测小鼠肝组织中GSH 水平和SOD 活性小鼠末次灌胃给药30 min 后脱颈处死,立即取出肝脏用冷藏的生理盐水漂洗除去血液,用试纸擦干后制成10% 的肝组织匀浆,按照试剂盒说明书中的方法在波长405 和450 nm 处测定A 值。根据公式计算GSH 水平和SOD 活性。GSH 水平(mg·g-1)=(测定A 值-空白A 值) /(标准A值-空白A 值) ×标准品浓度×GSH 相对分子质量×稀释倍数/蛋白浓度;SOD 活性(U·mg-1)=(对照A 值- 测定A 值) /对照A 值/50%× 反应液体积/取样量/蛋白浓度[12]。
1.7 分光光度法检测各组小鼠肝糖原和肌糖原水平小鼠末次灌胃给药30 min 后处死,解剖取出小鼠肝脏和肌肉组织,采用生理盐水洗去血液并用滤纸吸干水分,按照糖原测试盒说明书制备组织匀浆,用紫外可见分光光度计于波长620 nm 处测定A 值并根据说明书公式计算出肝糖原和肌糖原水平[13]。糖原水平(mg·g-1组织)=(测定A 值/标准A 值) ×标准管含量×样本稀释倍数×10/1.11。
1.8 C2C12 细胞的培养及诱导分化C2C12 细胞采用含10% FBS 的DMEM 高糖培养液培养,细胞融合度达到70%~80% 时,将原培养瓶中含有10% FBS 的DMEM 培养基吸走,用PBS 缓冲液漂洗细胞2 次(每次2 mL),用含2% 马血清的DMEM 高糖培养液对C2C12 细胞诱导5 d 后分化为肌管细胞进行实验[14]。
1.9 分光光度法检测各组细胞中GSH 水平、SOD活性和糖原水平C2C12 成肌细胞分化为肌管细胞后加入不同剂量(5、 10 和20 mg·L-1) GARP 处理,同时设对照组,24 h后胰酶消化,1 000 r·min-1离心5 min,取细胞沉淀采用RIPA 裂解,离心取上清;按照GSH 和SOD 检测试剂盒说明书中方法在波长405 和450 nm 处测定A 值[15],根据 “1.6”中的公式计算GSH 水平和SOD 活性;按照糖原检测试剂盒说明书操作,用紫外可见分光光度计于波长620 nm 处测定A 值[16],根据 “1.7” 中的公式计算细胞中糖原水平。
1.10 苯酚硫酸法检测各组细胞葡萄糖摄取能力细胞葡萄糖摄取是指其吸收培养液中葡萄糖的能力,使用葡萄糖标准品配制葡萄糖标准溶液,并绘制标准曲线;细胞接种于96 孔细胞培养板,加入不同剂量GARP 处理24 h 后收集培养液,1 000 r·min-1离心5 min 后取上清备用,将试管置于40 ℃水浴锅中15 min,迅速冷却至室温后于波长490 nm 处测定A 值,根据标准曲线所得公式计算出样品培养液的葡萄糖浓度,然后通过公式计算细胞葡萄糖摄取能力[17]葡萄糖摄取能力=培养液葡萄糖浓度-样品葡萄糖浓度。
1.11 Western blotting 法检测各组细胞中p-AMPK、AMPK 和GLUT4 蛋白表达水平收集各组细胞,PBS 缓冲液漂洗、 胰酶消化后4 ℃裂解1 h,Bradford 法测定各组细胞蛋白浓度,SDS-PAGE 法分离得到蛋白条带,转膜后封闭1 h,孵育一抗p-AMPK (1∶1 000 稀释)、AMPK(1∶1 000 稀释)、 GLUT4 (1∶1 000 稀释) 和β -tubulin (1∶5 000 稀释) 置于4 ℃摇床过夜,TBST 漂洗PVDF 膜后室温孵育相应二抗,1 h 后漂洗PVDF 膜,加入ECL 发光液后放入化学发光仪检测发光强度。目标蛋白表达水平=目标蛋白条带灰度值/β-tubulin 条带灰度值[18]。计算p-AMPK/AMPK 比值,以p-AMPK/AMPK 比值代表AMPK的磷酸化水平。
1.12 统计学分析采用GraphPad Prism 7.0 统计软件进行统计学分析。各组小鼠游泳时间、血清中BLA 和BUN 水平、肝组织中GSH 水平、SOD 活性和糖原水平,C2C12 细胞中GSH 水平、SOD 活性、 糖原水平、 细胞糖摄取能力、 p-AMPK/AMPK 比值和GLUT4 蛋白表达水平均以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组小鼠游泳时间与对照组比较,低剂量GARP 组小鼠游泳时间差异无统计学意义(P>0.05),中和高剂量GARP 组小鼠游泳时间明显延长(P<0.05 或P<0.01)。见表1。
表1 各组小鼠游泳时间Tab.1 Swimming time of mice in various groups(n=10,±s,t/min)
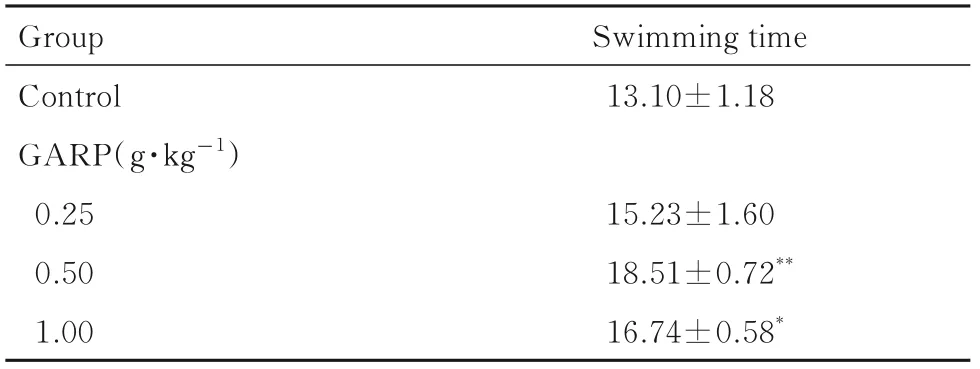
表1 各组小鼠游泳时间Tab.1 Swimming time of mice in various groups(n=10,±s,t/min)
*P<0.05,**P<0.01 compared with control group.
Group Control GARP(g·kg-1)0.25 0.50 1.00 Swimming time 13.10±1.18 15.23±1.60 18.51±0.72**16.74±0.58*
2.2 各组小鼠血清中BLA 和BUN 水平与对照组比较,低剂量GARP 组小鼠血清中BLA 和BUN水平差异无统计学意义(P>0.05),中和高剂量GARP 组小鼠血清中BLA 和BUN 水平明显降低(P<0.05 或P<0.01)。见表2。
表2 各组小鼠血清中BLA 和BUN 水平Tab.2 Levels of BLA and BUN in serum of mice in variousgroups [n=10,±s,cB/(mmol·L-1)]

表2 各组小鼠血清中BLA 和BUN 水平Tab.2 Levels of BLA and BUN in serum of mice in variousgroups [n=10,±s,cB/(mmol·L-1)]
*P<0.05,**P<0.01 compared with control group.
Group Control GARP(g·kg-1)0.25 0.50 1.00 BLA 9.01±0.15 8.19±0.29 7.04±0.38**7.28±0.38*BUN 56.29±1.69 53.86±1.29 41.88±1.36**43.99±1.22**
2.3 各组小鼠肝组织中GSH 水平和SOD 活性与对照组比较,不同剂量GARP 组小鼠肝组织中GSH 水平和SOD 活性明显升高(P<0.05 或P<0.01)。见表3。
表3 各组小鼠肝组织中GSH 水平和SOD 活性Tab.3 GSH levels and SOD activities in liver tissue of mice in various groups (n=10,±s)

表3 各组小鼠肝组织中GSH 水平和SOD 活性Tab.3 GSH levels and SOD activities in liver tissue of mice in various groups (n=10,±s)
*P<0.05,**P<0.01 compared with control group.
Group Control GARP(g·kg-1)0.25 0.50 1.00 GSH[wB/(mg·g-1)]35.22±2.89 48.99±5.83*62.79±4.99**58.15±3.89**SOD[λB/(U·mg-1)]9.23±0.61 10.65±0.84*11.95±1.21*11.57±0.92*
2.4 各组小鼠肝糖原和肌糖原水平与对照组比较,不同剂量GARP 组小鼠肝糖原和肌糖原水平均明显升高(P<0.05 或P<0.01)。见表4。

表4 各组小鼠肝糖原和肌糖原水平Tab.4 Levels of liver glycogen and muscle glycogen of mice in various groups [n=10,x±s,wB/(mg·g-1)]
2.5 各组细胞中GSH 水平和SOD 活性与对照组比较,不同剂量GARP组细胞中GSH水平和SOD活性明显升高(P<0.05或P<0.01)。见图1。
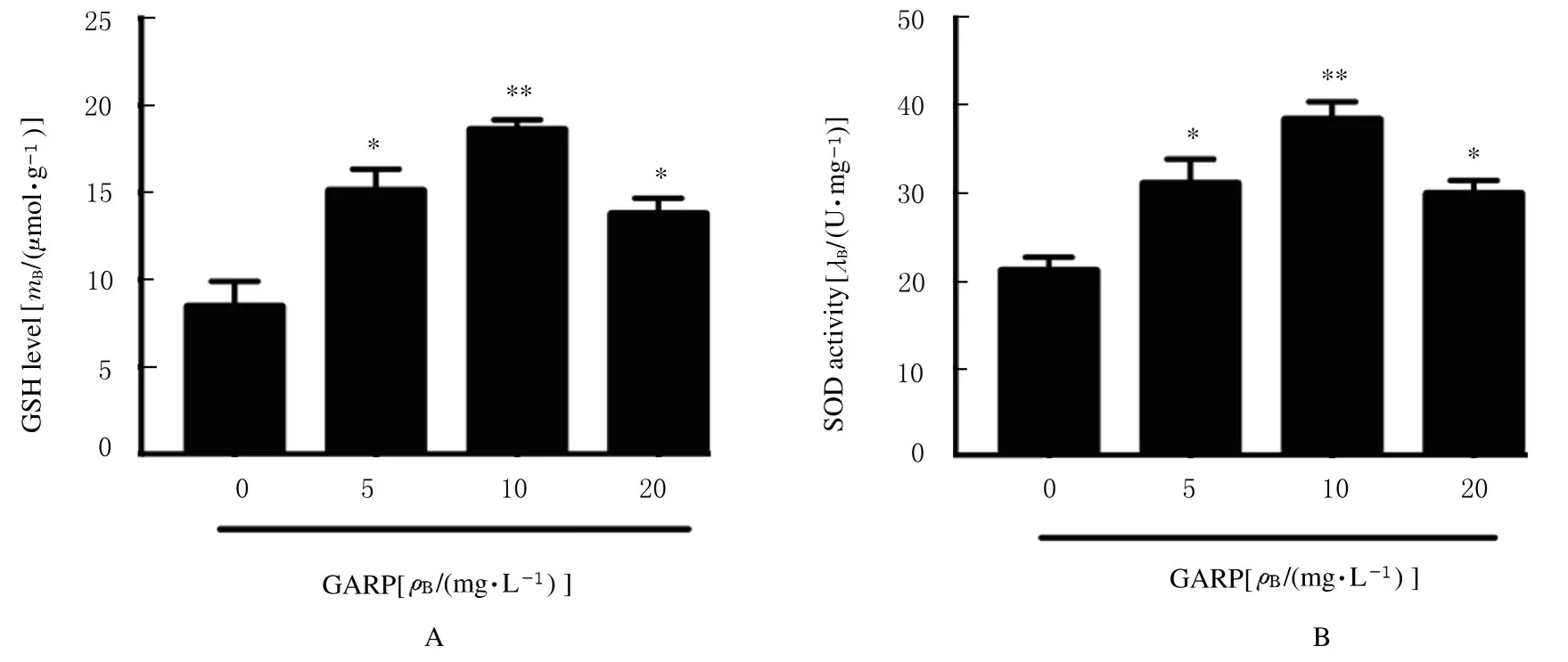
图1 各组细胞中GSH 水平(A)和SOD 活性(B)Fig.1 GSH levels (A) and SOD activities (B) in cells in various groups
2.6 各组细胞中糖原水平和葡萄糖摄取能力与对照组比较,不同剂量GARP 组细胞中糖原水平明显升高(P<0.05 或P<0.01),葡萄糖摄取能力明显增强(P<0.05 或P<0.01)。见图2。
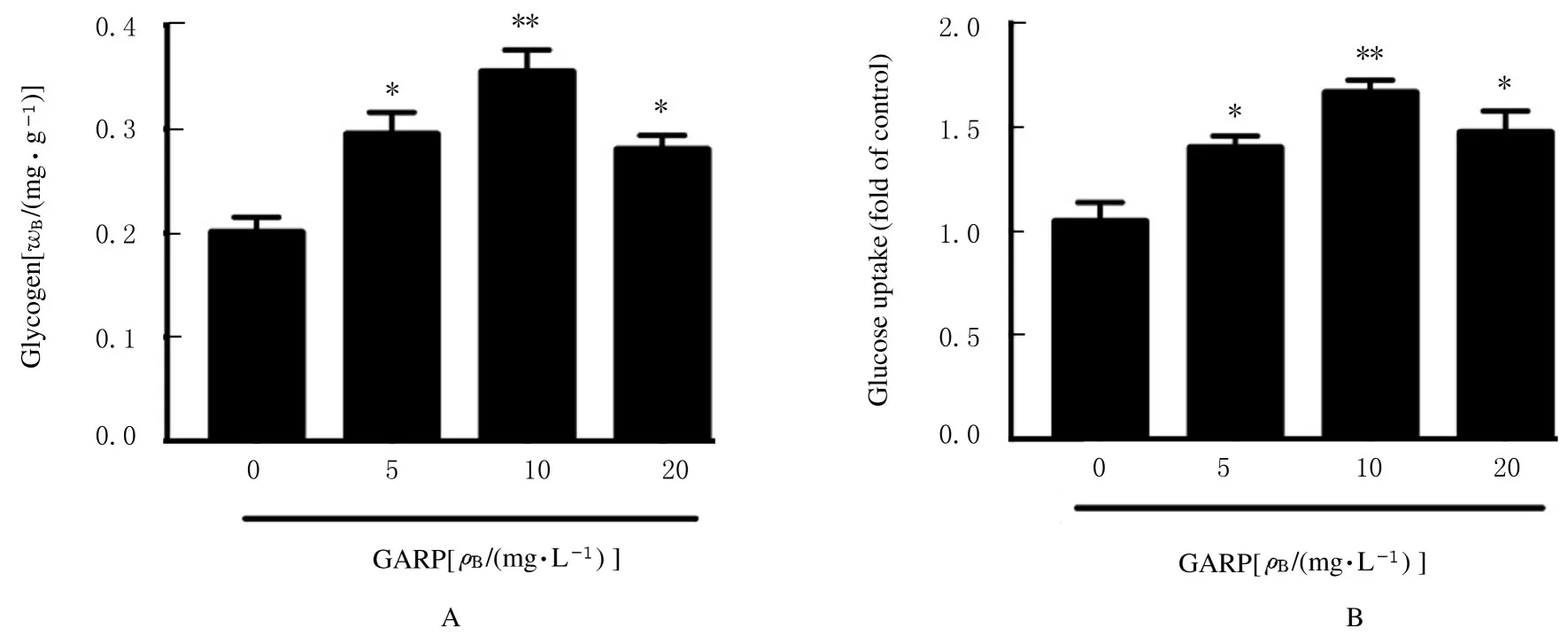
图2 各组细胞中糖原水平(A)和葡萄糖摄取能力(B)Fig.2 Glycogen levels (A) and glucose uptake (B) of cells in various groups
2.7 各组细胞中p-AMPK/AMPK 比值和GLUT4蛋白表达水平与对照组比较,不同剂量GARP组细胞中p-AMPK/AMPK 比值和GLUT4 蛋白表达水平明显升高(P<0.05 或P<0.01)。见图3。

图3 各组细胞中AMPK/GLUT4 通路蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregram(A)and histogram(B)of AMPK/GLUT4 pathway proteins in cells in various groups
3 讨 论
疲劳是指机体在一定条件下,因长时间过度劳累或紧张的劳动到达一定阶段而引起的工作效率暂时下降的一种生理和心理现象[19]。研究[20]显示:许多天然药物如人参、冬虫夏草和红景天等均具有抗疲劳作用。抗疲劳效果最直接的体现就是小鼠运动耐力的增加,力竭游泳运动是常用的动物模型,可以很好地评价小鼠的耐力水平[21]。本研究结果显示:GARP 能延长小鼠的游泳时间,提高小鼠的运动耐力。
机体剧烈运动时会消耗大量的能量和氧气,产生乳酸堆积于肌肉中,使体内正常代谢过程出现紊乱,影响内环境的稳定,成为诱发疲劳的重要原因[22]。运动时间过长会导致蛋白质的代谢参与到提供能量中,BUN 作为蛋白质代谢的终产物,反映了机体蛋白质代谢的情况,因此BUN 水平的变化可以作为评估机体承受负荷耐力的重要指标[23]。本研究中,与对照组比较,中和高剂量GARP 组小鼠血清中BLA 和BUN 水平明显降低,表明GARP 能使机体承受负荷的耐力有所增加。
氧化应激也是造成疲劳的重要因素。当剧烈运动时,自由基产生并积累,导致生物膜机能被破坏,线粒体受到自由基攻击,ATP 供给减少,肌肉工作能力减弱,从而产生疲劳[24]。GSH 是由谷氨酸、半胱氨酸和甘氨酸缩合而成的三肽,能消除人体自由基,是评价机体抗氧化水平的重要标志物[25];SOD 是生物体内存在的一种抗氧化金属酶,能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在机体氧化与抗氧化平衡中起到至关重要的作用[26];GSH 和SOD 作为机体重要抗氧化物和抗氧化酶,对自由基的清除有重要意义。本研究结果表明:GARP 能促进小鼠肝脏和C2C12 细胞中GSH的产生并提高SOD 活性,使机体清除自由基的能力增强,显示出较强的抗氧化功效来对抗疲劳的产生。
葡萄糖是机体的直接能源物质,可经氧化磷酸化产生ATP 为机体供能;糖原是机体的储备能源,可在血糖降低条件下分解成葡萄糖来维持细胞的能量供给[27];葡萄糖充足的条件下还能转换为糖原储存起来[28]。因此,葡萄糖摄取能力和糖原储备量是评价骨骼肌耐力的重要指标[29]。本研究结果显示:GARP 能使小鼠肝糖原和肌糖原水平明显提高,细胞实验也显示GARP 能提高C2C12 细胞的糖摄取能力并增加糖原水平。GLUT4 是细胞膜上的一种葡萄糖转运蛋白,与葡萄糖的摄取和转运能力呈正相关关系[30];AMPM 作为调控GLUT4 的重要蛋白,在糖代谢过程中起重要作用[31]。本研究结果显示:GARP 对AMPK 的磷酸化和GLUT4蛋白表达均有促进作用,能够通过激活AMPK/GLUT4 通路来调控糖代谢。
综上所述,采用组织培养等技术获得的GARP可以延长小鼠的游泳时间,降低小鼠血清中BLA和BUN 水平,提高小鼠抗氧化能力并促进糖原积累,具有抗疲劳作用,其机制可能是通过激活AMPK/GLUT4 通路、 促进糖摄取和转运并增强糖原储备实现的。由于GARP 与野山参的基因具有高度相似性且生长周期短,可广泛应用于抗疲劳药品及保健品的开发。

