miR-150-5p 在糖尿病肾病模型小鼠肾组织中的表达和对小鼠足细胞MPC5 损伤的影响及其机制
朱 妤, 王晶晶, 吴 芳
(1.浙江大学医学院附属儿童医院 国家儿童健康与疾病临床医学研究中心中医科,浙江 杭州 310003;2.浙江大学医学院附属儿童医院国家儿童健康与疾病临床医学研究中心肾脏内科,浙江 杭州 310003)
目前,糖尿病肾病(diabetic nephropathy,DN)已经成为导致严重终末期肾病的最常见原因之一[1]。DN 的主要肾脏临床特征包括肾小球功能障碍、肾小球硬化和肾小球滤过功能障碍等。其中,足细胞损伤在早期DN 的进展中起关键作用[2]。足细胞主要位于肾小球基底膜的外表面,是一种构成肾小球滤过屏障的高度分化的上皮细胞,增殖能力弱。已有研究[3]证实:足细胞损伤可导致DN 患者出现持续性蛋白尿和肾小球滤过率(glomerular filtration rate,GFR)下降。因此,干预导致足细胞损伤的关键靶点可能会延缓DN的进展。
微小RNA (microRNAs,miRNAs) 是一类短单链(含21~25 个核苷酸) 的非编码RNA,其可通过与靶mRNA 的3′- 非翻译区(3′-untranslated region,3′-UTR) 互补结合在转录后水平上负向调节靶基因的表达[4]。目前,已发现多种miRNAs 与包括DN 在内的多种肾脏疾病有关[5-6]。有研究[7]表明: miR-150-5p 可以抑制血管内皮生成因子(vascular endothelial growth factor,VEGF) 及其受体的表达,而敲除miR-150-5p 可导致炎症反应增强。动物实验[8]表明:眼内注射miR-150-5p 模拟物(mimic) 可明显降低病理性新生血管的生成。在肾脏疾病的小鼠中,敲除miR-150-5p 可加重肾损伤[9]。Targetscan软件(http://www.targetscan.org/vert_80/) 分析显示:miR-150-5p 与脑酸溶性蛋白1 (brain acid soluble protein 1,BASP1) 的3′-UTR 区存在潜在的结合序列。已有研究[10-11]表明:DN 患者的肾组织中BASP1 表达水平增加,且与肾小管上皮细胞凋亡有关。研究[12]显示:BASP1 在发育成熟的小鼠肾组织中主要表达于足细胞。miR-150-5p 可能在DN 肾损伤中起重要作用,但miR-150-5p 是否通过调节足细胞中BASP1 的表达影响DN 的发生发展尚不明确。本研究探讨miR-150-5p 和BASP1 对高糖(high glucose,HG) 环境诱导的足细胞损伤的影响以及二者的关系,为阐明DN 的进展及其机制提供新思路。
1 材料与方法
1.1 实验动物、细胞、主要试剂和仪器20 只7~8 周龄SPF 级雄性昆明小鼠(体质量20~25 g) 购自浙江维通利华实验动物技术有限公司实验动物中心,动物生产许可证号:SCXK (浙) 2019-0001。小鼠足细胞系MPC5 购自通派(上海) 生物科技有限公司。D-葡萄糖、链脲佐菌素(streptozotocin,STZ) 和干扰素-γ (interferon-γ,IFN-γ)(美国Sigma-Aldrich 公司),胎牛血清(美国HyClone 公司),RPMI-1640 培养基、1% 青霉素/链霉素双抗和Lipofectamine 2000 试剂(美国Invitrogen 公司),Bradford 蛋白分析试剂盒(美国Bio-Rad 公司),BASP1 抗体(美国Abcam 公司),突触足蛋白(synaptopodin) 抗体(美国Santa Cruz Biotechnology公司),GAPDH 和HRP-羊抗兔IgG 抗体(上海碧云天生物科技有限公司),Alexa Fluor 488 标记的羊抗小鼠IgG 和Alexa Fluor 594 标记的羊抗兔IgG抗体(美国Proteintech 公司),CCK-8 活细胞计数试剂盒和Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司),活性氧(reactive oxygen,ROS) 和乳酸脱氢酶(lactate dehydrogenase,LDH)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 试剂盒(上海心语生物科技有限公司),miRcute miRNA 提取分离试剂盒、SYBR Green SuperReal PreMix Plus 试剂盒和快速定点突变试剂盒(北京天根生化科技有限公司),一步法PrimeScript miRNA cNDA 合成试剂盒(日本TaKaRa 公司),miR-150-5p mimic、miRNA 阴性对照(miR-NC)、miR-150-5p 抑制物(miR-150-5p inhibitor)、BASP1 过表达质粒(pc-DNA3.1-BASP1)、 阴性对照质粒(pc-DNA3.1-SC) 和pmirGLO 双萤光素酶报告基因载体质粒(上海吉凯基因化学技术有限公司)。Synergy H4 Hybrid 酶标仪(美国Bio-Tek公司),微垂直电泳-电转系统(美国Bio-Rad 公司),7500实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 系统(美国Applied Biosystems 公司),BX53 显微镜(日本Olympus 公司),LSM 980 with Airyscan激光共聚焦显微镜(德国ZEISS公司),CytoFLEX 流式细胞仪(美国Beckman Coulter公司)。
1.2 小鼠DN 模型构建和分组小鼠饲养在条件可控的SPF 级动物房(温度22 ℃~25 ℃,湿度55%~70%,12 h 光照/黑暗交替循环),在给予特殊饮食前可自由饮水摄食。适应性饲养5 d 后,随机选取8 只小鼠作为对照组,其余12 只小鼠用于构建DN 模型。按照参考文献[13] 方法:DN 模型组小鼠采用高脂饮食喂养5 周后,连续3 d 腹腔注射STZ (50 mg·kg-1·d-1),采用血糖仪监测尾静脉血的空腹血糖水平,空腹血糖水平>300 mg·dL-1后再给予高脂饮食喂养12 周,出现多饮、 多食、多尿、体质量下降、空腹血糖>300 mg·dL-1和持续性蛋白尿时则表明DN 模型构建成功。本研究中DN 模型组小鼠全部造模成功。对照组小鼠采用标准颗粒饲料喂养,且不注射STZ。
1.3 免疫组织化学染色法观察各组小鼠肾组织中BASP1 蛋白表达情况各组小鼠麻醉后处死,并收集肾脏组织。肾脏组织经4% 多聚甲醛固定和石蜡包埋后制成4 μm 厚的切片。切片经二甲苯脱蜡和乙醇梯度水合后,3% H2O2室温孵育10 min 封闭内源性过氧化物酶,蒸馏水洗涤5 min×2 次,10%山羊血清37 ℃封闭30 min,室温孵育BASP1 抗体(1∶200) 30 min,PBS 缓冲液洗涤5 min×3 次。37 ℃孵育生物素化的二抗(1∶100) 40 min,PBS缓冲液洗涤5 min×3 次。37 ℃孵育SAB 复合物(1∶200) 40 min,PBS 缓冲液洗涤5 min×3 次。DAB 显色后,苏木素复染,常规脱水和透明后,显微镜下观察BASP1 蛋白表达情况。
1.4 免疫荧光染色法观察各组小鼠肾组织中BASP1 与足细胞共定位情况取各组小鼠肾组织的石蜡切片(厚度4 μm),脱蜡至水,封闭内源性过氧化物酶(步骤同“1.3”),室温分别孵育BASP1 抗体(1∶100) 和synaptopodin 抗体(足细胞标记物,1∶100) 30 min 后再4 ℃过夜,PBS 缓冲液洗涤5 min×3 次。分别室温避光孵育Alexa Fluor 488 标记的羊抗小鼠IgG 和Alexa Fluor 594 标记的羊抗兔IgG 抗体(1∶200) 45 min,PBS 缓冲液洗涤5 min×3 次。抗荧光淬灭剂封片后,激光共聚焦显微镜下观察BASP1 与足细胞共定位情况。
1.5 细胞培养和处理MPC5 细胞培养在含10%胎牛血清、1% 青霉素/链霉素和10 U·mL-1IFN-γ的RPMI-1640 培养基中,置于37 ℃、5% CO2的培养箱中培养备用。将MPC5 细胞接种在不含IFN-γ的RPMI-1640 完全培养基中于37 ℃培养2 周以诱导分化成熟,分为对照组(5.5 mmol·L-1D-葡萄糖)和不同时间HG组,不同时间HG 组采用30 mmol·L-1D-葡萄糖分别处理足细胞12、24、48 和72 h。
1.6 双荧光素酶报告基因实验验证miR-150-5p 与BASP1 的靶向关系通过Targetscan 预测miR-150-5p 与BASP1 的假定结合位点,并通过定点突变试剂盒将与miR-150-5p 预测的假定结合序列的BASP1-3′-UTR 进行点突变后,采用PCR 扩增。将BASP1 的野生型(WT) 3′-UTR 和BASP1 的突变体(MUT) 3′-UTR 克 隆 到 表 达 荧 光 素 酶 的pmirGLO 载体下游,分别构建BASP1-WT 或BASP1-MUT 荧光素酶载体。使用Lipofectamine 2000 将miR-150-5p mimic 或miR-NC 和BASP1-WT 或BASP1-MUT 荧光素酶载体质粒共转染入足细胞中。48 h后,通过双荧光素酶报告基因分析系统分析各组细胞相对荧光素酶活性。相对荧光素酶活性=萤火虫荧光素酶活性/海肾荧光素酶活性×100%。
1.7 细胞转染和分组将已诱导分化成熟的足细胞分为正常条件+miR-NC (Con+NC) 组、 HG条件+miR-NC (HG+NC) 组、 HG 条件+miR-150-5p mimic (HG+mimic) 组、 HG 条件+miR-150-5p mimic+pc-DNA3.1-SC (HG+mimic+SC)组和HG 条件+miR-150-5p mimic+pc-DNA3.1-BASP1 (HG+mimic+BASP1) 组。用Lipofectamine 2000 试剂分别将miR-NC、 miR-150-5p mimic、 pc-DNA3.1-SC 和 pc-DNA3.1-BASP1 转染相应各组足细胞,转染48 h 后,采用HG (30 mmol·L-1D-葡萄糖) 继续培养48 h。
1.8 RT-qPCR 法检测各组小鼠肾组织和各组细胞中miR-150-5p 表达水平采用miRcute miRNA 提取分离试剂盒提取各组小鼠肾组织和各组细胞中miRNA 富集的小RNA,然后通过一步法PrimeScript miRNA cNDA 合成试剂盒将RNA 逆转录为cDNA。将上述cDNA 和各自的引物序列,采用SYBR ™Green PCR Master Mix 在7500 RTqPCR 系统上进行RT-qPCR 反应。引物序列:miR-150-5p,正 向 引 物5′-CATGGCCCTGTCTCCCAAC-3′,反向引物5′-GGCCTGTACCAGGGTCTGA-3′; U6,正向引物5′-GCTTCGGCAGCACATATACTAAAAT-3′,反向引物5′-CGCTTCACGAATTTGCGTGTCAT-3′。以U6 为内参对照,采用2-△△Ct法计算miR-150-5p 表达水平。miR-150-5p 表达水平=实验组组织和细胞中miR-150-5p 表达水平/对照组组织和细胞中miR-150-5p 表达水平×100%。
1.9 Western blotting 法检测各组细胞中BASP1蛋白表达水平采用RIPA 裂解缓冲液裂解各组细胞,并提取总蛋白。通过Bradford 蛋白分析试剂盒测定蛋白浓度。每样本取等量(60 μg) 蛋白在12%SDS-PAGE 凝胶电泳,将电泳分离蛋白质转移到PVDF 膜上。采用5% 脱脂奶粉封闭后,将膜分别与BASP1 抗体(1∶2 000) 和GAPDH 抗体(1∶8 000) 在4 ℃条件下孵育过夜。采用TBST 洗涤5 min×3 次后,将其与HRP- 羊抗兔IgG 抗体(1∶2 000) 室温孵育2 h。采用TBST洗涤10 min×3 次后,采用化学发光试剂盒检测蛋白条带。以GAPDH 为内参,采用Image J 软件分析蛋白条带灰度值,计算BASP1 蛋白表达水平。BASP1 蛋白表达水平=BASP1 蛋白条带灰度值/GAPDH 蛋白条带灰度值×100%。
1.10 CCK-8 法检测各组细胞活性将MPC5 细胞以5 000 个/孔接种于96 孔细胞培养板,按照“1.7” 分组方法处理后,每孔分别加入10 μL CCK-8试剂,37 ℃孵育2 h,采用酶标仪检测490 nm 波长处各孔吸光度(A)值,计算细胞活性。细胞活性=各处理组A值/(Con+NC)组A值×100%。
1.11 ELISA 法检测各组细胞中ROS 水平和LDH活性按照ELISA 分析试剂盒说明书中的步骤,检测各组细胞中ROS 水平和LDH 活性。
1.12 流式细胞术检测各组细胞凋亡率取各组MPC5 细胞,调整细胞密度为1×105mL-1,采用PBS 缓冲液洗涤后,重悬于500 μL 结合缓冲液中。依次加入5 μL Annexin Ⅴ-FITC 和5 μL PI 试剂混匀,在室温避光条件下染色15 min,采用流式细胞术检测各组细胞凋亡率。
1.13 统计学分析采用SPSS 21.0 统计软件进行统计学分析。各组小鼠肾组织和各组细胞中miR-150-5p 表达水平,各组细胞中BASP1 蛋白表达水平、相对荧光素酶活性、细胞活性、ROS 水平、LDH 活性和细胞凋亡率均符合正态分布,以±s表示,2组间样本均数比较采用t检验,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 2 组小鼠肾组织中和不同时间HG 组细胞中miR-150-5p 表达水平与对照组(99.64%±6.45%) 比较,DN 组小鼠肾组织中miR-150-5p 表达水平(37.42%±4.43%)明显降低(P<0.01)。与对照组比较,不同时间HG 组细胞中miR-150-5p 表达水平明显降低(P<0.05 或P<0.01),且呈时间依赖性。见表1。
表1 各组细胞中miR-150-5p 表达水平Tab.1 Expression levels of miR-150-5p in MPC5 cells in various groups (n=4,±s,η/%)

表1 各组细胞中miR-150-5p 表达水平Tab.1 Expression levels of miR-150-5p in MPC5 cells in various groups (n=4,±s,η/%)
*P<0.05,**P<0.01 compared with control group.
Group Control HG (t/h)12 24 48 72 miR-150-5p expression level 100.76±8.25 83.65±3.78*71.93±6.84**49.29±9.88**25.63±3.02**
2.2 2 组小鼠肾组织中BASP1 蛋白表达情况和不同时间HG 组细胞中BASP1 蛋白表达水平与对照组比较,DN 组小鼠肾组织的肾小球中BASP1 富集表达,足细胞减少(足细胞标记物Synaptopodin的荧光强度减弱),BASP1与肾小球足细胞存在共定位,且足细胞中BASP1 表达强度升高(Synaptopodin 与BASP1 共定位的细胞中BASP1 荧光表达强度增强)。见图1 和2。与对照组比较,随着HG 处理时间延长,不同时间HG 组MPC5 细胞中BASP1 蛋白表达水平逐渐升高(P<0.01)。见图3。

图1 2 组小鼠肾组织BASP1 免疫组织化学染色结果(Bar=50 μm)Fig.1 Results of BASP1 immunohistochemical staining in kidney tissue of mice in two groups(Bar=50 μm)

图3 各组细胞中BASP1蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregrams(A)and histogram(B) of expressions of BASP1 protein in cells in various groups
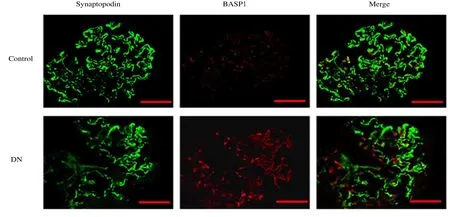
图2 2 组小鼠肾组织BASP1 免疫荧光染色结果(Bar=50 μm)Fig.2 Results of BASP1 immunofluorescence staining in kidney tissue of mice in two groups(Bar=50 μm)
2.3 BASP1 与miR-150-5p 的靶向关系BASP1-3′-UTR 区存在与miR-150-5p 碱基互补结合的序列(图4A)。与miR-NC+BASP1-3′-UTR WT 组比较,miR-150-5p mimic+BASP1-3′-UTR WT 组细胞相对荧光素酶活性明显降低(P<0.01);与miR-NC+BASP1-3′-UTR MUT 组 比 较,miR-150-5p mimic+BASP1-3′-UTR MUT 组细胞相对荧光素酶活性差异无统计学意义(P>0.05)(图4B)。与miR-NC 组比较,miR-150-5p mimic 组细胞中BASP1 蛋白表达水平明显降低(P<0.01),miR-150-5p inhibitor 组细胞中BASP1 蛋白表达水平明显升高(P<0.01)。见图5。

图4 预测的BASP1-3′-UTR 区与miR-150-5p 结合位点(A)和各组细胞相对荧光素酶活性(B)Fig.4 Predicted binding sites of BASP1-3′-UTR region and miR-150-5p (A) and relative luciferase activities in cells in various groups (B)

图5 各组细胞中BASP1 蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram (A) and histogram (B) of expressions of BASP1 protein in cells in various groups
2.4 各组细胞活性、细胞中ROS 水平及LDH 活性和细胞凋亡率与Con+NC 组比较,HG+NC 组细胞活性明显降低(P<0.01),细胞中ROS 水平及LDH 活性和细胞凋亡率均明显升高(P<0.01);与HG+NC 组 比 较,HG+mimic 组 和HG+mimic+SC 组细胞活性明显升高(P<0.01),细胞中ROS 水平及LDH 活性和细胞凋亡率均明显降低(P<0.01),HG+mimic组与HG+mimic+SC组比较差异无统计学意义(P>0.05); 与HG+mimic+SC 组比较,HG+mimic+BASP1 组细胞活性明显降低(P<0.01),细胞中ROS水平及LDH活性和细胞凋亡率均明显升高(P<0.01)。见表2。
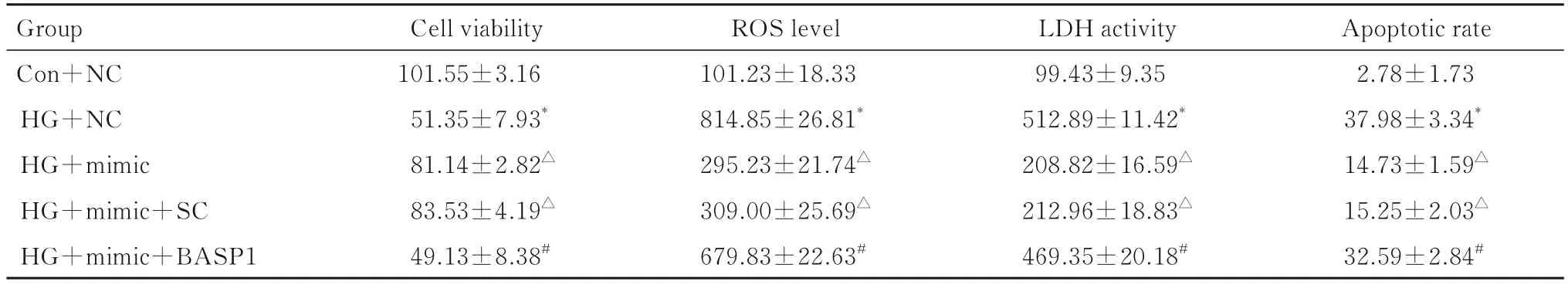
表2 各组细胞活性、细胞中ROS 水平及LDH 活性和细胞凋亡率Tab.2 Cell viabilities, ROS levels,LDH activities,and apoptotic rates of cells in various groups (n=3,-x±s,η/%)
3 讨 论
DN 作为糖尿病患者最重要的并发症之一,其发病率随着糖尿病发病率的升高呈逐年上升趋势,且已经成为终末期肾病的第二大病因[1]。由于DN患者存在一系列复杂的代谢紊乱,一旦进展为终末期肾病,治疗将十分困难。因此,迫切需要寻找针对DN 的有效治疗靶点来为临床治疗提供策略。足细胞在维持肾小球结构及其滤过功能方面具有重要作用,但由于其分裂能力有限,其受损后对肾脏功能的影响难以恢复[14]。近来越来越多的证据[5,15-16]表明:miRNAs 在调节足细胞功能方面发挥了重要作用。研究[15]显示:miR-30s 缺失可致足细胞损伤并导致蛋白尿。另有研究[16]显示:在糖尿病患者中miR-150-5p、miR-146a 和miR-424 表达水平均降低。miR-150-5p 也被证明在肥胖患者体内呈低表达[8]。本研究结果显示:miR-150-5p 在DN 小鼠的肾组织和HG 刺激下的MPC5 细胞中表达下调,而引入外源性miR-150-5p mimic 则可通过减少细胞的氧化应激和细胞凋亡来减轻HG 诱导的足细胞损伤。在早期的DN 病理改变中,细胞凋亡被认为是足细胞耗竭消失的主要原因[17-19]。本研究证实:过表达miR-150-5p 可抑制HG 诱导的MPC5 细胞的活性降低和凋亡。因此,上调miR-150-5p 的表达可能是延缓DN 的重要策略之一。
miRNAs 一般通过负调控靶基因的表达来发挥生物学效应[4,20]。本研究结果显示: BASP1 是miR-150-5p 的靶基因。BASP1 在肾组织中表达,且其高表达能促进DN 小鼠肾小管进一步损伤[11]。本研究结果显示:BASP1 在DN 小鼠的肾组织中高表达,其表达与肾小球足细胞存在共定位,且足细胞中BASP1 表达升高,该结果同样在HG 刺激的MPC5 细胞中得到验证。另外,本课题组前期研究[21]显示:在DN 模型中,足细胞特异性BASP1敲除能降低足细胞损伤;在细胞模型中,BASP1过表达能促进HG 诱导的足细胞损伤。本研究结果显示: miR-150-5p 过表达能降低MPC5 细胞中BASP1 的表达;在HG 条件下,BASP1 上调可抑制miR-150-5p 对MPC5 细胞的保护作用。本研究结果说明:miR-150-5p 通过下调BASP1 的表达来抑制HG 诱导的足细胞损伤。
综上所述,miR-150-5p 在DN 小鼠的肾组织以及HG 刺激的足细胞中表达下调,而外源性上调miR-150-5p 可通过靶向BASP1 来减轻HG 诱导的足细胞损伤。

