miR-219a-5p通过下调KLF4减轻H2O2诱导的人心肌细胞氧化损伤*
周云洁, 宋 歌, 路永平, 韩丽华
河南中医药大学第二附属医院 1研究生办公室 2功能检查科 3心内科,郑州 450002
心肌细胞氧化应激及其导致的凋亡在多种心血管疾病的发病机制中发挥着重要作用[1-2]。微小RNAs(micro RNA,miRNAs)是一类小的非编码RNAs,能与靶基因的3′UTR互补配对,导致靶基因的降解或者抑制mRNA的翻译,从而调节基因表达。在哺乳动物中有将近90%的基因都是被miRNAs调节的。已经发现miRNAs在多种生物进程中发挥重要的调节作用,如细胞发育、增殖、分化和凋亡等。miR-219a-5p是近年来发现的一个miRNA,已有的研究显示miR-219a-5p在多种癌症中表达异常,具有明显的抑癌作用[3-5],还能促进肺癌对放疗、化疗的敏感性[3,6]。Xiao等[7]的研究发现,在肝脏缺血再灌注损伤小鼠模型中过表达miR-219a-5p能够降低血清中谷丙转氨酶、谷草转氨酶和氧化指标的水平,减少肝脏中凋亡细胞数目,这表明miR-219a-5p能够减轻小鼠肝脏缺血再灌注损伤。此外,通过细胞模型发现,过表达miR-219a-5p也能减少H2O2诱导的肝细胞凋亡[7]。但是,目前miR-219a-5p对心肌细胞氧化应激损伤的作用和机制还未见相关报道。Krüppel样因子4(Krüppel-like factor 4,KLF4)是一个进化上保守的含锌指修饰结构的转录因子,它能够调节包括多种生物学过程,如细胞生长、增殖和分化等[8]。KLF4与心肌梗死过程中心肌细胞凋亡有关[9]。miRNAs是调节KLF4表达的一个重要因素[10]。但是,目前miR-219a-5p和KLF4的关系还未见相关研究。本研究使用H2O2诱导人心肌细胞(human cardiac myocytes,HCM)氧化应激损伤,探究过表达miR-219a-5p对H2O2诱导HCM氧化应激损伤的作用及其与KLF4的关系。
1 材料与方法
1.1 细胞和主要试剂
HCM细胞(Catalog #6200)和心肌细胞培养液均购于美国ScienCell公司,MTT细胞增殖检测试剂盒和Annexin Ⅴ/PI凋亡检测试剂盒均购于北京索莱宝科技有限公司,Lipofectamine 2000和TRIzol试剂购于美国Invitrogen公司,活性氧检测试剂盒、超氧化物歧化酶(Superoxyde dismutase,SOD)检测试剂盒和丙二醛(malondialdehyde,MDA)检测试剂盒均购买于上海碧云天有限公司,一抗Bax(使用时1∶2000稀释)和Bcl-2(使用时1∶1000稀释)均购于美国Abcam公司,一抗KLF4(使用时1∶1000稀释)购于美国Cell signaling technology公司,荧光素酶报告基因检测试剂盒购于广州锐博生物科技有限公司,cDNA第一链合成试剂盒和Real-time PCR试剂盒购于北京康为世纪生物科技有限公司。
1.2 细胞培养和分组处理
将HCM细胞培养在含有5%胎牛血清、1%心肌细胞生长因子和1%青霉素/链霉素的心肌细胞培养液中,置于37 ℃、5%CO2细胞培养箱中。将HCM细胞随机分成4组:对照组,H2O2组,H2O2+NC mimic组和H2O2+miR-219a-5p组。除对照组外,其余3组均使用200 μmol/L H2O2刺激6 h;H2O2+NC mimic组和H2O2+miR-219a-5p组分别使用Lipofectamine 2000转染NC mimic和miR-219a-5p mimic,转染48 h后使用H2O2刺激。
1.3 MTT检测细胞活力
将HCM细胞按照1.2项中分组进行处理,H2O2处理6 h后用胰酶消化,按照3×103个/孔的密度接种到96孔板中,继续培养24 h;弃上清液,加入90 μL新鲜培养液与10 μL MTT溶液,37 ℃继续培养4 h;弃上清液后每孔加入110 μL Formazan溶解液,在摇床上低速振荡10 min使紫色结晶完全溶解。利用酶标仪在490 nm处测定各孔的吸光度值。
1.4 流式细胞术检测细胞凋亡
利用Annexin Ⅴ/PI双染法检测细胞凋亡。具体操作如下:H2O2处理6 h后,换成新鲜培养液继续培养24 h;4 ℃预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞2次,用250 μL稀释的结合缓冲液重悬细胞,调整细胞密度为1×106个/mL;取100 μL样品加入5 μL Annexin Ⅴ和10 μL PI溶液,混匀后室温避光孵育15 min,再加入400 μL PBS,进行流式细胞仪分析。
1.5 细胞内ROS、MDA和SOD含量检测
胞内ROS含量检测:先用无血清的心肌细胞培养液按照1∶1000的比例将DCFH-DA稀释至终浓度为10 μmol/L;然后将稀释好的DCFH-DA加入到细胞中(按1.0×106个细胞/mL),37 ℃孵育20 min;用无血清的细胞培养液洗涤细胞以除去未进入胞内的DCFH-DA后,在荧光酶标仪上检测各孔的荧光强度,激发波长为488 nm,发射波长为525 nm。
胞内MDA和SOD水平检测:将H2O2处理后培养24 h的细胞充分裂解,离心取上清液,按照试剂盒说明书操作进行检测。最后使用酶标仪分别在532 nm、450 nm处测定吸光度值。
1.6 Real-time PCR检测
应用TRIzol法提取细胞中的总RNA,采用Nandrop2000测定总RNA的浓度和纯度。使用逆转录试剂盒将1 μg总RNA逆转录成cDNA后,以cDNA为模板使用Real-time PCR试剂盒进行PCR扩增。miR-219a-5p和KLF4分别以U6和GAPDH为内参,采用2-ΔΔCt法计算目的基因的相对表达量。引物序列如下:miR-219a-5p上游引物5′-ACACTCCAGCTGGGTGATTGTCCAAACGC-3′,下游引物5′-CTCAACTGGTGTCGTGGA-3′;U6上游引物5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物5′-CGCTTCACGAATTTGCGTGTCAT-3′;KLF4上游引物5′-GATGCTCACCCCACCTTCTT-3′,下游引物5′-TTTCTCACCTGTGTGGGTTCG-3′;GAPDH上游引物5′-TTCTTTTGCGTCGCCAGCCGA-3′,下游引物5′-GTGACCAGGCGCCCAATACGA-3′。
1.7 Western blot检测
用含1 mmol/L PMSF的RIPA裂解液提取细胞的总蛋白,并使用BCA蛋白试剂盒测定所提取蛋白的浓度。取适量蛋白行SDS-PAGE电泳分离蛋白,半干转法将蛋白转移至PVDF膜上;用5%脱脂奶粉室温封闭2 h,加入一抗4 ℃过夜孵育,二抗室温孵育1 h;然后加入ECL发光液拍照,并使用Image J软件分析条带的灰度值。
1.8 双荧光素酶检测
Starbase V3.0软件分析发现miR-219a-5p能够与KLF4的3′-UTR互补配对。将预测的与miR-219a-5p互补配对的KLF4 3′-UTR序列克隆到pGL3-basic载体中,构建野生型pGL3-KLF4载体;另外,将KLF4 3′-UTR突变序列克隆到该载体中,构建突变型pGL3-KLF4-Mut载体,作为阴性对照。然后将构建的2种质粒与miR-219a-5p mimic或对照mimic(NC mimic)使用Lipofectamine 2000共同转染到HCM细胞中。培养48 h后收集细胞,利用双荧光素酶报告基因检测试剂盒测定各组荧光素酶活性。
1.9 统计学方法
2 结果
2.1 各组细胞中miR-219a-5p的表达
采用Real-time PCR检测miR-219a-5p表达。结果如图1所示,与对照组相比,H2O2组中miR-219a-5p的表达水平显著降低(P<0.05)。与H2O2组相比,H2O2+miR-219a-5p组中miR-219a-5p的表达水平显著升高(P<0.05)。

1:对照组;2:H2O2组;3:H2O2+NC mimic组;4:H2O2+miR-219a-5p组;与对照组比较,*P<0.05;与H2O2组比较,#P<0.05图1 各组细胞中miR-219a-5p表达情况Fig.1 miR-219a-5p expression in each group
2.2 各组细胞活力的变化
MTT法检测细胞活力,结果如图2所示,与对照组相比,H2O2组细胞活力显著降低(P<0.05)。与H2O2组相比,H2O2+miR-219a-5p组细胞活力显著升高(P<0.05)。
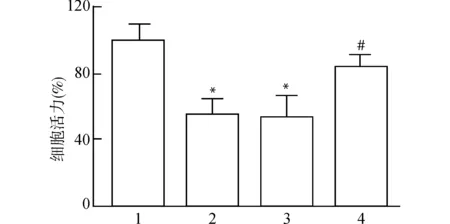
1:对照组;2:H2O2组;3:H2O2+NC mimic组;4:H2O2+miR-219a-5p组;与对照组比较,*P<0.05;与H2O2组比较,#P<0.05图2 各组细胞活力情况Fig.2 Cell viability in each group
2.3 各组细胞凋亡情况
流式细胞术检测细胞凋亡,结果如图3A所示,与对照组相比,H2O2组中细胞凋亡显著增加(P<0.05)。与H2O2组相比,H2O2+miR-219a-5p组中细胞凋亡显著降低(P<0.05)。
采用Western blot检测细胞中Bax和Bcl-2的表达。结果如图3B所示,与对照组相比,H2O2组中Bax/Bcl-2的比值显著增加(P<0.05)。与H2O2组相比,H2O2+miR-219a-5p组中Bax/Bcl-2的比值显著降低(P<0.05)。

1:对照组;2:H2O2组;3:H2O2+NC mimic组;4:H2O2+miR-219a-5p组;A:流式细胞术检测各组细胞凋亡率;B:Western blot检测各组中Bax和Bcl-2蛋白表达;与对照组比较,*P<0.05;与H2O2组比较,#P<0.05图3 各组细胞中凋亡率和Bax/Bcl-2比值的变化Fig.3 Apoptosis rate and ratio of Bax/Bcl-2 in each group
2.4 各组细胞中ROS、MDA和SOD含量的变化
与对照组相比,H2O2组中ROS和MDA水平增加,SOD水平降低,差异均具有统计学意义(均P<0.05)。与H2O2组相比,H2O2+miR-219a-5p组中ROS和MDA水平降低,SOD水平升高,差异具有统计学意义(均P<0.05)。见图4。
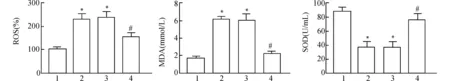
1:对照组;2:H2O2组;3:H2O2+NC mimic组;4:H2O2+miR-219a-5p组;与对照组比较,*P<0.05;与H2O2组比较,#P<0.05图4 各组细胞中ROS、MDA和SOD含量Fig.4 Levels of ROS,MDA and SOD in each group
2.5 各组细胞中KLF4表达情况
Real-time PCR和Western blot检测各组细胞中KLF4 mRNA和蛋白表达水平情况,结果如图5所示。与对照组相比,H2O2组中KLF4 mRNA和蛋白表达水平均显著升高(均P<0.05)。与H2O2组相比,H2O2+miR-219a-5p组中KLF4 mRNA和蛋白水平表达均显著降低(均P<0.05)。

1:对照组;2:H2O2组;3:H2O2+NC mimic组;4:H2O2+miR-219a-5p组;与对照组比较,*P<0.05;与H2O2组比较,#P<0.05图5 各组细胞中KLF4 mRNA和蛋白表达情况Fig.5 The mRNA and protein levels of KLF4 in each group
2.6 KLF4是miR-219a-5p的靶基因
使用双荧光素酶报告基因检测确证KLF4与miR-219a-5p的关系,结果见图6,在PGL3-KLF4野生型载体中,与NC mimic组相比,miR-219a-5p mimic转染显著降低了荧光强度(P<0.05);而在PGL3-KLF4-Mut突变型载体中,与NC mimic组相比,miR-219a-5p mimic转染对荧光强度的影响不大,差异无统计学意义(P>0.05)。

与NC mimic组比较,*P<0.05图6 双荧光素酶报告基因检测证实KLF4是miR-219a-5p的靶基因Fig.6 Dual-luciferase reporter gene assay revealed that KLF4 is a target gene of miR-219a-5p
3 讨论
miR-219a-5p是近年来开始被广泛研究的一个miRNA,它在多种肿瘤的发生和发展中具有重要作用。此外,研究发现miR-219a-5p还能够促进成骨细胞分化[11],缓解肝脏缺血再灌注损伤[7],减轻大脑缺血再灌注损伤[12]。但是,目前miR-219a-5p在心血管疾病中的研究还未见相关报道。本研究探究了miR-219a-5p对氧化应激诱导的心肌细胞损伤的作用和机制。
H2O2是常见的细胞氧化应激损伤的诱导物,我们利用H2O2诱导建立HCM细胞氧化应激损伤模型。氧是心肌细胞的一个重要底物,线粒体呼吸通常伴随着ROS的产生。ROS会与核酸、蛋白和脂质等生物大分子相互作用,最终导致细胞功能障碍和凋亡[13]。氧化剂与抗氧化剂之间的平衡对于维持正常的生理功能至关重要,外源性刺激会破坏这个平衡造成ROS的过度积累,诱导多种疾病。在氧化应激条件下,脂质过氧化产物(如MDA)可直接反映ROS的产生,胞内抗氧化剂(如SOD)可减少胞内ROS含量[13]。Bax是一个重要的凋亡蛋白,而Bcl-2是一个重要的抗凋亡蛋白,H2O2可诱导Bax和Bcl-2比例的失调[13]。本研究使用200 μmol/L H2O2刺激后,HCM细胞活力和SOD含量降低,凋亡率、Bax/Bcl-2、ROS和MDA水平增加,这表明HCM细胞氧化应激损伤模型构建成功。
使用Real-time PCR检测发现H2O2刺激导致miR-219a-5p表达降低。本研究通过miR-219a-5p mimic在HCM细胞中过表达miR-219a-5p,探究miR-219a-5p在H2O2诱导HCM细胞氧化应激损伤中的作用。结果显示,过表达miR-219a-5p能够增加细胞活力和SOD水平,减少细胞凋亡、ROS和MDA含量,下调Bax/Bcl-2比值。这表明过表达miR-219a-5p能够抑制H2O2诱导的心肌细胞氧化应激损伤。
我们又进一步探究了miR-219a-5p的作用机制。生物信息学分析结果显示miR-219a-5p能够与KLF4的3′-UTR互补配对。研究发现,在视网膜上皮细胞中,氧化应激可诱导KLF4表达,进而激活炎症反应[14]。在心肌梗死的心脏样本中,KLF4呈高表达[15]。而KLF4表达下调可以缓解H2O2诱导的心肌细胞损伤[16]。因此,我们将miR-219a-5p的作用机制主要集中到KLF4上。与之前的研究结果相似,我们的研究也显示H2O2刺激后,HCM细胞中KLF4表达上调。过表达miR-219a-5p能够抑制KLF4 mRNA和蛋白水平表达,且双荧光素酶报告系统证实了KLF4是miR-219a-5p的靶基因。miR-219a-5p能够促进肿瘤细胞凋亡[3-5],而本研究发现miR-219a-5p能够抑制H2O2诱导的心肌细胞凋亡,这可能是因为在不同类型的细胞中,miR-219a-5p的靶基因不同导致的。
总之,本研究结果表明miR-219a-5p过表达能够抑制H2O2诱导的人心肌细胞氧化应激损伤,这种作用可能是通过下调KLF4表达实现的。本研究进一步阐明了心肌细胞氧化应激损伤的机制,也为临床上心肌氧化损伤的治疗提供了一定的理论依据。

