circPRKCI靶向miR-217对缺氧/复氧诱导心肌细胞损伤的影响
刘 颁,姜丕桥,熊桂丽,焦 奇
急性心肌梗死等心血管疾病是威胁人类生命安全的主要疾病,再灌注治疗可缓解心肌缺血缺氧,同时也可加重缺血再灌注损伤,从而降低治疗效果,已知氧化应激、细胞凋亡等是导致心肌细胞损伤的主要原因,因此,如何减轻心肌细胞损伤成为治疗缺血再灌注损伤的研究热点[1]。环状RNA(circRNA)可充当微小RNA(miRNA)的海绵分子,参与心肌细胞损伤过程,并可能作为治疗的潜在靶标[2-4]。circPRKCI在脂多糖诱导的人肾小管上皮细胞中呈低表达,上调其表达可通过miR-545/ZEB2分子轴减轻细胞损伤[5]。但circPRKCI在心肌细胞损伤中的作用机制尚未明确。靶基因预测显示miR-217与circPRKCI存在结合位点,抑制miR-217表达通过核转录因子-κB(NF-κB)/丝裂原活化蛋白激酶(MAPK)途径可防止心肌缺血-再灌注损伤[6]。但circPRKCI是否通过靶向调控miR-217表达影响缺氧/复氧(H/R)诱导的心肌细胞损伤尚未明确。本研究采用H/R诱导的心肌细胞建立细胞损伤模型,探讨circPRKCI/miR-217对H/R诱导的心肌细胞氧化应激和凋亡的影响及可能的作用机制。
1 材料与方法
1.1 实验材料与试剂 大鼠心肌细胞H9c2购自上海弘顺生物科技有限公司;DMEM培养基购自美国Gibco公司;Lipofectamine2000、Trizol购自美国Invitrogen公司;反转录与荧光定量聚合酶链反应(PCR)试剂购自北京天根生化科技有限公司;pcDNA、pcDNA-circPRKCI购自美国Invitrogen公司;miR-NC、miR-217 mimics、si-NC、si-circPRKCI、anti-miR-NC、anti-miR-217购自广州锐博生物科技有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自南京建成生物工程研究所;凋亡检测试剂盒购自美国Sigma公司;兔抗鼠Bcl-2、Bax抗体购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗购自美国Abcam公司。
1.2 实验方法
1.2.1 实验分组 心肌细胞培养于含10%胎牛血清的DMEM培养液中,取对数生长期心肌细胞(1×105个/mL)接种于96孔板(每孔100 μL),将培养液更换为不含血清的DMEM培养液,细胞置入37 ℃,95%N2,体积分数5%CO2培养箱内缺氧处理3 h,之后将培养液更换为含10%胎牛血清的DMEM培养液,将其置入37 ℃、体积分数5%CO2培养箱内复氧处理4 h[7],作为H/R组。将正常培养的心肌细胞作为对照组。pcDNA、pcDNA-circPRKCI、anti-miR-NC、anti-miR-217、pcDNA-circPRKCI与miR-NC、pcDNA-circPRKCI与miR-217 mimics分别转染至心肌细胞后进行H/R处理,分别作为H/R+pcDNA组、H/R+pcDNA-circPRKCI组、H/R+anti-miR-NC组、H/R+anti-miR-217组、H/R+pcDNA-circPRKCI+miR-NC组、H/R+pcDNA-circPRKCI+miR-217组。
1.2.2 实时荧光定量逆转录聚合酶链式反应(qRT-PCR)检测细胞circPRKCI、miR-217表达水平 采用Trizol法提取各组心肌细胞总RNA,应用Nanodrop2000c超微量分光光度计检测RNA浓度后置于-80 ℃超低温冰箱内保存。应用反转录试剂盒将总RNA合成cDNA,cDNA稀释20倍后进行qRT-PCR,按照试剂盒说明书配置反应体系及设置反应条件,应用美国ABI StepOnePlus实时荧光定量PCR仪检测circPRKCI、miR-217表达水平。
1.2.3 检测MDA、SOD、GSH-Px含量 采用反复冻融法裂解各组心肌细胞,使用硫代巴比妥酸法检测MDA含量,黄嘌呤氧化酶法检测SOD活性,5,5′-二硫代(2-硝基苯甲酸)双比色法测定GSH-Px活性,严格按照试剂盒说明书进行操作。
1.2.4 流式细胞术检测细胞凋亡率 各组心肌细胞中加入预冷的磷酸缓冲盐溶液(PBS)洗涤,弃上清液后收集细胞沉淀,加入500 μL结合缓冲液重悬细胞后,分别加入5 μL染色液(Annexin V-FITC)与5 μL碘化丙啶(PI),充分混匀后室温孵育10 min,应用FACS Calibur流式细胞仪检测细胞凋亡率。
1.2.5 双荧光素酶报告基因检测circPRKCI与miR-217的靶向关系 StarBase预测显示circPRKCI与miR-217存在结合位点,分别构建野生型载体WT-circPRKCI与突变型载体MUT-circPRKCI,将其分别与miR-NC、miR-217 mimics共转染至心肌细胞后继续培养24 h并检测荧光素酶活性。
1.2.6 免疫印迹法检测Bcl-2、Bax蛋白表达 各组心肌细胞加入400 μL放射免疫沉淀(RIPA)裂解液提取细胞总蛋白,采用2,2-联喹啉-4,4-二甲酸二钠(BCA)法检测蛋白浓度后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜、封闭2 h后加入一抗稀释液(1∶1 000),4 ℃条件下孵育24 h后使用TBST洗涤,加入二抗稀释液(1∶2 000)后置于室温孵育1 h,使用TBST洗涤后加入电化学发光(ECL)液,暗室内曝光显影,应用Image J软件分析各条带灰度值。

2 结 果
2.1 circPRKCI和miR-217在H/R诱导的心肌细胞损伤中的表达 与对照组比较,H/R组circPRKCI表达水平降低,miR-217表达水平升高,差异有统计学意义(P<0.001)。详见表1。
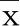
表1 circPRKCI和miR-217在H/R诱导的心肌细胞损伤中的表达(±s)
2.2 circPRKCI过表达对H/R诱导的心肌细胞损伤的影响 与对照组比较,H/R组MDA含量、细胞凋亡率增加(P<0.05),SOD、GSH-Px、Bcl-2蛋白水平降低(P<0.05),Bax蛋白水平升高(P<0.05);与H/R+pcDNA组比较,H/R+pcDNA-circPRKCI组MDA含量、细胞凋亡率降低(P<0.05),SOD、GSH-Px活性增加,Bcl-2蛋白水平升高(P<0.05),Bax蛋白水平降低(P<0.05)。详见图1、表2。
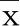
表2 circPRKCI过表达对H/R诱导的心肌细胞损伤的影响(±s)
2.3 circPRKCI靶向调控miR-217的表达 StarBase预测提示circPRKCI与miR-217存在结合位点,详见图2。miR-217过表达可降低野生型载体WT-circPRKCI荧光素酶活性(P<0.001),而对突变型载体MUT-circPRKCI的荧光素酶活性无明显影响(P>0.05),详见表3。与pcDNA组比较,pcDNA-circPRKCI组miR-217表达水平降低(P<0.05);与si-NC组比较,si-circPRKCI组miR-217表达水平升高(P<0.05),详见表4。
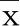
表3 双荧光素酶实验结果(±s)
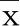
表4 circPRKCI调控miR-217的表达(±s)
2.4 干扰miR-217表达对H/R诱导的心肌细胞损伤的影响 与H/R+anti-miR-NC组比较,H/R+anti-miR-217组MDA含量降低,SOD、GSH-Px活性升高,细胞凋亡率降低,Bcl-2蛋白水平升高,Bax蛋白水平降低,差异有统计学意义(P<0.001)。详见图3、表5。

图3 干扰miR-217表达对H/R诱导的心肌细胞凋亡的影响(A为凋亡相关蛋白表达电泳图;B为细胞凋亡流式图)
表5 干扰miR-217表达对H/R诱导的心肌细胞损伤的影响(±s)
2.5 上调miR-217表达逆转了circPRKCI过表达对H/R诱导的心肌细胞损伤的作用 与H/R+pcDNA-circPRKCI+miR-NC组比较,H/R+pcDNA-circPRKCI+miR-217组MDA含量升高(P<0.05),SOD、GSH-Px活性降低,细胞凋亡率增加,Bcl-2蛋白水平降低,Bax蛋白水平升高,差异有统计学意义(P<0.001)。详见图4、表6。
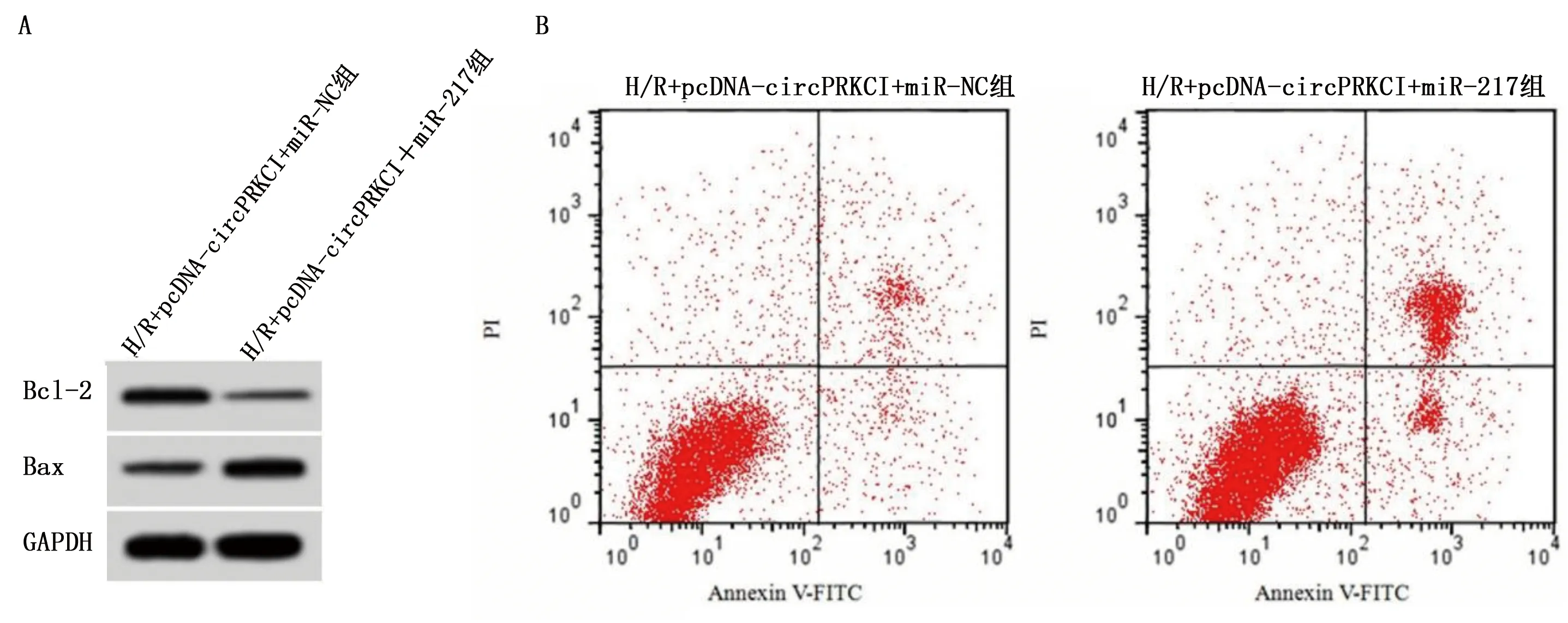
图4 上调miR-217表达逆转了circPRKCI过表达对H/R诱导的心肌细胞凋亡的作用(A为凋亡相关蛋白表达电泳图;B为细胞凋亡流式细胞图)
表6 上调miR-217表达逆转了circPRKCI过表达对H/R诱导的心肌细胞损伤的作用(±s)
3 讨 论
急性心肌梗死病理过程复杂,而心肌缺血再灌注损伤是加重心肌细胞凋亡的重要原因之一,因而寻找心肌损伤调控靶点或作用机制对提高病人治疗效果具有重要的意义。circHIPK3通过miR-29a/胰岛素样生长因子1(IGF-1)通路调节缺氧诱导的心肌细胞氧化损伤[8]。沉默circ-0010729通过上调miR-145-5p减轻心肌细胞损伤[9]。circRNA-101237通过靶向let-7a-5p/IGF2BP3介导心肌细胞H/R损伤[10]。但circPRKCI在心肌细胞损伤中的作用机制尚未明确。
circPRKCI在过氧化氢诱导的神经元细胞中表达水平降低,上调其表达通过miR-545/589-E2F7轴介导过氧化氢诱导的神经元细胞损伤[11]。本研究结果显示,H/R诱导的心肌细胞circPRKCI表达水平降低,提示circPRKCI表达下调可能加重心肌细胞氧化损伤。本研究结果显示,H/R诱导的心肌细胞MDA含量升高,SOD、GSH-Px活性降低,与相关研究报道结果[12-13]相似,提示成功建立心肌细胞氧化损伤模型。本研究通过体外细胞实验证实,circPRKCI过表达可降低H/R诱导心肌细胞中MDA含量,增强SOD、GSH-Px活性,提示circPRKCI过表达可抑制氧化应激,从而减轻H/R诱导心肌细胞损伤。氧自由基生成量增加可激活线粒体凋亡途径,其中Bcl-2表达水平降低,而Bax表达水平升高,通过激活Caspase-3从而诱导细胞凋亡[14-15]。本研究结果显示,H/R诱导的心肌细胞凋亡率升高,Bcl-2蛋白水平降低,Bax蛋白水平升高,circPRKCI过表达可降低H/R诱导的心肌细胞凋亡率,并可抑制Bax表达及促进Bcl-2表达,提示circPRKCI过表达可抑制氧化应激诱导的细胞凋亡,从而减轻心肌细胞氧化损伤。
本研究结果还证实circPRKCI可充当miR-217的海绵分子,并负向调控miR-217表达及活性。抑制miR-217表达可通过恢复张力蛋白同源物(PTEN)介导的自噬途径减轻高糖诱导的足细胞损伤[16]。miR-217通过靶向磷酸酯酶与PTEN促进心脏肥大和功能障碍[17]。miR-217表达上调可促进高糖诱导的足细胞凋亡[18]。本研究结果显示,H/R诱导的心肌细胞miR-217表达水平升高,抑制miR-217表达可明显降低MDA含量,增强SOD、GSH-Px活性,并降低细胞凋亡率,提示抑制miR-217表达可增强细胞抗氧化能力及抑制细胞凋亡,从而减轻H/R诱导的心肌细胞凋亡。本研究结果显示,circPRKCI过表达与miR-217过表达联合处理可提高MDA含量,减低SOD、GSH-Px活性,并提高细胞凋亡率,提示miR-217过表达可逆转circPRKCI过表达对H/R诱导的心肌细胞氧化应激及凋亡作用。
综上所述,H/R诱导的心肌细胞中circPRKCI表达水平降低,而miR-217表达水平升高,circPRKCI过表达通过下调miR-217表达抑制氧化应激及其诱导细胞凋亡,从而减轻心肌细胞氧化损伤,circPRKCI/miR-217可能作为心肌缺血再灌注损伤的治疗靶点,但具体作用机制需进一步分析。

