新型硫化氢供体对癫痫大鼠模型海马Nrf2蛋白表达和SOD活性的影响*
张艺泷, 黄宝怡, 黄文幸, 钟宇婷, 詹芷晴,邓 镇, 汪 鹏, 刘国辉, 朱晓琴△, 苏 涛
1广州医科大学附属第二医院神经科学研究所,广州 510260 2广州医科大学基础医学院生理学教研室,广州 511436
癫痫是一种神经系统慢性临床综合征[1]。硫化氢(hydrogen sulfide,H2S)是一种新型的气体信号分子,在多种器官组织中发挥着重要的抗氧化应激和细胞保护作用[2-3]。经典硫化氢供体硫氢化钠性质不稳定、作用时效短,易影响实验结果。为弥补其弊端,本研究采用本课题组研究制备的新型硫化氢供体,以便更有效地探究H2S的作用机制。此外,课题组前期研究结果表明,H2S可以抑制大鼠癫痫发作,其机制可能与调节Kir6.2表达有关[4-6],但具体作用机制尚未明确。通过查阅文献发现,近年来核因子E2相关因子2(Nuclear factor erythroid 2-related factor 2,Nrf2)作为癫痫的潜在治疗靶点备受关注[7-9]。研究显示,Nrf2是机体调节抗氧化反应的重要转录因子,当机体受到氧化应激刺激后Nrf2转位进入细胞核,与抗氧化反应元件(antioxidant response element,ARE)结合,启动Nrf2-ARE信号通路,Nrf2蛋白表达上调,并促使下游抗氧化酶如超氧化物歧化酶(superoxide dismutase,SOD)活性增加,降低氧化应激水平,发挥了重要的神经保护作用[10-12]。由此我们猜测H2S抗癫痫的机制或与Nrf2这一靶点有关。故本研究采用新型硫化氢供体干预急性癫痫模型大鼠,检测其对大鼠海马组织中Nrf2蛋白表达及SOD活性的影响,为癫痫的药物靶向治疗提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 成年健康Sprague-Dawley(SD)大鼠24只,SPF级,雌雄不拘,体重(250±30)g,由广州中医药大学实验中心提供,常规实验条件下饲养。
1.1.2 主要试剂 新型硫化氢供体(专利号:ZL201910164930.3)为课题组前期合成的一种新型芳基硫代酰胺类化合物,其在成年大鼠中最佳抗癫痫浓度为500 μmol/L,作用时间为2 h[4]。戊四氮(pentylenetetrazole,PTZ)购自Sigma公司;鸦胆子苦醇(brusatol)购自成都植标公司;SOD试剂盒购自Elabscience公司;兔抗大鼠Nrf2多克隆抗体购自捷威斯生物公司;兔抗大鼠GADPH多克隆抗体购自CST公司;实时荧光定量PCR试剂盒购自日本TaKaRa公司;引物合成由上海Invitrogen生物工程公司完成。
1.2 实验分组与模型制备
将24只大鼠随机分为4组,分别为对照组(Control组)、致痫组(epilepsy,EP组)、H2S干预组(H2S+EP组)和硫化氢干预+Nrf2蛋白抑制剂(鸦胆子苦醇,brusatol)组(H2S+Brusatol+EP组)。每组6只,分别经侧脑室注射不同的药物进行预处理。Control组和EP组均注射10 μL的生理盐水,H2S+EP组以10 μL H2S探针(500 μmol/L)进行预处理,H2S+Brusatol+EP组同时注射10 μL H2S探针和鸦胆子苦醇(1 mg/kg,用0.2%二甲基亚砜溶液配置)。PTZ溶于生理盐水制成1%溶液。侧脑室注射2 h后,EP组、H2S+EP组、H2S+Brusatol+EP用PTZ首剂(50 mg/kg)进行腹腔注射,观察大鼠行为学变化。若10 min后无大发作,以原始剂量的半量(25 mg/kg)注射,评估方法如前,之后每隔10 min补注射小剂量PTZ(1.25 mg/kg)直至大鼠癫痫发作[13]。Control组腹腔注射等剂量的生理盐水。
1.3 行为学观察
根据Racine癫痫发作标准评估[14]。0级:无发作;Ⅰ级:嘴边及头部组织抽动;Ⅱ级:头面部痉挛伴点头样动作;Ⅲ级:前肢阵挛发作;Ⅳ级:肢体强直抽搐伴直立;Ⅴ级:全身强直发作伴摔倒。观察并记录大鼠癫痫大发作的潜伏期、发作级别及持续时间。
1.4 BL-420系统监测大鼠脑电变化
于海马位置(大脑左侧前囟后3.8 mm,矢状缝旁2.5 mm)钻开颅骨穿过硬脑膜,将不锈钢双极铜芯电极插入硬膜下3.0 mm。术后缝合部分皮肤,用活力碘消毒皮肤预防感染。将大鼠置于空笼内,引导电极信号通过BL-420生物机能实验系统记录各个实验组大鼠脑电波的变化[15]。
1.5 分光光度法检测海马组织SOD活性
各组大鼠造模成功24 h后麻醉处死,取大鼠一侧海马组织,称重,按重量(g)/体积(mL)=1∶9,加入0.01 mol/L磷酸盐缓冲液(PBS,pH7.4)在低温条件下用电动匀浆器进行匀浆,在4 ℃离心机中10000×g离心10 min,取上清液置于冰上待测,按照试剂盒说明书测定海马匀浆中SOD的活性。
1.6 Western blot检测海马组织Nrf2蛋白的表达
取50 mg海马组织置于RIPA/PMSF裂解液中,匀浆后12000 r/min离心5 min,收集上清。运用BCA法进行蛋白定量,每孔上样量为40 μg,经10% SDS-PAGE垂直电泳后电转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,然后加入兔抗大鼠Nrf2多克隆抗体(1∶500)和兔抗大鼠GADPH单克隆抗体(1∶1000)4℃孵育过夜,辣根过氧化物酶标记山羊抗兔IgG(1∶1000)室温孵育1 h,ECL显色,利用Bio-Rad成像分析系统检测蛋白条带。使用Image J软件测定各条带的灰度值,以GADPH为内参标准化Nrf2蛋白的表达水平。
1.7 统计学方法
实验数据采用SPSS 17.0统计软件进行处理,计量资料以均数±标准差表示,多组间均数比较采用单因素方差分析(ANOVA),组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠行为学表现
Control组的大鼠行为学表现正常,无发作。EP组大鼠癫痫发作潜伏期为(8.17±7.60)min,发作持续时间为(1240.00±868.38)s,根据Racine标准评估癫痫发作级别为Ⅳ~Ⅴ级;与EP组相比,H2S+EP组大鼠癫痫发作潜伏期[(46.00±22.21)min]明显延长(P<0.05),发作持续时间[(46.60±31.49)s]缩短(P<0.05),发作级别(Ⅱ~Ⅲ级)降低;与H2S+EP组相比,H2S+Brusatol +EP组的大鼠癫痫发作潜伏期[(8.50±7.78)min]缩短(P<0.05),持续时间[(47.50±17.68)s]无明显变化(P>0.05),发作级别(Ⅳ~Ⅴ级)增加;与EP组相比,H2S+Brusatol+EP组大鼠癫痫发作潜伏期无明显变化(P>0.05),发作持续时间缩短(P<0.05)。结果见图1。
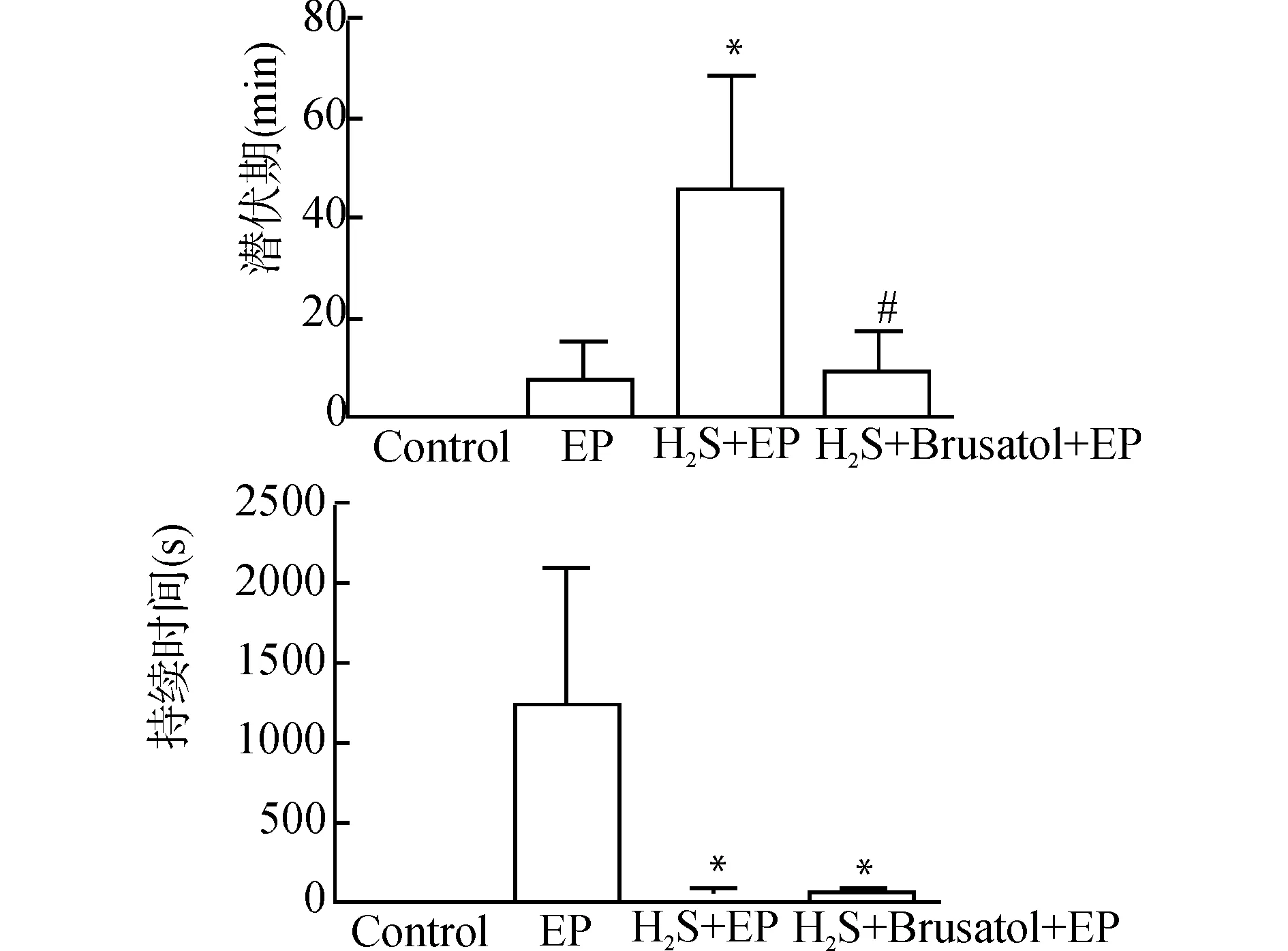
与EP组比较,*P<0.05;与H2S+EP组比较,#P<0.05图1 各组大鼠癫痫发作的潜伏期及持续时间Fig.1 The incubation period and duration of epileptic seizures in rats
2.2 脑电图监测结果
Control组脑电波波幅为(114.39 ± 12.33)μV,为正常的脑电图波形。EP组脑电波波幅为(1506.87 ± 291.28)μV,且记录到明显的尖波、棘波或棘-慢综合波等痫样波;与EP组相比,H2S+EP组癫痫发作波幅[(531.67±26.75)μV]减小(P<0.05);与H2S+EP组相比,H2S+Brusatol+EP组大鼠癫痫发作波幅[(914.20±31.48)μV]增大(P<0.05);与EP组相比,H2S+Brusatol+EP组大鼠癫痫发作波幅差异无统计学意义(P>0.05)。结果见图2。
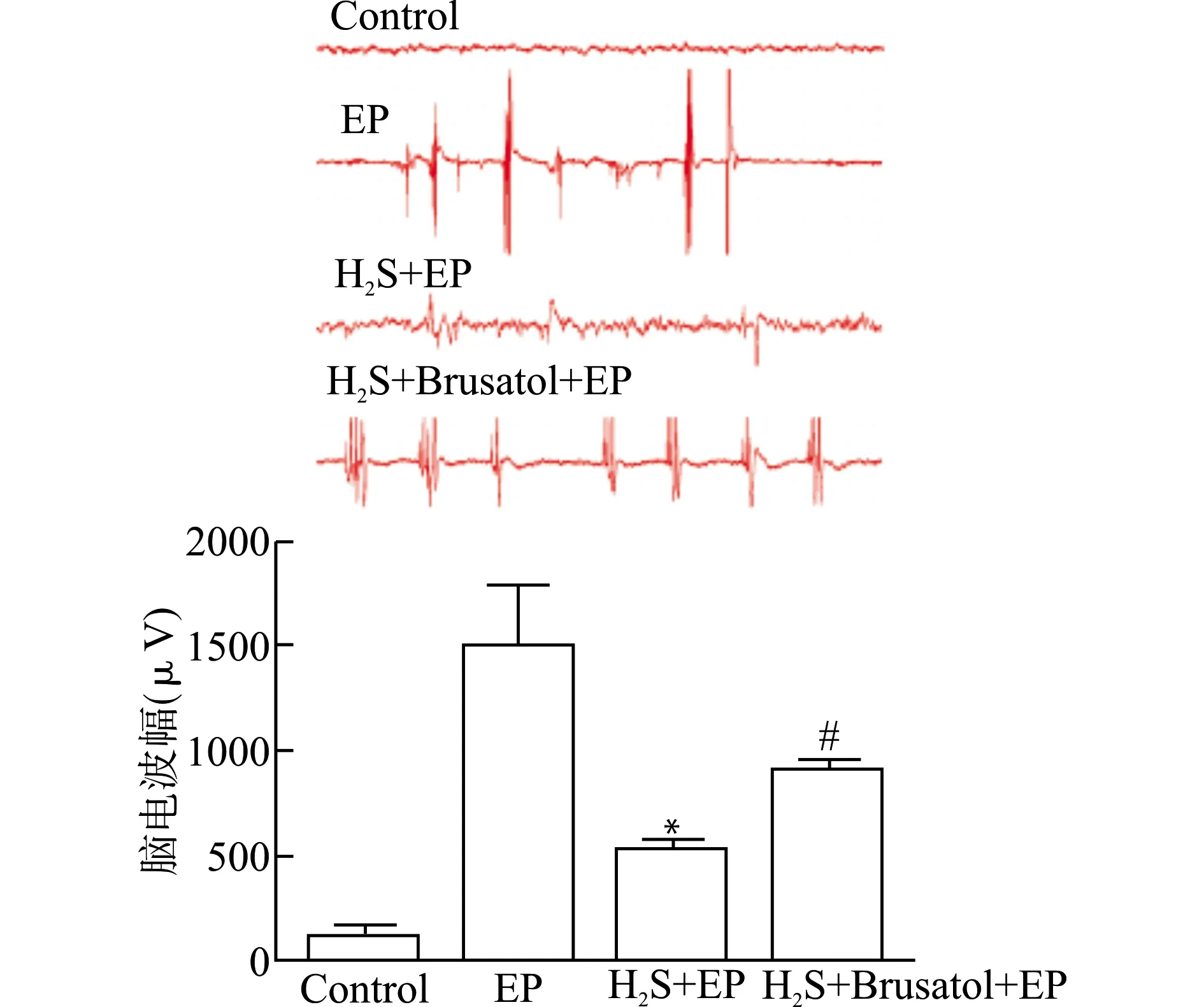
与EP组比较,*P<0.05;与H2S+EP组比较,#P<0.05图2 各组大鼠海马脑电监测结果Fig.2 Hippocampal electroencephalogram of rats in each group
2.3 分光光度法检测海马组织SOD活性变化
Control组大鼠海马组织SOD活性为(512.885±125.216)U/mgprot,EP组大鼠海马组织SOD活性为(344.988±118.245)U/mgprot;与EP组相比,H2S+EP组海马组织SOD活性[(544.474±157.931)U/mgprot]明显升高,差异具有统计学意义(P<0.05);与H2S+EP组相比,H2S+Brusatol+EP组海马组织SOD活性[(304.269±112.062)U/mgprot]显著降低,差异具有统计学意义(P<0.05)。与EP组相比,H2S+Brusatol+EP组海马组织SOD活性差异无统计学意义(P>0.05)。见图3。
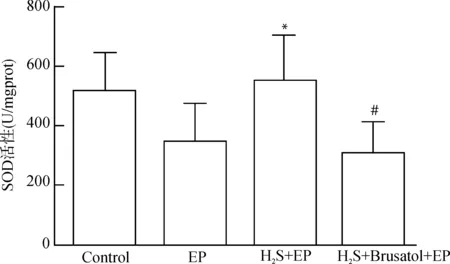
与EP组比较,*P<0.05;与H2S+EP组比较,#P<0.05图3 各组大鼠海马组织中的SOD活性Fig.3 The activity of SOD in hippocampus of rats
2.4 Western blot检测海马组织Nrf2蛋白的表达
Nrf2与GADPH条带灰度值比值,Control组为(0.8684 ± 0.1230)、EP组为(0.8480 ± 0.1018),两者Nrf2蛋白表达差异无统计学意义(P>0.05)。与EP组相比,H2S+EP组Nrf2蛋白表达(1.0732± 0.1833)明显增高,差异有统计学意义(P<0.05);与H2S+EP组相比,H2S+Brusatol+EP组Nrf2蛋白表达(0.8587±0.2040)明显降低,差异有统计学意义(P<0.05);与EP组相比,H2S+Brusatol+EP组Nrf2蛋白表达差异无统计学意义(P>0.05)。见图4。
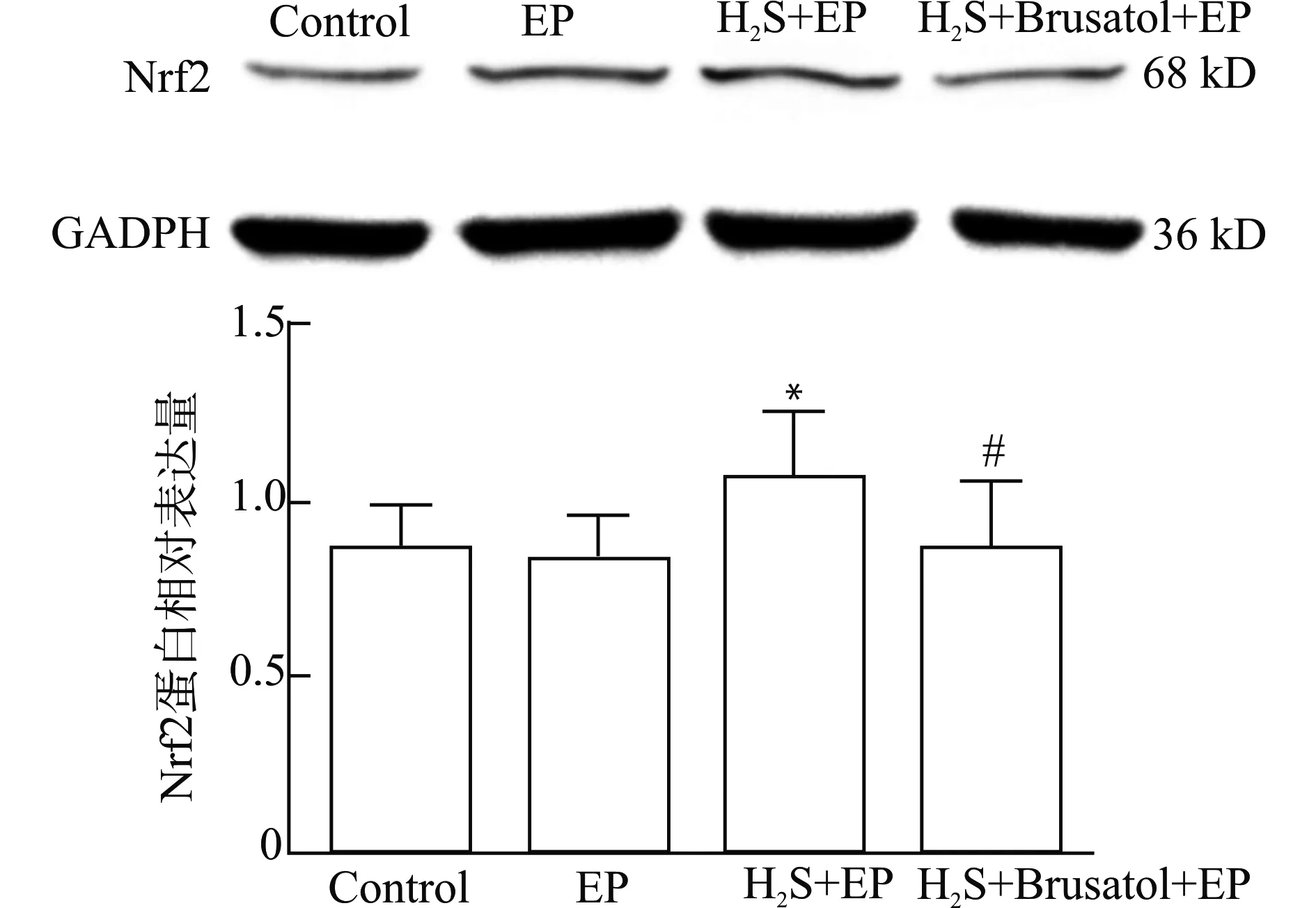
与EP组比较,*P<0.05;与H2S+EP组比较,#P<0.05图4 Western blot检测Nrf2蛋白在大鼠海马组织的表达Fig.4 The expression level of Nrf2 protein in hippocampal tissues of rats detected by Western blotting
3 讨论
H2S作为新型气体信号分子,有抗炎、抗氧化应激等作用[2],并与多种神经系统疾病进展相关[16-18]。课题组前期研究已证实,H2S具有抗癫痫的作用,且其机制可能与上调Kir6.2表达有关[4-6]。Nrf2是机体调节抗氧化反应的重要转录因子。当机体受到氧化应激刺激时,Nrf2与Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein-1,Keap1)解离随后转位进入细胞核,启动Nrf2-ARE信号通路并促使下游抗氧化酶(如SOD等)基因表达上调,从而发挥重要的神经保护作用[10]。
进一步查阅文献发现,H2S能够激活糖尿病性心肌病小鼠体内的Nrf2-ARE信号通路,减轻高血糖导致的心脏组织炎症、氧化应激,改善糖尿病小鼠的左心室功能[19]。另有研究显示,H2S可以防止高盐饮食诱导的肾脏损伤,其通过活化Nrf2,起到增强抗氧化能力并抑制肾脏氧化应激的作用[20]。此外,H2S通过上调Nrf2蛋白表达降低氧化应激这一作用,在硫芥子气诱导的肺损伤、百草枯诱导的急性肝损伤等疾病模型研究中也得到证实[21-22]。由此,H2S抑制癫痫发作的具体机制,是否与其激活Nrf2-ARE信号通路有关,值得我们探索。
研究显示,萝卜硫素(sulforaphane,SFN)激活Nrf2-ARE信号通路后,Nrf2蛋白表达水平上调,由癫痫发作引起的氧化应激水平明显减轻[23]。另有研究表明,脱氢表雄酮处理14 d后,Nrf2-ARE信号通路激活,大鼠癫痫样发作活动减少,SOD活性明显升高[24]。我们的实验结果显示:与EP组相比,H2S+EP组大鼠癫痫大发作潜伏期明显延长,发作持续时间缩短,癫痫发作级别降低,海马组织Nrf2蛋白表达及SOD活性明显增高。此外,Mazzuferi等[8]研究证实:在颞叶癫痫小鼠模型中,与正常小鼠相比,癫痫小鼠的Nrf2蛋白表达水平并未减少。本实验结果亦显示:与Control组相比,EP组Nrf2蛋白表达无显著性差异,与前述研究相符。上述实验结果表明,外源性给予H2S预处理后,癫痫大鼠海马Nrf2蛋白表达增加,其下游抗氧化酶SOD活性亦增加,氧化应激反应减轻,癫痫受到一定程度抑制。由此提示,H2S可能通过激活Nrf2-ARE通路,上调Nrf2蛋白的表达及SOD的活性,降低氧化应激,发挥抗癫痫作用。
在杏仁核点燃癫痫模型中,Nrf2基因敲除小鼠的癫痫发作和认知障碍显著加剧,且SFN预处理的保护作用被消除[23]。据此,为进一步研究H2S抗癫痫的具体作用机制,我们在H2S干预的基础上,同时给予鸦胆子苦醇预处理以下调Nrf2蛋白表达,结果发现,与H2S+EP组相比,H2S+ Brusatol +EP组大鼠行为学、脑电检测显示其癫痫发作程度加重,海马组织Nrf2蛋白质表达及SOD活性水平显著降低,且与EP组相比无显著性差异。该实验结果说明同时给予H2S和Nrf2抑制剂后,H2S预处理的保护作用被削弱,进一步证实H2S可能是通过上调Nrf2蛋白的表达、提高SOD的活性而起到抑制癫痫的作用。
综上所述,H2S可以抑制癫痫发作,其作用机制可能与上调Nrf2蛋白的表达,提高SOD的活性,降低氧化应激有关。但H2S通过上调Nrf2蛋白抑制癫痫的具体保护机制仍有待进一步研究。

