环状RNA与氧化应激互作机制的研究进展
赵久红,童佳婷,沈郅珺,吕叶辉
上海健康医学院基础医学院,上海 201318
环状RNA(circular RNA,circRNA)是一类共价闭环非编码RNA,是由mRNA 前体通过特殊的可变剪切连接而成的内源性RNA[1]。circRNA 在哺乳动物细胞中广泛表达, 可通过充当微RNA(miRNA)海绵、与RNA 结合蛋白相互作用、调节mRNA 稳定性、作为竞争性内源RNA(competing endogenous RNA,ceRNA)等机制在多个水平参与基因调控,广泛参与缺血、缺氧、损伤修复、肿瘤发生等多种病理生理过程[1-3]。氧化应激是指机体在衰老或者遭受有害刺激时,机体内活性氧(reactive oxygen species,ROS)的产生与清除(抗氧化)失衡的状态,进而导致损伤,与多种疾病的发生、发展密切相关。随着研究深入,已有证据表明多种circRNA 在氧化应激状态下表达异常。分析circRNA 的表达改变及其对氧化应激相关分子指标的作用机制具有重要意义,不仅有助于揭示发病机制,也可为相关疾病的防治提供理论基础。本文在梳理现有研究的基础上,以器官系统疾病为主线,就氧化应激过程中的circRNA 的表达变化及调控作用机制做一综述。
1 氧化应激概述
氧化应激即体内ROS 的产生与ROS 清除失衡的一种状态。ROS 是生物体有氧代谢过程中的正常副产物,在机体内被不断地产生,包括超氧阴离子、羟基自由基、氧自由基衍生的单线态氧、过氧化氢(H2O2)、过氧亚硝酸盐、一氧化氮(NO)等,并通过信号转导和表达调控参与各项生命过程[4]。生理状态下,代谢产生的ROS 能被体内抗氧化系统清除,而ROS 和抗氧化系统之间的良好平衡对于细胞的正常功能至关重要[5]。在机体衰老或病理状态下,都有可能导致ROS 产生和清除失衡,导致各类分子受到氧化损伤,如DNA 断裂、蛋白质变性和脂质过氧化等,细胞表现为衰老、凋亡或坏死[6]。上述氧化应激改变可出现在中枢神经系统,如阿尔茨海默病和帕金森病[7-8];也可出现在心血管系统疾病,如氧自由基攻击心肌细胞和动脉粥样硬化等[9-10];也有研究表明氧化应激在肾脏损伤、肺损伤等疾病的发生、 发展过程中发挥着重要作用[11-12]。
氧化应激标志物是指能反映机体内氧化应激水平的一系列生化分子。在氧化应激过程中,清除氧化产物的蛋白酶减少,大量氧化中间产物蓄积,从而导致分子、细胞和机体的一系列损伤。而目前常用的氧化应激标志物也是从蛋白酶、中间产物及损伤产物3 个层面进行选取,详见表1。氧化应激发生时,超氧化物歧化酶(superoxide dismutase,SOD)表达下降,活性降低,产生过多的脂质过氧化产物丙二醛(malondialdehyde,MDA);谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px) 也是体内重要的过氧化物分解酶,可使MDA 还原,从而保护细胞免受氧化损伤;因此SOD、MDA 和GSH-Px 常被作为判断氧化应激程度的指标[13-14]。过量表达的诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS) 是NO 异常增多的主要原因,过氧化氢酶(catalase,CAT)也是重要的H2O2清除酶,这些酶亦可用来评估氧化应激状态。氧化应激本就表现为ROS 升高,所以ROS 本身也是氧化应激标志物。在机体处于氧化应激状态下,增多的ROS 可使体内的生物大分子等出现不同程度的氧化:谷胱甘肽大量转化成氧化型谷胱甘肽(oxidized glutathione, GSSG); 3- 硝基酪氨酸(3-nitrotyrosine,3-NT)为蛋白硝基化终产物,能不断积累活性氮和活性氧,影响细胞内线粒体生物功 能 ; 8- 羟 基 脱 氧 鸟 苷 (8-hydroxy-2-deoxyguanosine,8-OHdG)是ROS 攻击DNA 分子中鸟嘌呤碱基的第8 位碳原子形成的氧化加合物;故而GSSG、3-NT 和8-OHdG 也可作为氧化应激标志物。此外,亦有研究表明铁、汞等金属处理可造成机体内的氧化与抗氧化的不平衡,也有学者推荐将微量金属元素作为标志物来检测机体的氧化应激状态[15]。
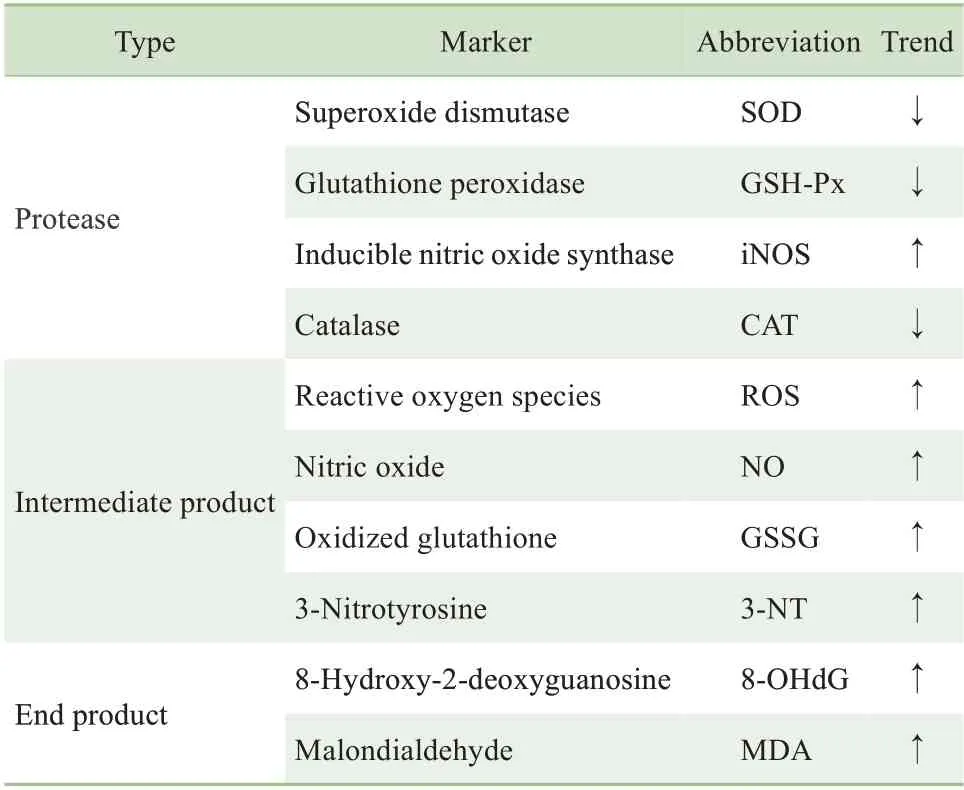
表1 研究常用的氧化应激标志物Tab 1 Commonly used oxidative stress markers in present studies
标志物含量的变化既可以明确氧化应激状态,也是分析疾病发生、发展与氧化应激相关性的前提,无论是蛋白酶、中间产物,还是终产物,相关的表达调控主要在3 个水平上进行,即miRNA-mRNA-蛋白质作用网络。circRNA 作为近年来生物医学领域的热点分子,其转录或转录后的调控作用主要表现为以下几点[16-18]:转录时与mRNA 前体发生剪接竞争,起到ceRNA 作用;充当miRNA 海绵,与mRNA 竞争miRNA 位点;少数circRNA 包含核糖体进入位点,具有翻译能力;在翻译后水平与蛋白结合,调节蛋白的活性。鉴于上述调控机制和相关研究基础,circRNA 可能是氧化应激过程中的关键分子,对于氧化应激标志物的表达调控和下游改变具有重要作用。在氧化应激状态下特异性表达的circRNA,可通过多种机制进行调控,特别是通过miRNA 影响下游基因表达,参与氧化应激造成的损伤,亦可上调相关抗氧化因子,降低氧化应激的影响。根据在氧化应激过程中不同的调控作用(促进或抑制),本文将相关circRNA 大致分为促氧化应激损伤和抗氧化应激损伤2类。
2 circRNA 在心血管疾病氧化应激中的作用
心血管疾病在世界范围内都有着极高的发病率和死亡率,越来越多的证据表明氧化应激参与了多种心血管疾病的发生、发展。已有研究表明circRNA 是高血压、心肌梗死、动脉粥样硬化等心血管疾病中的重要调控因子,而且与氧化应激损伤有关[9]。系列研究表明差异性表达的circRNA 可通过多种作用机制对氧化应激诱发的炎症反应或细胞损伤发挥调控作用,详见表2。
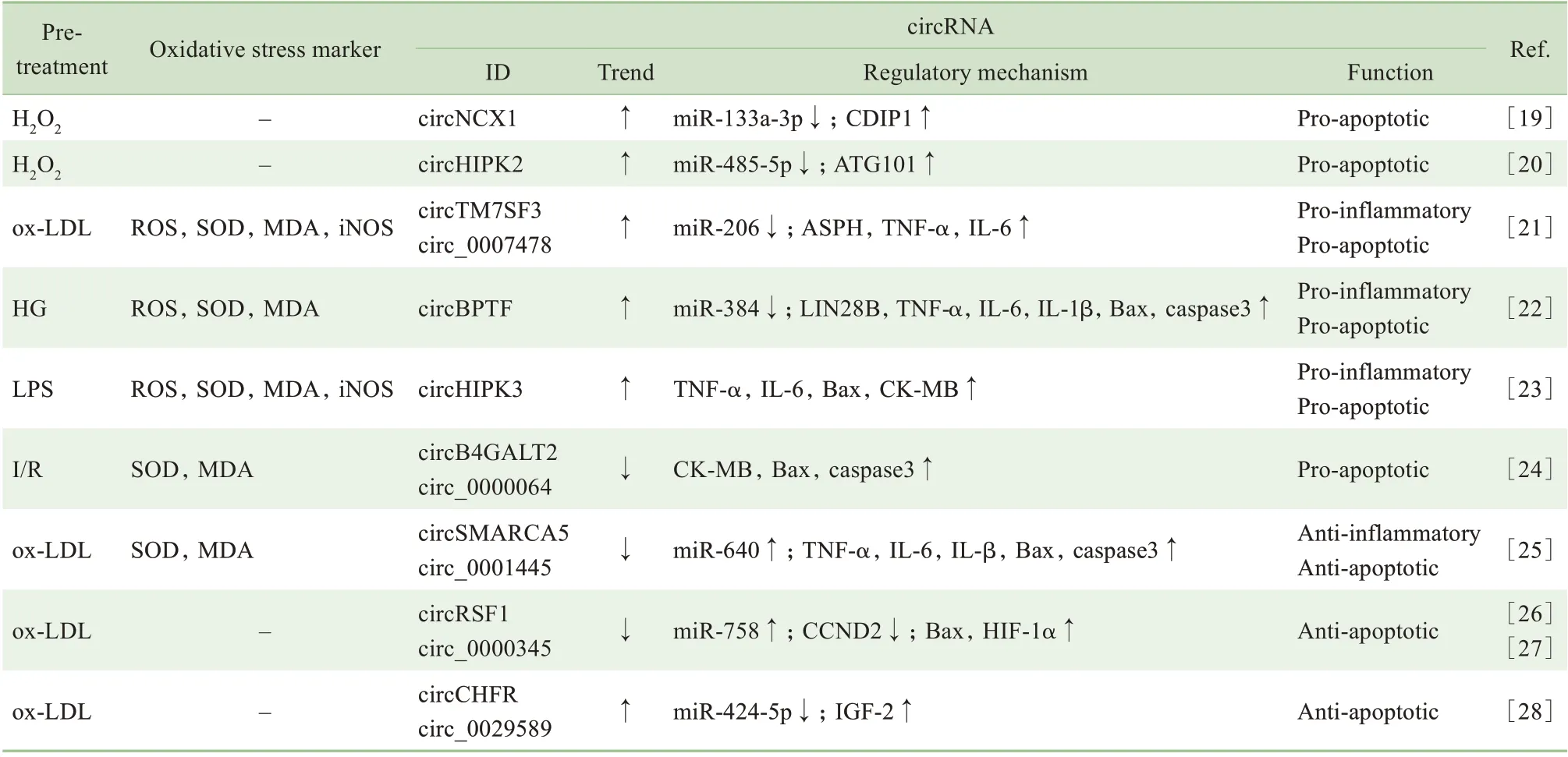
表2 circRNA在心血管疾病氧化应激中的表达调控机制Tab 2 Regulatory mechanism of circRNA expression under oxidative stress in cardiovascular diseases
2.1 促氧化应激circRNA
H2O2或缺血再灌注损伤(ischemia/reperfution,Ⅰ/R)处理的心肌细胞可诱导circNCX1 高表达,miR-133a-3p 与circNCX1 竞争性结合,以致前者对促凋亡因子细胞死亡诱导蛋白(cell death-inducing p53 target protein 1,CDⅠP1)的翻译抑制作用丧失,最终导致心肌细胞死亡[19]。circHⅠPK2 在H2O2处理新生小鼠心肌细胞中表达上调,并通过miR-485-5p/ATG101 通路促进自噬,加速氧化应激中的细胞凋亡和死亡[20]。在氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL) 诱导的细胞模型中,hsa_circ_0007478 (circTM7SF3) 通过miR-206 的介导上调天冬酰胺β 羟化酶(aspartyl β-hydroxylase,ASPH)、TNF-α、ⅠL-6 表达,起到促炎、促凋亡的作用[21]。在高葡萄糖(high glucose,HG)或脂多糖(lipopolysaccharide,LPS)处理的氧化应激细胞模型中,高表达的circBPTF 和circHⅠPK3 可通过上调TNF-α、ⅠL-6、Bax、caspase3、CK-MB 等起到促炎、促凋亡的作用[22-23]。在LPS 诱导的心肌炎小鼠模型中,敲除circHⅠPK3 可有效降低ROS、MDA 等氧化应激标志物的含量,抑制心肌细胞凋亡,减轻心肌组织损伤[23]。
2.2 抗氧化应激circRNA
2.2.1 氧化应激条件下表达下调 Ⅰ/R 后心肌细胞内hsa_circ_0000064(circB4GALT2) 表达降低,上调的CK-MB、Bax和caspase3参与氧化应激状态下的细胞损伤;如损伤前采用红景天苷预处理,细胞内的hsa_circ_0000064 显著上调,上述凋亡相关蛋白表达下降,减轻氧化应激对心肌细胞的损伤[24]。在ox-LDL 诱导的细胞模型中, hsa_circ_0001445(circSMARCA5)和hsa_circ_0000345(circRSF1)的表达显著下调:前者与miR-640 的介导有关,下调后引起TNF-α、ⅠL-6、ⅠL-β、Bax 和caspase3 等炎症因子及凋亡相关蛋白的上调;后者与细胞周期素D2(cyclin D2,CCND2)竞争性结合miR-758,下调后CCND2 表达下降,Bax 和HⅠF-1α 的表达升高;两者的低表达均起到促炎、促凋亡的作用。值得注意的是,将过表达的circSMARCA5或circRSF15的质粒转染到细胞后,再行氧化应激时,高水平的circRNA 可通过下调相关炎症因子及凋亡相关蛋白的表达,起到抗氧化应激的作用[25-27]。
2.2.2 氧化应激条件下表达上调 在ox-LDL 诱导的血管平滑肌细胞中,circ_0029589(circCHFR)表达上调,通过miRNA 海绵吸附miR-424-5p 使胰岛素样生长因子2 (insulin-like growth factor 2,ⅠGF2)表达增加,减少细胞凋亡,起到抗氧化应激的作用;沉默circ_0029589 或过表达miR-424-5p,可使细胞在氧化应激时增殖下降且凋亡增加[28]。该研究也提示机体在氧化应激下,会通过高表达部分circRNA 来应对过氧化状态、减轻损伤,这是一种自我保护机制。
3 circRNA 在神经系统疾病及肺部疾病氧化应激中的作用
在神经系统疾病,特别是神经退行性病变中,ROS增多、脂质过氧化、细胞色素C释放等因素是氧化应激损伤的重要机制,可导致神经元凋亡或死亡的发生,是病变的重要基础[7]。肺也是氧化应激暴露的常见受累器官,特别是在慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD) 中,氧化应激是重要的致病机制[12,29]。随着研究深入,已有证据表明circRNA 可能是连接氧化应激与神经系统疾病或肺部疾病之间的关键环节[30-31],详见表3。
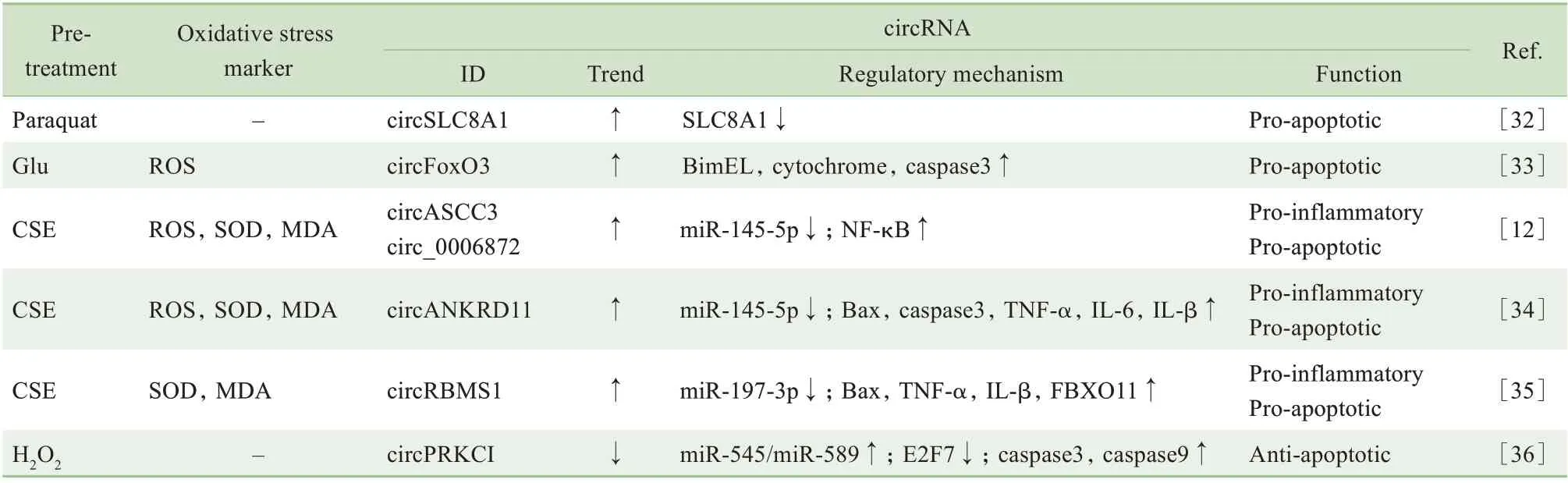
表3 circRNA在神经系统及肺疾病氧化应激中的表达调控机制Tab 3 Regulatory mechanism of circRNA expression under oxidative stress in neurological disorders and lung diseases
3.1 促氧化应激circRNA
百草枯处理神经母细胞瘤细胞系制作氧化应激模型,发现circSLC8A1 显著升高,与线性mRNA 竞争导致SLC8A1表达下调;circSLC8A1 还具有miR-128和Ago2 蛋白结合位点,使miR-128 的靶基因表达上调,参与氧化应激所致的帕金森病[32]。在谷氨酸诱导的HT22 细胞(小鼠海马神经元细胞系)氧化应激模型中,circFoxO3 表达升高,介导凋亡相关蛋白BimEL、cytochrome 及caspase 上调,从而减弱细胞活力、促进细胞凋亡;敲除circFoxO3 后BimEL 下调,间接抑制HT22 细胞的线粒体凋亡,减轻氧化应激损伤[33]。
香烟烟雾被公认为COPD 的危险因素,香烟烟雾所致的氧化应激在COPD 中也至关重要。有3 个不同的实验组借助香烟烟雾提取物(cigarette smoke extract,CSE)诱导细胞氧化应激,并检测出多种circRNA 异常升高,这些指标可能是阻断氧化应激的潜在靶点。XUE 等[12]发现发生氧化应激条件下,hsa_circ_0006872 (circASCC3) 通过miR-145-5p/NF-κB 途径,促进CSE 诱导的人肺微血管内皮细胞内ROS、SOD 和MDA 增多,促炎、促凋亡。WANG 等[34]发现circANKRD11 可与miR-145-5p 结合,导致Bax、caspase3、TNF-α 等炎症因子及凋亡相关蛋白的表达增加,沉默circANKRD11 可明显改善CSE 诱导氧化应激所致的炎症及凋亡情况。QⅠAO 等[35]发现在CSE 处理的人支气管上皮样细胞中,circRBMS1 在氧化应激状态下表达上调,敲除circRBMS1 后可降低炎症水平、减少细胞凋亡。
3.2 抗氧化应激circRNA
研究发现在H2O2诱导的神经元氧化应激模型中,circPRKCⅠ表达下调,通过circPRKCⅠ-miR-545/589-E2F7轴,上调凋亡相关蛋白caspase3和caspase9的表达,而过表达circPRKCⅠ可显著减轻氧化应激损伤,减少细胞凋亡[36]。
4 circRNA在肾疾病氧化应激中的作用
氧化应激是急性肾损伤(acute kidney injury,AKⅠ)和糖尿病肾病(diabetic nephropathy,DN)的发病机制之一,circRNA 在其中也发挥着重要作用,见表4。
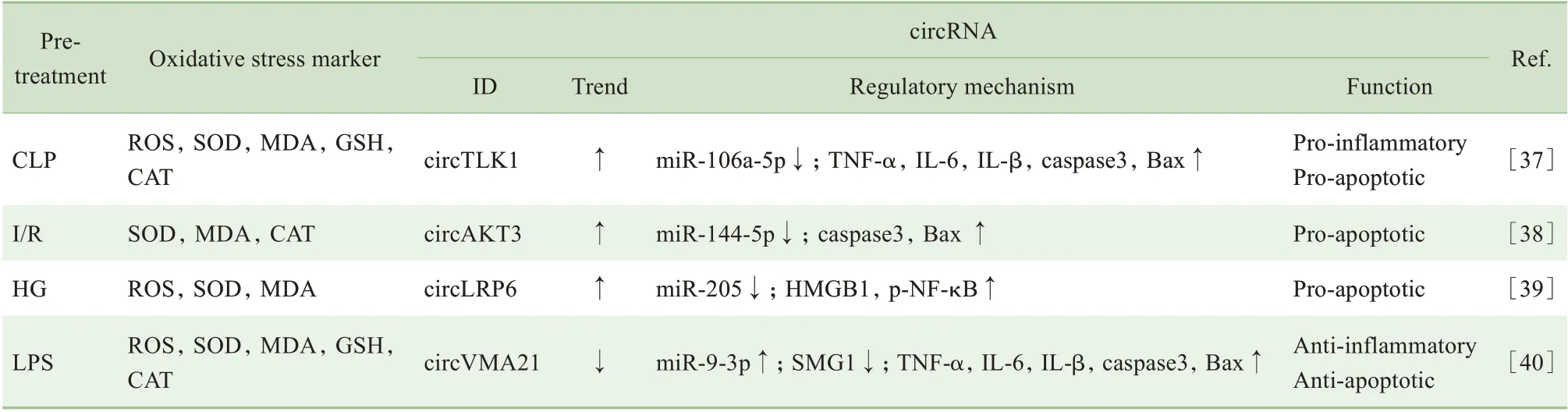
表4 circRNA在肾疾病氧化应激中的表达调控机制Tab 4 Regulatory mechanism of circRNA expression under oxidative stress in kidney diseases
4.1 促氧化应激circRNA
在盲肠结扎穿刺(cecum ligation and puncture,CLP)制作的脓毒症相关性AKⅠ模型中,circTLK1的表达升高,通过miR-106a-5p 轴加剧炎症、凋亡等氧化应激损伤[37]。在肾Ⅰ/R 损伤模型中,高表达的circAKT3 通过miRNA 海绵作用下调miR-144-5p 的表达,致使Bax 及caspase3 上调,介导了氧化应激过程[38]。在HG诱导的氧化应激细胞模型中,circLRP6显著上调并吸附miR-205,使高迁移率族蛋白1(high mobility group protein 1,HMGB1)表达上调,HMGB1 具有促炎作用,可加剧氧化应激所致的细胞损伤,也是DN病情进展的独立危险因素[39]。
4.2 抗氧化应激circRNA
SHⅠ等[40]的实验表明,在LPS 诱导肾细胞模型中,circVMA21 表达下调,通过miR-9-3p/SMG1/炎症因子轴介导氧化应激过程,过表达circVMA21 则可降低炎症水平、减少细胞凋亡。
当然,circRNA 参与和介导的氧化应激不只局限于上述器官系统疾病中。LⅠ等[41]在HG 诱导的人视网膜上皮细胞中,发现高表达的circRNA_0084043 参与氧化应激过程,导致细胞活力下降和凋亡增加,下调其表达则可减轻氧化应激损伤。YANG 等[42]从circRNA 的角度研究了氧化应激在骨关节炎中的发病机制,揭示了circRSU1/miR-93-5p/MAP3K8轴,通过MEK/ERK1/2和NF-κB途径促进骨关节炎的发生。
5 circRNA 与氧化应激相互作用机制分析与探讨
5.1 氧化应激状态导致circRNA表达改变
多项研究已经证实氧化应激状态下多种circRNA出现明显的上调或下调,虽然氧化应激介导circRNA形成和变化的机制尚未完全明确,但有报道表明氧化应激可通过影响转录过程的顺式作用元件[43]、促进反式作用因子的核转移[44]、改变剪接体的功能[45],进而对基因表达进行调控,而上述机制都在circRNA的形成过程中发挥重要作用。当然,氧化应激状态下circRNA 的差异性表达很可能是一个复杂的多通路机制,还有待进一步深入。
5.2 circRNA调控氧化应激进程
circRNA 可通过多种机制,在转录或转录后水平调控氧化应激的进程。已有多项研究[12,19-24,35-38]表明circRNA 主要通过miRNA 的介导调控相关炎症因子及凋亡基因的表达,影响炎症水平及细胞凋亡、死亡进程,发挥促或抗氧化应激损伤的作用。也有研究[22-24,32-33]显示circRNA 直接或间接调控抗氧化基因的表达,改变氧化应激进程。以核因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,NRF2)和Kelch 样环氧氯丙烷相关蛋白1 (Kelch-like ECHassociated protein 1,KEAP1)为例,KEAP1/NRF2信号通路在调控抗氧化基因的表达中发挥重要作用,circKEAP1与miR-141-3p结合可激活KEAP1/NRF2信号通路,减轻氧化应激损伤[46],circTCONS_l2_00004572则可下调NRF2的表达,导致ROS增加,加剧氧化应激损伤[47]。
6 结语与展望
氧化应激可导致circRNA 表达变化,circRNA 也可调控氧化应激状态,两者相互作用和影响,参与多种疾病的发生、发展。氧化应激条件下表达变化的circRNA 大致可分为促氧化应激和抗氧化应激2 类:前者多在氧化应激时表达上调,介导炎症因子及凋亡蛋白表达增多,加剧氧化应激损伤,下调此类circRNA 可减轻氧化应激损伤;后者多在氧化应激时表达下调,过表达此类circRNA 可降低炎症水平、减少细胞凋亡,起到抗氧化应激损伤的作用。本文综述了各系统疾病中circRNA 与氧化应激的相互作用,分析了circRNA 在促氧化应激和抗氧化应激中的具体作用机制,希望能为进一步研究提供参考。

