ATIC对乳腺癌细胞MB231迁移和增殖能力的影响*
盛玉程, 舒 扬△, 向 敏, 孙 文, 王德钱,黄文康, 许亚晨, 葛彦锋, 宗明慧, 庄秀芬
江苏大学附属医院 1中心实验室 2检验科 3肿瘤科,镇江 212001
乳腺癌是除肺癌外全球癌症发病率最高的肿瘤[1],同时乳腺癌也是中国女性最常见的癌症之一[2]。近年来,对于乳腺癌的治疗出现了创新疗法,虽然在一定的范围内取得不同程度的治疗效果[3],但乳腺癌的易转移性仍是导致其死亡率不断上升的关键因素[4]。目前,由于晚期乳腺癌患者肿瘤已经发生转移,只能采取姑息治疗,极大缩短了乳腺癌患者的生存期[5]。因此,早期诊断乳腺癌以及探讨乳腺癌发生发展的相关机制,并寻找其生物标志物成为当前研究的重中之重。
5-氨基咪唑-4-羧酰胺核糖核苷酸甲酰基转移酶(ATIC)是一种新的嘌呤生物合成途径中的限速酶,催化嘌呤合成路径的最后2个反应[6-7]。近年来,随着研究的深入,ATIC被发现在多种肿瘤中通过调控细胞的增殖和转移等方面影响肿瘤的发生发展。已有文献表明,ATIC表达异常导致肝癌细胞增殖和迁移的显著改变,同时ATIC异常表达与肝癌患者的预后情况密切相关[8]。Li等[9]通过组织微阵列和基因微阵列技术发现,多发性骨髓瘤中ATIC的mRNA水平和蛋白水平均显著升高,并揭示ATIC的异常改变可能与多发性骨髓瘤的发生发展密切相关。目前,ATIC在乳腺癌中的表达情况和作用机制尚不清楚,因此本研究拟通过临床样本和细胞实验研究ATIC在乳腺癌细胞中的生物学作用。
本研究检测了ATIC在乳腺癌肿瘤标本和细胞系中的表达情况;运用细胞生物学功能实验探讨了ATIC对乳腺癌细胞MB231的增殖和迁移的影响;通过检测间质上皮化生(EMT)和增殖的关键标志物揭示了ATIC与EMT以及增殖指标的相关性。本文探讨了ATIC在乳腺癌中的生物学作用,为乳腺癌的临床检测提供新的生物分子标志物,为其治疗提供新的药物靶点。
1 材料与方法
1.1 实验材料
1.1.1 细胞和试剂 人乳腺癌细胞MB231、MCF7、T47D,正常乳腺导管细胞MCF10A均购自中国科学院上海细胞库;DMEM高糖培养液、RPMI-1640培养液和MEBM培养液以及青霉素、链霉素购于Gibco公司;胎牛血清、EDU增殖试剂盒和RIPA蛋白裂解液购于上海生工生物工程公司。胰酶由上海奕杉生物科技有限公司提供;Trizol RNA提取试剂盒由TaKaRa公司提供;逆转录试剂、PCR试剂、CCK-8增殖试剂盒、BCA蛋白定量试剂盒由南京诺唯赞生物科技有限公司提供;ATIC干扰慢病毒及感染试剂、嘌呤霉素购于上海合生生物科技有限公司;蛋白电泳胶由北京索莱宝科技有限公司提供;ATIC抗体购于Santa公司;E-cadherin、Vimentin以及PCNA抗体购于CST公司;GAPDH、鼠二抗和兔二抗由BBI公司提供。
1.1.2 组织标本来源 收集江苏大学附属医院2020年1月到2020年12月收治的9例乳腺癌患者行外科手术切除的乳腺癌组织和癌旁组织标本。纳入标准:①确诊为乳腺癌患者,且不存在其他部位的肿瘤;②在手术前未进行放、化疗和其他治疗。排除标准:①术前接受放、化疗者;②病理组织标本不合格者;③临床资料和随访资料不完整者。患者手术后,立即将乳腺癌组织和癌旁组织分类、标记,储存于-80 ℃冰箱中。本研究得到本院伦理委员会的批准,并且和所有患者签署了知情同意书。
1.1.3 细胞培养方法 乳腺癌细胞MB231、MCF7培养于含10%胎牛血清的DMEM高糖培养液(含1%青霉素和链霉素),T47D细胞用含10%胎牛血清的1640培养液(含1%青霉素和链霉素)培养,MCF10A细胞用含10%胎牛血清的MEBM培养液(含1%青霉素和链霉素)培养,置于37 ℃ 5% CO2培养箱中培养,取对数生长期的细胞用于实验。
1.1.4 构建ATIC敲低的乳腺癌细胞MB231 将处于对数生长期的MB231细胞用胰酶消化后,700 r/min离心重悬,以(3~5)×103/孔接种于6孔板中,于37 ℃ 5% CO2培养箱中培养至细胞汇合度达到约20%时,按照感染指数(MOI)为10加入ATIC干扰和对照慢病毒,分为对照组(sh-NC)和ATIC干扰组(sh-ATIC),然后放于培养箱中培养,12 h后更换新鲜培养液,继续培养,经过一段时间的培养待其汇合度达到80%时,用10 mg/mL的嘌呤霉素,2 μL/孔连续处理3 d进行筛选。通过实时荧光定量PCR和Western blot检测慢病毒感染后ATIC的表达量。
1.2 实验方法
1.2.1 实时荧光定量PCR反应(qRT-PCR) 向适量组织和细胞中加入1 mL RNA iso plus充分裂解,室温孵育5 min,然后加入0.2 mL氯仿,大力摇晃15 s,室温孵育2 min,12000×g 4 ℃离心15 min,取0.4 mL上层液体,加入0.5 mL异丙醇,室温孵育10 min,12000×g 4 ℃离心10 min,取凝胶样沉淀,用1 mL 75%的乙醇洗涤沉淀,7500×g 4 ℃离心5 min,弃液体晾干沉淀,向沉淀中加入20 μL无RNA酶水使其充分溶解。总RNA浓度在分光光度计下测定。对总RNA进行逆转录得到cDNA,然后进行实时荧光定量PCR反应,引物由上海生工生物技术有限公司提供。ATIC上游引物:5′-CACGCTCGAGTGACAGTG-3′;下游引物:5′-TCGGAGCTCTGCATCTCCG-3′。GAPDH上游引物:5′-ACCCAGAAGACTGTGGATGG-3′;下游引物:5′-TTCAGCTCAGGGATGACCTT-3′。以GAPDH为内参,按照PCR检测试剂盒的说明书进行扩增,条件如下:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,共40个循环。结果分析采用2-ΔΔCt法进行基因表达的相对定量。
1.2.2 Western blot实验 将研磨的组织和细胞在RIPA缓冲液中裂解,并使用BCA试剂盒测定蛋白浓度后上样(40 μg),通过SDS-PAGE电泳保持电压80 V分离蛋白质样本,湿转法350 mA转膜120 min将蛋白质转移到PVDF膜上,用5%的脱脂牛奶室温封闭1 h,根据目的蛋白的分子量切取条带孵育一抗ATIC(1∶1000)与GAPDH(1∶3000)4 ℃过夜。次日用1×TBST洗膜3次×10 min,然后用羊抗鼠二抗(1∶5000)室温孵育1 h,1×TBST洗膜5次×5 min,ECL显影曝光。采用Image J软件对蛋白条带进行灰度值分析,以目的蛋白的灰度值与内参蛋白的灰度值比值表示目的蛋白的相对表达量。
1.2.3 CCK-8细胞增殖实验 取适量对数生长期的细胞制成细胞悬液,以每组细胞2×103个/孔,100 μL加样体积接种于96孔板中,每个时间点设置5个复孔,设置0、24、48、72 h时间点。然后加入10 μL/孔CCK-8试剂,置于37 ℃ 5% CO2培养箱中孵育2 h,用酶标仪于450 nm波长处测定每孔细胞的吸光度(A)值,绘制细胞的增殖曲线,横坐标为时间点(h),纵坐标为A值。
1.2.4 EDU细胞增殖检测实验 按照EDU细胞增殖检测试剂盒说明书操作步骤进行细胞增殖检测,染色后通过40倍荧光显微镜拍照,并进行统计学分析。
1.2.5 平板克隆实验 取每组细胞以1×103个/孔接种于培养皿中,37 ℃ 5% CO2培养箱中培养7 d,取出弃去培养液,加入新鲜的4%多聚甲醛固定30 min,0.1%结晶紫溶液室温染色15 min,在光学显微镜下(×400)计数克隆数大于50的细胞团。
1.2.6 Transwell迁移实验 取对数生长期的细胞,离心后用不含血清的培养液重悬制成单细胞悬液,计数板计数,在小室的上室中加入5×104个细胞,在下室中加入含10%血清的培养液,置于37 ℃ 5% CO2培养箱中培养24 h后取出,用棉签轻轻擦拭掉上室中未穿过的细胞,0.1%结晶紫溶液室温染色15 min,PBS溶液清洗干净后置于40倍正置显微镜下随机收集5个视野图片,记录穿膜细胞数并进行统计分析。
1.2.7 划痕愈合实验 取适量对数生长期的细胞接种于6孔板中,至细胞汇合度达到80%时用200 μL的枪头在细胞表面划痕,PBS清洗掉落的细胞,加入新鲜的含10%血清的培养液,在光学显微镜下收集0、24 h的划痕图片,并计算细胞的划痕愈合距离。划痕愈合距离=0 h划痕宽度-24 h划痕宽度。
1.3 统计学方法
本文采用GraphPad Prism 8.0软件绘图,并进行统计分析。每一项实验至少独立重复进行3次及以上。两组间均数比较采用t检验分析,多组间均数比较采用单因素方差分析。CCK-8实验结果采用两因素多元方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 ATIC在乳腺癌组织中的表达
从江苏大学附属医院随机收集的9例乳腺癌组织标本以及对应的癌旁组织标本中,ATIC在乳腺癌组织中的mRNA表达量明显高于癌旁组织(P<0.05)(图1A)。同时,Western blot检测显示ATIC蛋白表达量在乳腺癌组织中显著高于对应的癌旁组织(图1B)。

A:ATIC的mRNA表达情况,n=9,*P<0.05;B:ATIC的蛋白表达量,N:癌旁组织,C:癌组织图1 ATIC在乳腺癌组织和癌旁组织中的表达情况Fig.1 The expression level of ATIC in breast cancer and adjacent normal tissues
2.2 ATIC在不同乳腺癌细胞系中的表达情况及sh-ATIC-MB231细胞株的构建
在MB231和T47D细胞中,ATIC的蛋白和mRNA表达量均高于MCF10A(图2A、2B)。利用shATIC慢病毒感染MB231细胞,Western blot检测发现ATIC蛋白表达量在sh-ATIC组明显低于sh-NC组(P<0.01)(图2C、2D),qPCR结果与Western blot结果一致。
以上实验均提示sh-ATIC-MB231细胞株构建成功。

A、B:ATIC在不同乳腺癌细胞系和正常乳腺细胞中表达情况;C、D:ATIC干扰效果验证;**P<0.01图2 ATIC在乳腺癌细胞系中表达情况及干扰效果验证Fig.2 The expression level of ATIC in breast cancer cells and the effect of ATIC silencing
2.3 ATIC对MB231细胞增殖能力的影响
CCK-8结果显示sh-ATIC组MB231细胞的增殖能力明显低于sh-NC对照组,差异有统计学意义(P<0.01,图3A);平板克隆实验显示MB231细胞克隆数在sh-ATIC组与sh-NC组间比较具有显著性差异(P<0.01,图3B、3C);EDU增殖实验显示sh-ATIC组MB231细胞的增殖数明显少于sh-NC对照组(P<0.01,图3D、3E)。

A:CCK-8实验检测细胞的增殖情况;B:平板克隆实验检测细胞增殖能力;C:平板克隆结果统计图;D:EDU增殖实验检测细胞增殖能力;E:EDU增殖统计图;**P<0.01图3 ATIC对MB231细胞增殖能力的影响Fig.3 The effect of ATIC on the cell proliferation of MB231 cells
2.4 ATIC对MB231细胞迁移能力的影响
Transwell实验中,细胞培养24 h后,sh-ATIC组MB231细胞的迁移数明显少于sh-NC对照组,差异具有统计学意义(图4A、4B)。同时,划痕实验结果和Transwell实验结果一致,两组差异具有统计学意义(图4C、4D)。
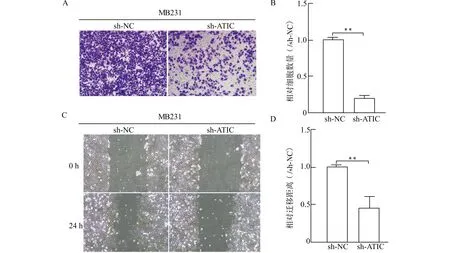
A:Transwell实验结果显示,接种24 h后,sh-ATIC组的细胞穿膜数量明显少于sh-NC组;B:Transwell实验统计图;C:划痕实验结果显示,培养24 h后,sh-ATIC组迁移能力弱于sh-NC组;D:划痕实验统计图;**P<0.01图4 ATIC对MB231细胞迁移能力的影响Fig.4 The effect of ATIC on the migration of MB231 cells
2.5 ATIC对E-cadherin、Vimentin和PCNA蛋白水平的影响
与sh-NC对照组比较,E-cadherin在sh-ATIC组中表达量上调,Vimentin和PCNA在sh-ATIC组中的表达量下调(图5)。以上结果显示,ATIC可能影响乳腺癌MB231细胞的EMT和增殖过程。

A:Western blot检测sh-NC组和sh-ATIC组相关蛋白表达量,sh-ATIC组E-cadherin表达量升高,Vimentin表达量降低,PCNA表达量降低;B:蛋白电泳结果统计图;*P<0.05,**P<0.01图5 ATIC对E-cadherin,Vimentin和PCNA蛋白表达影响Fig.5 The protein expression of E-cadherin,Vimentin and PCNA after ATIC silencing
3 讨论
乳腺癌是常见的恶性肿瘤之一[4],同时也是重要的女性死亡病因之一。随着现代医疗水平的进步,乳腺癌的早期诊断和治疗得到了长足的发展,但是乳腺癌发病年龄呈现年轻化迹象,年轻女性患较高临床病理分期乳腺肿瘤的发生率不断上升,治疗也更加棘手[10]。因此探究乳腺癌发生发展(特别是恶性程度较高的转移性乳腺癌)的分子机制迫在眉睫。本文初步探讨了ATIC在乳腺癌中的表达以及相关分子机制,以期为乳腺癌的治疗提供新的分子标志物和临床治疗靶点。
ATIC主要功能为催化嘌呤的生物合成,参与核苷酸的合成与代谢[11],因此对ATIC在生物代谢异常中作用的研究较多。肿瘤细胞的特性为无限增殖,物质代谢紊乱,核苷酸代谢异常,ATIC作为调控核苷酸的关键因子成为人们研究的焦点。最近的研究表明,ATIC在肿瘤中表达异常,与肿瘤的预后和复发密切相关[8]。ATIC在肝癌里表达明显升高,且ATIC的表达水平与癌症患者的预后不良密切相关。Cai等[12]发现,通过降低ATIC基因启动子区域的H3K18Ac和H3K27Ac水平可降低肝癌细胞的糖酵解功能和核苷酸合成,以此达到对肝癌细胞的抑制作用。ATIC在细胞代谢和自噬中的异常可能与卵巢癌的发生发展相关[13]。Zhu等[14]发现,肺癌患者体内ATIC表达量异常增高并且ATIC高表达提示患者预后不良[15]。除了调控实体肿瘤,ATIC还与血液系统肿瘤密切相关。在多发性骨髓瘤[9],淋巴瘤[16]和急性白血病[17]中,研究发现ATIC基因表达失调在上述疾病的发生发展中起重要作用并影响着患者的预后。ATIC在乳腺癌中的表达情况和作用机制并不清楚,本文初步探究ATIC在乳腺癌中的表达情况并探讨相关的作用机制。
上皮间充质转化(EMT)是指上皮细胞的表型转化为间充质细胞,主要与癌细胞的转移密切相关。通过EMT,上皮细胞失去极性,获得较高的迁移与侵袭的能力。在肿瘤的恶性演变过程中,EMT使得肿瘤细胞得以转移到远处部位。而上皮间充质转化在蛋白水平主要表现为E-cadherin下调,N-cadherin、Vimentin和Snail表达上调[18-19]。本研究中我们主要探究ATIC与E-cadherin和Vimentin之间的关系来判断ATIC是否与肿瘤迁移能力密切相关。而PCNA作为DNA复制的重要参与者,代表着细胞的增殖活性,用于表示肿瘤细胞的增殖能力[20-21]。本研究中我们主要探究ATIC与PCNA之间的关系来判断ATIC是否与细胞增殖密切相关。
本研究证实ATIC在乳腺癌组织和相关的乳腺癌细胞中高表达;通过嘌呤霉素筛选得到sh-ATIC-MB231稳定转染细胞株,经过qPCR和Western blot检测,发现sh-ATIC组的ATIC mRNA和蛋白表达量均低于sh-NC对照组,提示sh-ATIC-MB231慢病毒细胞模型构建成功;通过CCK-8细胞增殖实验等证实sh-ATIC组较sh-NC对照组细胞的增殖能力减弱;细胞划痕实验等结果表明sh-ATIC组细胞的迁移能力明显弱于sh-NC对照组;Western blot实验表明乳腺癌细胞的E-cadherin蛋白表达量在sh-ATIC组高于sh-NC对照组,而Vimentin蛋白的表达量降低,提示下调ATIC可以逆转EMT;PCNA蛋白在sh-ATIC组中表达量下调,提示下调ATIC后乳腺癌细胞的增殖能力降低。
综上所述,ATIC在乳腺癌中的高表达以及对乳腺癌细胞MB231功能的调控,提示ATIC可能作为乳腺癌早期诊断的新分子标志物,并为乳腺癌的临床治疗提供新靶点。

