二乙酰吗啡干预下大鼠心肌细胞蛋白质组学差异性研究
王维娜,刘 丽,苏丽萍,季 敏,蒲红伟
(新疆医科大学1附属肿瘤医院病理科,2基础医学院,3第一附属医院病理科,4第一附属医院学科建设科,乌鲁木齐830011)
二乙酰吗啡属于阿片类毒品,由于机体对其成瘾快且依赖性强,其可对机体多器官系统造成严重危害[1-2]。其中,对心血管系统的损害较为严重,长期使用二乙酰吗啡可诱发恶性心律失常甚至心脏骤停[3],对机体造成严重的生命威胁。研究表明,二乙酰吗啡能够引起心肌细胞节律异常、组织形态学改变及功能障碍,从而诱发各类的心律失常[4]。但其具体作用机制尚不清楚。本研究以TMT 定量蛋白质组学研究为基础,探究二乙酰吗啡干预心肌细胞前、后各类蛋白质表达情况,为进一步探索二乙酰吗啡导致的心血管损伤机制奠定理论基础,也为临床上因二乙酰吗啡导致的心脏损伤提供新的防治靶标。
1 材料与方法
1.1 实验动物与材料SPF 级SD 大鼠乳鼠60 只,鼠龄3~5 d(新疆医科大学实验动物中心提供),实验已通过新疆医科大学第一附属医院动物实验医学伦理委员会审批(IACUC201805-K1)。二乙酰吗啡购自新疆维吾尔自治区禁毒总队,纯度97% 以上,外观为淡黄色粉末,PBS 稀释后使用。DMEM 高糖培养基、Dhanks 平衡盐溶液,PBS 无菌液体等均购自北京博奥森生物技术有限公司;胰蛋白酶、青/链霉素双抗、胎牛血清、Ⅱ型胶原酶购自美国Gibco公司。
1.2 实验方法
1.2.1 原代心肌细胞培养与分组 所有乳鼠沿剑突近左锁骨中线处剪开皮肤,快速夹取心脏置于预冷的D-hanks 液中,留取心尖部约1/2 的心脏组织剪成7~9 瓣置于胰蛋白酶液中,4℃摇床过夜消化10 h 后加入完全培养基终止消化,Ⅱ型胶原酶对心肌组织重复进行三次消化后获得所需细胞悬液,采用差速贴壁法剔除杂质细胞。将获得的原代心肌细胞接种至10 cm 培养皿中于37 ℃细胞孵育箱中培养5~7 d,期间根据细胞生长情况进行换液,待多数心肌细胞连成片(密度80%)且以相同频率搏动时,即可进行后续药物干预。将培养好的原代大鼠心肌细胞分正常对照组(Con)与药物干预组(Drug),Drug 组根据前期预实验确定出的最适药物作用浓度给予10-4mol/L 的二乙酰吗啡,Con 组加入等量PBS,作用24 h 后收集细胞至1.5 mL EP管中,每组重复三管。
1.2.2 TMT 定量蛋白质组学与生物信息学分析(1)提取蛋白质与肽段酶解:蛋白质提取采用SDT[4% 十二烷基硫酸钠(SDS), 100 mM 三羟甲基氨基甲烷盐酸盐(Tris/HCl,pH7.6), 0.1 M 二硫苏糖醇(DTT)],蛋白定量使用二喹啉甲酸(BCA)蛋白定量试剂盒。胰蛋白酶酶解及肽段定量采用滤器辅助的样品制备(fil⁃ter aided proteome preparation, FASP) 方法进行;(2)TMT 标记:每个样品取100 μg 肽段,根据Thermo 公司TMT 标记试剂盒使用说明进行标记;(3)色谱分级:每组标记后的肽段等量混合,采用Pierce High pH Reversed-Phase Peptide Fractionation Kit 进行分级;(4)质谱采集:通过液相色谱串联质谱进行(LCMS);(5)蛋白质鉴定及定量分析:采用Mascot2.2 与Proteome Discoverer1.4软件对原始数据进行查库鉴定与定量分析;(6)差异表达蛋白质筛选:以2组蛋白质丰度比,即差异倍数Foldchange 大于1.2 倍且P<0.05 为标准对差异蛋白质进行筛选;(7)对筛选出的差异表达蛋白质进行基因本体(GO)聚类分析、功能注释及基因百科全书(KEGG)通路富集分析等。以上实验部分由上海中科新生命生物有限公司协助完成。
1.2.3 质量控制 本实验采用具有高质量精度、高分辨率的Q Exactive 质谱仪,在数据采集过程中可以保持良好的质量偏差,并最终获得高质量图谱。
2 结果
2.1 蛋白质定量结果分析蛋白质丰富度结果显示,3次重复定量所得均值、分布均衡,见图1。2组大鼠心肌细胞中共鉴定出5 884 个蛋白质,其中上调差异表达蛋白质442 个,下调差异表达蛋白质342 个,总差异表达蛋白质784个,见图2、3。
图1 2组蛋白质丰度图
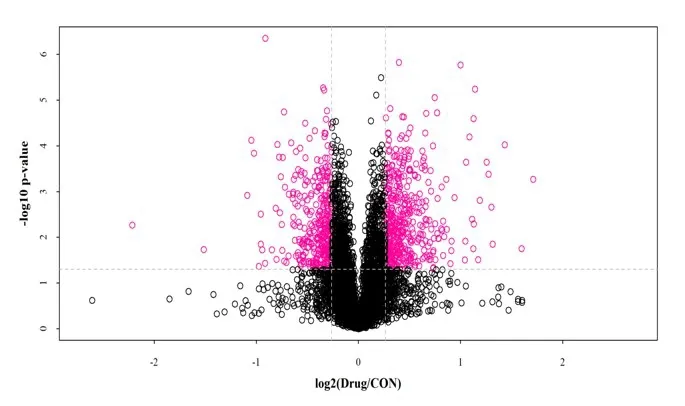
图2 2组蛋白质火山图
2.2 差异蛋白质GO 富集分析2 组筛选出的784 个差异蛋白主要参与肌细胞、横纹肌细胞、肌肉结构、心脏组织、横纹肌组织发育过程。Drug 组NADH 脱氢酶活性、氧化还原酶活性、肌动蛋白结合分子功能、肌原纤维、收缩纤维、呼吸链复合体等定位蛋白质活性均呈增高趋势,见图4。
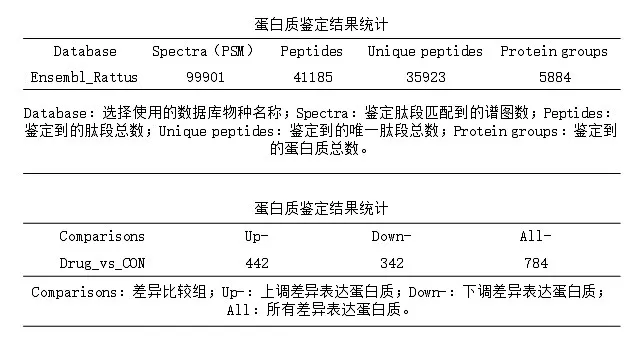
图3 蛋白质鉴定结果统计
2.3 差异蛋白KEGG 富集分析对784个差异蛋白进行KEGG通路富集分析筛选出差异最为显著的前20个信号通路,见图5。其中,心肌收缩通路、肥厚型心肌病(HCM)通路、扩张型心肌病(DCM)通路、糖酵解/糖异生通路、Apelin信号通路、细胞因子-细胞因子受体相互作用通路、过氧化物酶体增殖物激活受体(PPAR)信号通路、心肌细胞的肾上腺素能信号转导通路、致心律失常性右室心肌病(ARVC)以及氧化磷酸化通路等重要通路均发生了显著性变化。心肌收缩通路(图6)、氧化磷酸化通路(图7)差异性改变图发现,在心肌收缩通路中与心肌细胞钙离子分布及心肌的兴奋收缩偶联密切相关的重要蛋白质:细胞膜二氢吡啶受体(DHPR)、肌浆网兰诺定受体2(RyR2)、三联蛋白Triadin(TRDN)、肌集钙蛋白2(CASQ2)以及肌钙蛋白I(TnI)在二乙酰吗啡干预后均发生了显著上调,氧化磷酸化通路在二乙酰吗啡干预前后亦发生了显著变化,部分酶活性异常增高。
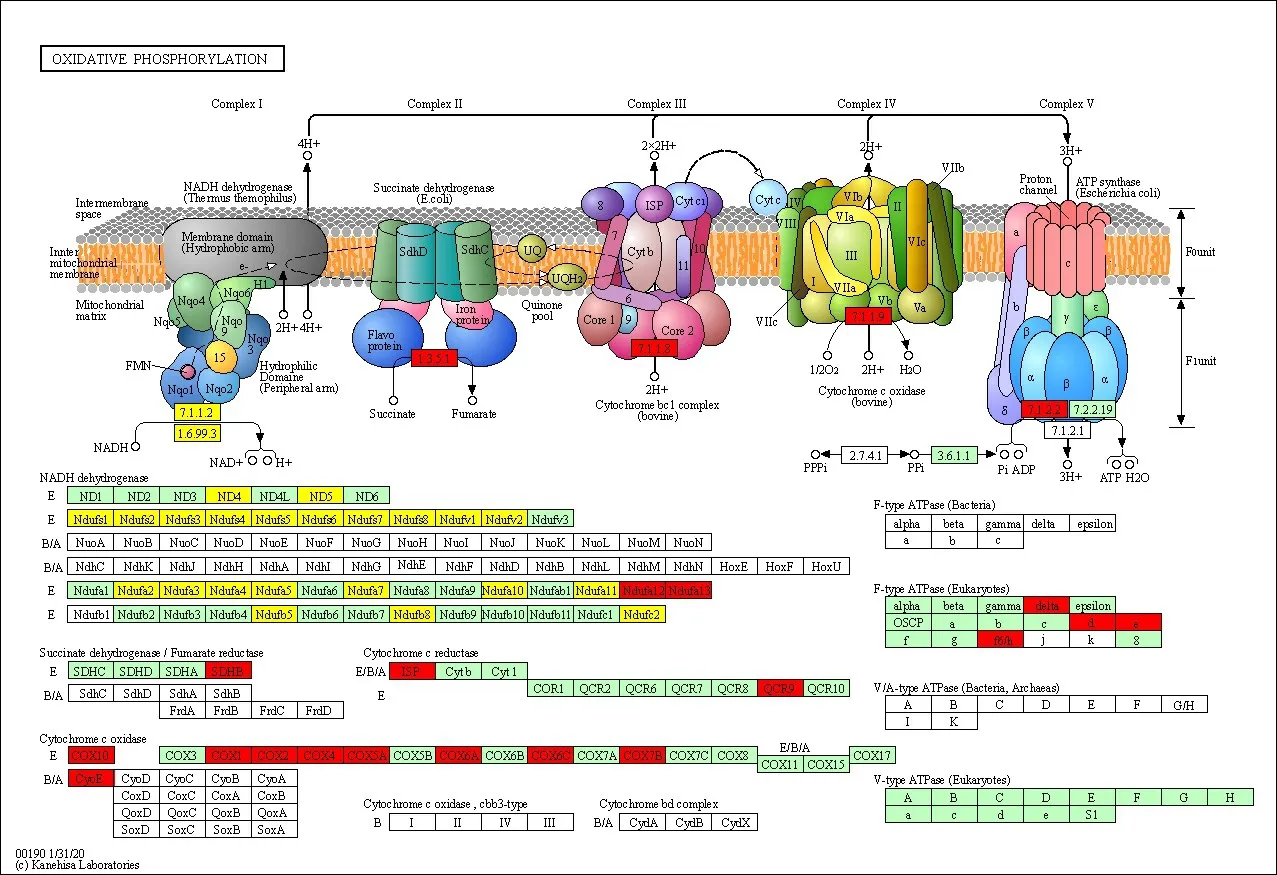
图7 氧化磷酸化通路
3 讨论
二乙酰吗啡滥用与成瘾对社会造成的影响较为严重,其在阿片类药物中滥用程度最多且成瘾最快的药物,长期吸食可导致机体发生不同程度的依赖,主要症状常表现为心悸、胸闷气短、药物渴求及肌肉疼痛等[5-6]。过去的研究提示,二乙酰吗啡可使心脏发生损伤,引发心律失常[7],但当前国内外对二乙酰吗啡造成的心脏损害研究主要集中于临床资料分析,对心脏微观形态及分子生物学机制的研究较少,其导致心脏损伤的作用机制尚不清楚。二乙酰吗啡滥用是阿片类药物引起心脏骤停的主要原因,也是药物滥用人群心脏骤停及死亡的独立危险因素[8]。长期吸食二乙酰吗啡可对心血管系统造成严重损伤,能够引起急性心肌梗死[9]、窦性心动过速或过缓[7]、房室传导阻滞[10]及窦性停搏[11]等各类心律失常疾病,对机体的生命健康构成了严重威胁。此外,二乙酰吗啡还可诱发二尖瓣与三尖瓣畸形,对右心室功能产生不良影响,继而引发肺动脉高压[12-13]。发生心功能紊乱的具体机制可能是二乙酰吗啡通过作用于心脏中的阿片受体诱发心肌细胞内Ca2+异常从而导致心肌收缩节律异常,亦可能是通过神经调节机制影响心肌细胞内神经递质水平,进而影响心肌收缩过程[14-15]。Ma 等[16]通过研究乌头碱导致室性心律失常的发生机制发现当细胞膜上的二氢吡啶受体DHPR 被大量激活后可导致Ca2+流入细胞激活RyR2,进而导致肌浆网的Ca2+大量释放发生钙超载,引起细胞内ROS 的产生增加,促进线粒体凋亡及自噬的发生从而诱发心律失常。
本实验中通过培养原代心肌细胞进行二乙酰吗啡干预,应用蛋白质组学观察二乙酰吗啡干预前、后大鼠心肌细胞中各种蛋白质的表达情况,在大鼠心肌细胞中共筛选出的784个差异蛋白,上调差异蛋白442个,下调差异蛋白342个,说明二乙酰吗啡对心肌细胞具有较严重影响。GO 功能富集分析发现,差异蛋白质生物学功能与心肌组织结构发育密切相关,说明二乙酰吗啡可能通过多途径影响心肌细胞功能。KEGG 通路富集分析发现,差异表达蛋白质主要富集的信号通路有心肌收缩通路、钙信号通路、肥厚型心肌病(HCM)通路、扩张型心肌病(DCM)通路、心肌细胞肾上腺素能信号转导通路、致心律失常性右室心肌病(ARVC)通路以及氧化磷酸化通路等,表明二乙酰吗啡可能通过影响心肌收缩力及心肌的能量代谢导致心脏损伤。在心肌收缩通路中关键蛋白DH⁃PR、RyR2、JCN、TRDN、CASQ2、TnT、TnC、TnI 表达均发生显著上调(P<0.05)。DHPR 与RyR2 在心肌的兴奋-收缩偶联中发挥着核心效应,心肌细胞膜上DH⁃PR 的激活能够改变细胞内外Ca2+分布,细胞外的Ca2+向细胞内大量聚集可激活RyR2,通过肌浆网招募Ca2+使细胞内Ca2+浓度达到较高水平, 触发心肌细胞完成一次收缩[17-18]。综合以上结果分析提示,二乙酰吗啡可能通过影响心肌细胞膜上的二氢吡啶受体DHPR 并通过钙活动与肌浆网上的TRDN、RyR2相互偶联作用引发心肌细胞钙超载的发生,导致线粒体发生氧化应激活性氧(ROS)产生增多,诱发心肌线粒体凋亡与自噬的发生,进一步影响心肌细胞收缩功能从而导致心律失常。氧化磷酸化通路也在二乙酰吗啡干预前后发生了显著的变化,部分酶活性异常增高,说明二乙酰吗啡可能对心肌细胞能量代谢造成严重影响,提示二乙酰吗啡可能通过影响心肌收缩力及心肌能量代谢共同导致心脏损伤。
综上所述,本研究结果可揭示二乙酰吗啡导致心脏损伤引发心律失常的可能路径,有望为临床治疗中二乙酰吗啡导致心律失常的具体作用机制提供理论参考与有效的治疗靶点。

