线粒体泛素连接酶MARCH5对缺氧/复氧损伤所致心肌细胞凋亡的影响及机制
王 霞,朱 伟,熊 英,赖红梅
(新疆维吾尔自治区人民医院1全科医学科,2心血管内科,乌鲁木齐830001)
冠状动脉血流供应中断引起的急性心肌梗死是常见心血管急症,已成为全世界人口死亡和残疾的主要原因[1]。 根据《中国心血管健康与疾病报告2020》,我国2002—2018 年急性心肌梗死死亡率呈快速上升趋势[2],严重影响国民健康发展,造成巨大的医疗支出。尽快恢复血流灌注被认为是心肌梗死最有效的治疗方法,但是随之而来的可逆性和不可逆性心肌损伤,即心肌缺血/再灌注损伤,与患者预后不良、发生多种心血管并发症密切相关[3]。研究表明,氧化应激是缺血/再灌注损伤中导致心肌损伤易感性增加的核心原因[4],对此环节进行干预是减少心肌细胞死亡、缩小梗死面积和改善心脏功能的有利策略。线粒体泛素连接酶膜相关环指蛋白5(membrane-as⁃sociated RING-CH-type finger 5,MARCH5)定位于线粒体外膜,含有调控泛素转移活性的环指结构域,在线粒体功能维持和活性氧(reactive oxygen species,ROS)生成中起着关键作用[5-6]。目前,在心肌缺血/再灌注损伤过程中线粒体泛素连接酶MARCH5 变化以及针对它的干预效果还不清楚。因此,本研究拟利用心肌细胞缺氧/复氧损伤(hypoxia/reoxygenation in⁃jury,H/R)模型模拟缺血/再灌注损伤,观察线粒体泛素连接酶MARCH5 的表达并通过基因转导载体对其进行干预,探索它对氧化应激的影响及作用机制,以期为急性心肌梗死治疗策略提供实验数据。
1 材料与方法
1.1 细胞、主要试剂和仪器大鼠心肌细胞系H9C2细胞购自中国科学院细胞库。MARCH5 过表达腺病毒及其阴性对照由和元生物技术有限公司合成制作。胎牛血清、DMEM 高糖培养基、青/链霉素双抗购于美国Hyclone 公司。Annexin V-FITC 细胞凋亡、细胞活力试剂盒(cell counting kit-8,CCK-8)和三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒购自上海碧云天生物技术公司。MitoTracker 和Mito SOX 荧光染料为美国Thermo 公司产品。MARCH5 蛋白、线粒体融合蛋白(mitofusin,Mfn)1、Mfn2、动力相关蛋白(dynamin-relatedprotein 1,Drp1)、低氧诱导因子-1α(hypoxia-inducible factor 1α,HIF-1α)和β-actin 抗体为美国CST 公司产品,线粒体分裂蛋白1(mitochon⁃drial fission protein 1,Fis1)为美国Abcam 公司产品。多功能酶标仪、流式细胞仪和激光扫描共聚焦显微镜分别为美国Thermo、美国Beckman 和德国Zeiss 公司产品。
1.2 细胞培养及处理使用含10% 胎牛血清和1%青/链霉素双抗的DMEM 高糖培养基(完全培养基),在5%CO2、95% 空气、37℃条件下进行细胞培养。将细胞生长至80% 左右的细胞分为4 组:正常组(N组)、缺氧/复氧损伤组(H/R 组)、H/R+阴性对照腺病毒干预组(H/R+NC 组)和H/R+MARCH5 过表达腺病毒干预组(H/R+MARCH5组)。通过缺氧小室构建H/R 模型:缺氧时使用不含胎牛血清和葡萄糖的DMEM培养基,并置入含有5%CO2和95%N2的缺氧小室中处理6h;随后更换完全培养基转入常氧环境中进行12h复氧处理[7]。H/R建模之前进行腺病毒感染H9C2细胞,先对细胞2 h 的血清剥夺预处理,再加入含腺病毒的完全培养基感染12 h,病毒感染复数为300 vg/细胞。
1.3 蛋白表达的检测通过蛋白质免疫印迹法(Western blot)检测目的蛋白的表达。细胞处理结束后,收集、提取总蛋白,进行浓度测定并将蛋白调至相同浓度,100℃加热变性后制成蛋白样本。蛋白样品经过凝胶电泳、转膜、封闭和抗体孵育等关键步骤,最终采用化学发光法在凝胶成像系统中显色并采集图像。本实验所用一抗浓度为1:1 000,二抗浓度为1:5 000。以目的蛋白与内参β-actin灰度值之比为蛋白相对表达水平。
1.4 线粒体形态观察各组细胞处理完毕后,使用PBS 缓冲液清洗3 遍,加入200 nmol/LMitoTracker 工作液,置于细胞培养箱中孵育30 min 进行染色。随后吸弃染色工作液,用PBS 缓冲液清洗3 次,使用激光扫描共聚焦显微镜下观察线粒体形态(激发/发射波长:490 nm/516 nm)。使用ImageJ 软件测量线粒体的数量、长度和面积,进行统计分析。
1.5 活性氧(reactive oxygen species,ROS)水平检测各组细胞处理完毕后,使用PBS 缓冲液清洗3遍,加入10 μmol/LMitoSOX 工作液,置于细胞培养箱中孵育30 min 进行染色。随后吸弃染色工作液,用PBS 缓冲液清洗3 次,使用激光扫描共聚焦显微镜下观察红色荧光(激发/发射波长:510 nm/580 nm)。红色荧光强度越高表明ROS 水平越高,反之则ROS 水平越低。
1.6 细胞ATP 水平检测各组细胞处理完毕后,加入200μL 裂解液进行充分裂解,4℃12 000 g 离心5 min,收取上清后进行蛋白定量并调至统一浓度,以消除蛋白浓度不同对ATP 检测结果的影响。在96孔板中按照100 μL/孔添加ATP 检测工作液,室温放置5 min使本底值消耗掉,分别在每检测孔中加入20 μL标准品和待测样品,用移液器迅速吹打均匀,用全波段酶标仪的Luminometer 功能测定相对光单位(rela⁃tive light unit,RLU)。根据标准品RLU 制定标准曲线,算出曲线方程,计算待测样品的ATP含量。
1.7 细胞活力检测将H9C2细胞接种于96孔板(1×105细胞/孔),施以各组处理后弃去培养基。向每孔细胞加入10 μL CCK-8工作液充分混匀,置于细胞培养箱中孵育2 h。最后,采用多功能酶标仪在波长450 nm 处测量每孔吸光度值,按照如下公式计算细胞活力。细胞活力(%)=(实验组吸光度值-空白吸光度值)/(正常组吸光度值-空白吸光度值)×100%。
1.8 细胞凋亡检测各组细胞处理结束后,收集并离心H9C2细胞,加入195 μL Annexin V-FITC 结合液轻轻重悬细胞,加入5 μL Annexin V-FITC 后轻轻混匀。再加入10 μL 碘化丙啶染色液混匀,室温避光孵育20 min,使用流式细胞仪检测细胞凋亡率。
1.9 统计学分析采用SPSS 22.0 软件进行统计分析,数据以均数±标准差(±s)表示,实验重复至少3次(n≥3),采用单因素方差分析(One-way ANOVA)进行多组比较,采用LSD-t检验进行两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 心肌细胞目的蛋白表达变化Western blot 实验结果显示,与N组细胞相比,H/R组和H/R+NC组细胞MARCH5、Mfn1 和Mfn2 表达减少,而Drp1、Fis1 和HIF-1α表达增加,差异有统计学意义(P均<0.05);与H/R+NC 组细胞相比,H/R+MARCH5 组细胞MARCH5、Mfn1 和HIF-1α 表达增加,Drp1 表达减少,差异有统计学意义(P均<0.05)。见图1、表1。
表1 各组心肌细胞目的蛋白表达比较(±s)
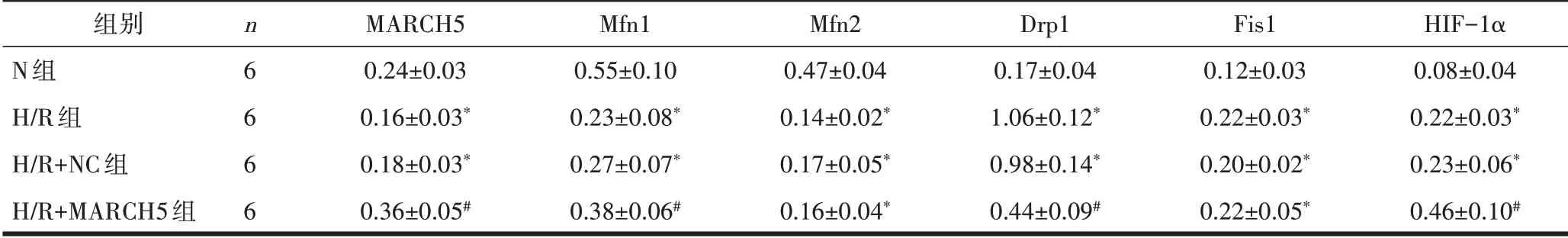
表1 各组心肌细胞目的蛋白表达比较(±s)
注:与N组比较,*P<0.05;与H/R+NC组比较,#P<0.05。
组别N组H/R组H/R+NC组H/R+MARCH5组n6666 MARCH5 0.24±0.03 0.16±0.03*0.18±0.03*0.36±0.05#Mfn1 0.55±0.10 0.23±0.08*0.27±0.07*0.38±0.06#Mfn2 0.47±0.04 0.14±0.02*0.17±0.05*0.16±0.04*Drp1 0.17±0.04 1.06±0.12*0.98±0.14*0.44±0.09#Fis1 0.12±0.03 0.22±0.03*0.20±0.02*0.22±0.05*HIF-1α 0.08±0.04 0.22±0.03*0.23±0.06*0.46±0.10#

图1 各组心肌细胞目的蛋白的Western blot检测结果
2.2 心肌细胞线粒体形态改变MitoTracker 染色结果显示,N 组细胞内线粒体分布均匀、排列整齐,多数呈棒杆状,交连成网;H/R 组和H/R+NC 组细胞内线粒体明显增多且排列紊乱,多数为碎片状或点状,线粒体网状连接结构消失;H/R+MARCH5 组细胞内线粒体形态有所恢复。与N 组细胞相比,H/R 组和H/R+NC 组细胞线粒体平均长度和面积减少,而数量增加,差异有统计学意义(P均<0.05)。与H/R+NC 组细胞相比,H/R+MARCH5 组细胞线粒体平均长度和面积增加,而数量减少,差异有统计学意义(P均<0.05)。见图2、表2。

图2 各组心肌细胞线粒体形态观察、ROS和细胞凋亡检测
2.3 心肌细胞ROS 和ATP 水平变化MitoSOX 染色和ATP 检测结果显示,与N 组细胞相比,H/R 组和H/R+NC 组细胞线粒体ROS 合成增多,而ATP 水平降低,差异有统计学意义(P均<0.05);与H/R+NC 组细胞相比,H/R+MARCH5组细胞线粒体ROS合成减少,而ATP 水平升高,差异有统计学意义(P均<0.05)。见图2、表2。

表2 各组心肌细胞线粒体形态、ROS和ATP水平比较
2.4 心肌细胞凋亡与细胞活力结果流式细胞术和CCK-8 检测结果显示,与N 组细胞相比,H/R 组和H/R+NC 组细胞凋亡指数增加而活力降低,差异有统计学意义(P均<0.05);与H/R+NC 组细胞相比,H/R+MARCH5 组细胞凋亡指数降低而活力增加,差异有统计学意义(P均<0.05)。见图2、表3。
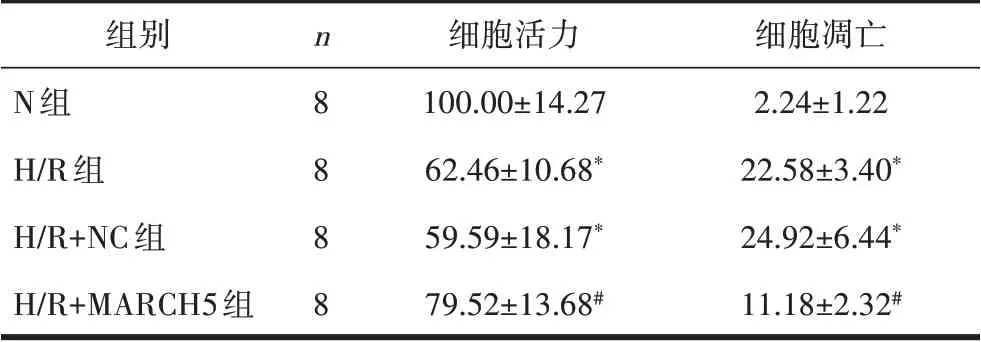
表3 各组心肌细胞活力与凋亡比较/%
3 讨论
心肌缺血/再灌注损伤涉及多种经典机制,其中氧化应激居于核心地位,与炎症、代谢障碍等相互影响。心肌细胞ROS 主要来源于线粒体呼吸链和还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶[8]。心肌缺血/再灌注损伤发生时,线粒体呼吸传递链复合体I和III处于还原状态,ROS 过度生成或蓄积,超过细胞抗氧化系统的清除能力,引起心磷脂分子和线粒体DNA等众多大分子物质受损,成为心肌细胞坏死和凋亡的主要驱动力[8-9]。因此,维持线粒体结构和功能完整对细胞生存至关重要。传统观念认为线粒体是静止和结构恒定的,但随着观察技术的更新,研究者证实线粒体在不断融合和分裂进行着迁移、连接和自我更新以维持自身稳态[10-11]。一般情况下,线粒体通过融合修复受损线粒体,线粒体的清除则主要依靠分裂进行。线粒体融合与分裂由一系列蛋白调控,其中Mfn1 和Mfn2 是线粒体外膜融合调控关键蛋白,而Drp1 和Fis1 等参与线粒体分裂过程的调控。本研究结果显示,H/R使H9C2心肌细胞的Mfn1和Mfn2表达减少而Drp1 和Fis1 表达增加,此时线粒体呈现过度分裂状态,能量供应减少且ROS 水平升高,细胞凋亡增加、活力降低,再次证实了线粒体融合与分裂失衡影响了线粒体的功能从而加剧心肌病理性损害,反映出线粒体结构与功能受损是心肌缺血/再灌注损伤易感性增加的原因。
在泛素-蛋白酶体系统作用下将泛素添加到目的蛋白的过程称为泛素化修饰,是真核细胞中普遍的高选择性蛋白质更新途径。泛素连接酶E3通过识别蛋白质N端不稳定的氨基酸信号实现蛋白质表达、活性和分布,参与心脏健康和疾病状态的调控[12]。近年来,三结构域蛋白6(TRIM6)、肌肉萎缩盒F 蛋白(Atrogin-1)、肌肉环指蛋白1(MuRF1)、神经调节蛋白受体降解蛋白1(Nrdp1)等泛素连接酶E3与心肌细胞存活、心肌缺血/再灌注损伤存在的紧密关联性被逐渐揭示,使得这些分子成为潜在治疗靶点[12-14]。MARCH5 是N 末端具有环指结构的泛素连接酶E3,具有调控细胞凋亡、信号转导、内质网-线粒体偶联和钙稳态等重要功能[15]。Wang 等[16]报道,在过氧化氢或阿霉素诱导的心肌细胞凋亡模型中,MARCH5水平反应性升高,通过基因干预手段进一步增强该蛋白表达可改善细胞凋亡。Li等[17]研究发现,氧化应激状态引起心肌细胞MARCH5 水平下降,而黄芩素通过上调MARCH5 表达水平抑制过氧化氢或缺血再灌注损伤所致凋亡,促进细胞存活。本研究结果显示,在H9C2 心肌细胞H/R 模型中MARCH5 表达水平降低伴细胞凋亡增加,借助腺病毒载体过表达MARCH5 有助于减轻细胞凋亡,表明MARCH5 与心肌缺血/再灌注损伤所致细胞凋亡密切相关。
MARCH5 定位于线粒体外膜,所含四个跨膜结构域决定着它可以结合Mfn 和Drp1 等线粒体融合分裂调控蛋白[18-19],继而对这些蛋白进行泛素化修饰和降解,成为影响细胞凋亡的主要原因。本研究发现过表达MARCH5 能够逆转H/R 所致H9C2 心肌细胞Mfn1 减少和Drp1 增多,从而抑制线粒体过度分裂和氧化应激损伤、促进ATP 合成和细胞存活,而不影响Mfn2和Fis1表达,表明Mfn1和Drp1可能是心肌缺血/再灌注损伤中MARCH5 实现线粒体稳态调控和抗凋亡的靶分子。目前有关MARCH5抑制Drp1蛋白水平从而改善线粒体分裂的作用保持一致,而对Mfn影响的报道则不相同[16-17,20-21]。心肌损伤时MARCH5水平变化及其线粒体融合调控靶点报道不一与研究选用的细胞系、细胞模型和建模条件不同有关[16]。MARCH5 可直接泛素化修饰Mfn1,也通过间接作用影响着Mfn1 的表达[20,22]。 Park 等[22]研究证实,MARCH5促进细胞生存时伴随着Mfn1乙酰化水平增加,使Mfn1 成为MARCH5 依赖性泛素化修饰的优先底物之一。Chen 等[23]研究发现,线粒体自噬受体FUNDC1 分子是MARCH5 的底物,MARCH5 直接对该受体119 位点赖氨酸进行泛素化修饰、介导降解,调节缺氧所致线粒体自噬;敲除内源性MARCH5 减少FUNDC1分子降解,加剧缺氧所致的过度线粒体自噬。由此可见,调控线粒体自噬过程是MARCH5 影响心肌细胞凋亡的另一核心机制。另外,本研究结果显示,低氧状态下细胞内环境修复因子HIF-1α 在H/R 后代偿性增加,MARCH5过表达使其水平进一步增加,提示HIF-1α 同样参与了MARCH5 介导心肌细胞凋亡的过程。尽管有研究证实线粒体泛素化连接酶E3家族成员MUL1通过其特异性底物UBXN7影响着HIF-1α 表达[24],但是有关MARCH5 与HIF-1α 的相互作用及机制还需进一步阐明。
总之,MARCH5 在心肌细胞缺血/再灌注损伤过程中发挥着重要的生理功能,可能通过调控线粒体融合分裂维持自身结构和功能稳态以及HIF-1α 表达实现抗细胞凋亡、促进细胞生存。针对MARCH5开展基因干预有望逆转心肌缺血/再灌注损伤,成为改善急性心肌梗死预后的辅助治疗方案。

