卵巢癌来源外泌体对网膜微环境以及肿瘤转移的影响
李 霞,徐春菊,周 琦
(新疆医科大学附属肿瘤医院妇外四科,乌鲁木齐830011)
外泌体属于囊泡样的小体,细胞合成之后将其释放到细胞外部,作为肿瘤微环境的媒介可促进肿瘤的转移[1]。卵巢癌源性外泌体中包含分2000 多种蛋白,其中与肿瘤发展和转移相关的有热休克蛋白、膜蛋白、酶类蛋白等。有研究发现,铂类化疗药物抵抗和膜粘连蛋白A3(annexinA3)的高表达关系密切[2]。在肿瘤微环境当中,外泌体是其中比较重要的构成部分。其中所携带的信息载体,在调节免疫系统当中有比较明显的作用。肿瘤外泌体当中含包含了丰富的miRNA、蛋白酶、表面标记蛋白、抗原呈递蛋白以及膜转运蛋白等。卵巢癌筛查中,紧密连接蛋白claudin-4 联合癌抗原125(CA125)是一种比较好的指标[3]。卵巢癌细胞可以通过外泌体在卵巢癌当中产生影响。CAFs与ADSCs是大网膜微环境当中最重要的2 种间质细胞。外泌体是肿瘤微环境当中十分关键的一环,在肿瘤疾病早期诊断、预后评价、疾病的发生机制、化疗耐药以及免疫抑制等很多方面都具有重要的作用。本研究主要通过体外试验分析卵巢癌来源外泌体对于细胞活化的影响以及对于网膜微环境的影响和卵巢癌转移影响的效果,现将研究结果报道如下。
1 资料与方法
1.1 一般资料收集2018年1月—2019年12月在新疆医科大学附属肿瘤医院确诊为卵巢癌的患者68例,年龄平均38~65 岁,平均年龄(49±6.0)岁。所有患者均有病理学证实为卵巢恶性肿瘤。良性肿瘤患者50例,年龄平均22~59岁,平均年龄(42±6.1)岁均为手术病理证实为卵巢良性肿瘤。健康对照患者60例,年龄平均45~70 岁,平均年龄(52±6.2)岁为妇科其他疾病切除卵巢者,卵巢病理检查证实为正常卵巢组织。纳入标准:知情同意;临床资料完整;病理符合纳入要求者。排除标准:拒绝参与研究;病理不符合纳入标准者。
1.2 方法
1.2.1 细胞培养 人卵巢癌细胞株SKOV3 在温度37℃,二氧化碳含量5% 的温箱中培养,含胎牛血清10% 左右的培养基DEME加入青链霉素双抗共培养,密度达到70~80% 传代。获取在医院实施卵巢恶性肿瘤手术的患者的大网膜,患者在手术之前没有接受放化疗,分离培养培养人大网膜脂肪来源间充质干细胞。取大网膜组织,PBS 冲洗,剪碎,置于50 mL离心管中,加10 mL 无血清培养基,让组织变成悬浮状态,加入浓度为1% 的I 型胶原酶,混匀,置于温控摇床中,100 rpm 恒温,振荡消化60 min,组织变成悬浊状态,肉眼看不到比较显著的脂肪块。加入体积相同的完全培养基混匀胶原酶。剩余液体离心5 min,溶液分为上层脂肪层和下层液体层,细胞团块聚集于管底,加入培养基混匀,置于培养箱中,24 h后换液,正常传代。 4℃左右的环境中进行人大网膜成纤维细胞的培养,网膜组织中的血管和筋膜剪去,PBS 冲洗,剪碎,加入无血清培养基,加入浓度为0.1% 的等量I 型胶原酶,剩余液体离心5min,细胞团块聚集在管底。细胞计数之后接种到培养瓶,加双抗,24 h后换液,未贴壁的细胞去除,正常的传代培养。
1.2.2 人卵巢癌网膜组织标本的收集 取卵巢恶性肿瘤患者手术切除的大网膜组织置于温度保持在4℃的保温箱快速转送实验室,在液氮中迅速冷冻,再切成体积约5mm3的组织块后甲醛固定石蜡包埋,制成玻片。
1.2.3 腹水来源的外泌体与效应细胞共培养(1)CAFs 细胞:在10% 比例的胎牛血清培养基中进行完全培养,密度达到70% 后,无菌PBS 冲洗3次,去除血清,在50ug/ml 的培养基中进行不同时段培养。(2)ADSCs 细胞在比例为10% 的胎牛血清当中培养,细胞密度达到70% 左右后,无菌PBS 冲洗2 次,去除血清。加入差异化的腹水外泌体,培养的时间也需要差异化,最长的处理时间为15 d。
1.2.4 免疫印迹(Western blotting)法对细胞内蛋白进行测定 取出培养符合标准的细胞,PBS冲洗3次,刮下细胞,加入细胞裂解液,离心后对蛋白进行定量,加入一抗,SDS-PAGE 胶电泳法进行蛋白的分离与PVDF膜的转移。TBST漂洗后孵育二抗,化学发光检测显影蛋白质条带。
1.2.5 动物模型的构建 实验组裸鼠腹腔注射卵巢癌患者腹水中提取的外泌体,每只裸鼠注射外泌体的剂量为50 μg,3天为1个注射周期。对照组裸鼠腹腔PBS注射。选择不同的时间处死裸鼠,裸鼠网膜组织免疫组化检测OCDE,观察分析在不同时段网膜组织发生的变化。
1.3 统计学分析采用SPSS.21.0统计学软件对所有数据进行分析,其中计量资料采用t检验,用均数±标准差(±s)来表示,检验水准α=0.05。
2 结果
2.1 人卵巢癌转移之前网膜微环境的变化结果
ADE 处理SKOV3 和CAFS2 之后,网膜微环境被活化,见图1。
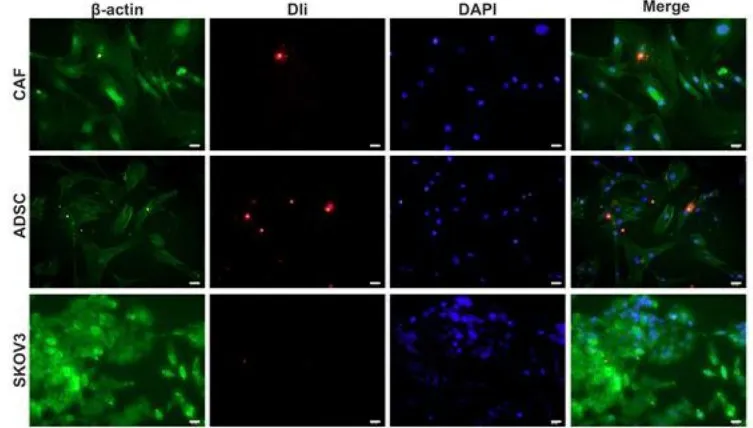
图1 效应细胞对OCDE的摄取
2.2 卵巢癌来源外泌体对于CAFs以及ADSCs活化作用ADE处理CAFs后,FAP及a-SMA表达量增加,具有剂量以及时间依赖性。见图2。

图2 卵巢癌来源外泌体对于CAFs以及ADSCs活化效果
2.3 卵巢癌源性外泌体对于网膜微环境以及肿瘤转移的影响OCDE 处理裸鼠后,其网膜组织中a-SMA表达水平与对照组比较显著升高,差异有统计学意义(P<0.05)。见图3。

图3 裸鼠网膜组织中a-SMA表达水平
2.4 3 组患者CD9+、CD44+以及EpCAM+表达比较恶性肿瘤组CD9+、CD44+以及EpCAM+表达与良性肿瘤组比较,差异有统计学意义(P<0.05),见表1。
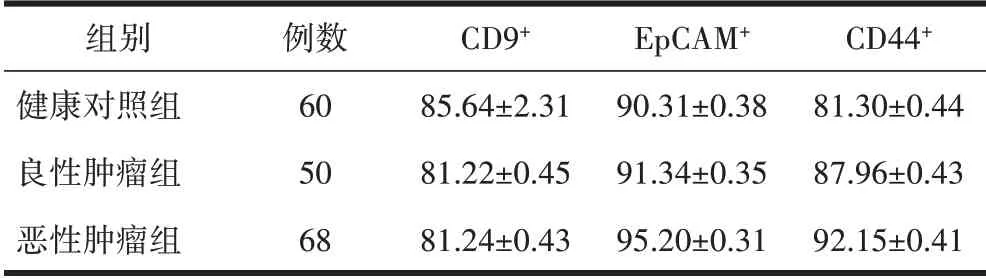
表1 3组患者CD9+、CD44+以及EpCAM+表达比较
3 讨论
卵巢癌在妇科肿瘤中恶性程度高,预后差,早期诊断困难,当前在卵巢癌诊断中比较常见的诊断方法有血清肿瘤标志物水平检测及影像学检查和妇科查体等,但病理活检方可明确诊断[4]。在肿瘤细胞中外泌体会参与肿瘤细胞间遗传物质的转运[5]。组织器官出现病理变化之后,血清以及血浆蛋白结构和数量都会开始改变[6-7]。外泌体可以通过吞噬、膜融等方式被细胞吸收完成细胞通讯过程[8]。卵巢癌晚期患者外泌体中包含的蛋白量比较高,所以上皮性卵巢癌外泌体蛋白质检测体系的构建与研究在今后也会成为卵巢癌辅助诊断的重要方法[9]。肿瘤微环境包含肿瘤细胞、外泌体等,这些物质一起形成了肿瘤细胞外部的局部内环境[10]。一些恶性腹水外泌体可以导致外周血的DC 细胞及T 细胞加速凋亡[11]。已经有多项研究当中发现外泌体包含黏附因子、明胶酶及细胞表面锚定蛋白酶等[12]。因此可以认为在肿瘤细胞的转移及游离原发部位过程中,外泌体起到了比较大的促进作用。有体外实验证实可以通过清除外泌体治疗晚期肿瘤,但其同时也清除了非肿瘤源性外泌体,在促进卵巢癌患者生存期延长对效果上还有比较大的争议[13]。
本研究显示:网膜转移癌灶中有大量的条索状a-SMA 表达,而在未出现转移的网膜组织中a-SMA 表达并不是十分明显;ADE 与SKOV3 CDE 在处理了CAFs 之后,SMA/FAP 表达均显著增加,而且在剂量与时间上具有明显依赖性;在体内实验中OCDE 可以促进未荷瘤裸鼠网膜出现活化,而且对卵巢癌网膜原代CAFs 与ADSCs 细胞的活化起到促进作用;开展的体外实验发现,在原代培养网膜微环境细胞中,OCDE 对于ADSCs 与-CAFs 活化的促进作用很显著。提示:外泌体中决定外泌体作用发挥程度的关键因素是外泌体当中所包含的内容物;卵巢癌外泌体对于网膜微环境以及肿瘤的转移促进效果比较明显。
综上,卵巢癌源性外泌体可以起到一定的癌细胞活化和微环境细胞活化作用,其中包含的细胞主要就是ADSCs 和-CAFs 细胞。但特异性miRNA 转染外泌体能否对肿瘤化疗耐药性进行逆转,是否可以接种免疫性疫苗治疗肿瘤等,这些都是需要在今后研究中进一步验证。

