乳腺癌帕博西尼耐药细胞株的建立及耐药机制研究
唐 瑶,杨 建,郭正成 ,郝 峰,宁金鹰,康金森
(1新疆医科大学药学院,乌鲁木齐830011;2新疆天然药物活性组分与释药技术重点实验室,乌鲁木齐830000;
3康源博创(北京)生物科技有限公司,北京100010)
乳腺癌是女性发病率和死亡率最高的恶性肿瘤,在分子水平上主要表现出高度异质性,包括几个具有不同肿瘤生物学特性的分子亚群:管腔A 型(Lu⁃minal A)、管 腔B 型(Luminal B)、HER-2 过 表 达 型(HER-2+)、基底样型(三阴性,Basal-like)以及正常样型[1]。约70% 的乳腺癌患者呈雌激素受体(ER)阳性,有效的内分泌治疗能够改善ER 阳性患者的预后,但乳腺癌患者对内分泌治疗的耐药性仍然是该疾病的临床挑战[2]。细胞周期蛋白依赖性激酶(CDK)4/6抑制剂是目前乳腺癌靶向治疗药物研究的最新热点,CDK4/6抑制剂正迅速改变激素受体(HR)阳性人表皮生长因子受体2(HER2)阴性(HR+/HER2-)晚期乳腺癌的治疗格局,能够有效地延迟内分泌抵抗的出现[3]。 目前帕博西尼(Palbociclib)、瑞博西尼(riboci⁃clib)、和玻玛西尼(abemaciclib)3种口服特异性CDK4/6 抑制剂已被美国食品药品监督管理局批准用于HR+/HER2-乳腺癌患者的一线治疗[4]。虽然CDK4/6抑制剂可以有效改善HR+/HER2-乳腺癌患者的预后,但不同的个体对CDK4/6 抑制剂敏感性不同,大多数患者在接受CDK4/6抑制剂治疗后出现耐药。肿瘤耐药主要分为内源性耐药和获得性耐药,其耐药机制十分复杂。目前国内建立肿瘤耐药细胞株的方法主要使用药物筛选法,包括大剂量药物冲击疗法和浓度递增法[5]。研究认为基于药物剂量递增建立肿瘤耐药细胞主要是通过化疗药物持续作用,使用肿瘤细胞生理和遗传特性发生改变,从而产生获得性耐药[6]。本实验以帕博西尼(palbociclib)为诱导药物,人HR+/HER2-细胞T47D为诱导对象,探究人源乳腺癌细胞系(T47D)对帕博西尼耐药的机制,现报告如下。
1 材料与方法
1.1 试药培养基RPMI-1640(Hyclone,SH30809.01);0.25% 胰酶(Solarbio,T1320);100×青链霉素混合液(Solarbio,P1400);1×磷酸盐缓冲液PBS(Solarbio,P1020-500);10×磷酸盐缓冲液PBS (Solarbio,P1022-500);牛胰岛素(Solarbio,I8040);胎牛血清FBS(Gibco,10099-141);CellTiter-Glo® Luminescent Cell Viability Assay(Promega, G7572); Palbociclib (selleck, PD-0332991),总RNA 提取试剂盒RNeazy Plus MiniKit(250)(QIAGEN,74136);逆转录试剂盒PrimeScript RT Master Mix(TAKARA,RR036A),PowerUp ™SYBR ™Green premix (Thermo,A25742);抗磷酸Rb(CST,8516T);总Rb(CST,9313T)、CDK2(CST,18048T);CDK4(CST,12790T);CDK6(CST,13331T);CCND1(CST,55506T);内参GAPDH(CST,5174S);均为抗兔单克隆抗体;及其相应的二抗Anti-rabbit IgG, HRPlinked Antibody(CST,7074S);引物由中国北京瑞博兴科合成。
1.2 仪器96 孔透明平底黑壁板(Corning);Spectra⁃Max 多标记微孔板检测仪(MD);CO2培养箱(Thermo Scientific);生物安全柜(Thermo Scientific);倒置显微镜(Olympus,CKX41SF);iBlot 2 Dry Blotting System(In⁃vitrogen);Mini-Protean Tera 小型垂直电泳槽(Bio-Rad);ImageQuant ™LAS 4000 Image Analyzer (GE Healthcare Bio-Sciences AB);7500 Fast Real-Time PCR System(Applied Biosystems™Thermo)。
1.3 细胞人乳腺癌细胞系T47D 购自美国典型培养物保藏中心(ATCC);人乳腺癌帕博西尼耐药细胞株为本实验室构建。
1.4 方法
1.4.1 细胞培养 取对数生长期T47D 人乳腺癌细胞采用RPMI-1640(含有10% 胎牛血清,1×青链霉素混合液)培养液,在37℃、5%CO2条件下于培养箱中培养,每2~3 天更换培养液,贴壁生长良好的乳腺癌细胞经0.25% 胰蛋白酶消化传代。取对生长期细胞进行试验。
1.4.2 人乳腺癌帕博西尼耐药细胞株的建立 取对数生长期T47D 细胞,置于含抑制剂帕博西尼的新鲜培养液,抑制剂梯度为0.5、1、2、5、10、20、50 μmol,从最低浓度0.5 μmol开始,抑制剂处理细胞24 h后撤去含帕博西尼换新鲜培养基,细胞正常生长后加入更高浓度的抑制剂进行筛选实验,反复传代并使之稳定,直到最高浓度50 μmol,最终得到耐受帕博西尼的混合克隆。用不含抑制剂的完全培养基培养混合克隆14 d,使细胞恢复状态,采用Promega CellTiter-Glo方法检测帕博西尼对亲代细胞和耐药细胞混合克隆生长抑制作用,计算IC50值和耐药指数(RI)。当混合克隆耐药指数≥5 时,再进行单克隆挑选。同法采用Promega CellTiter-Glo 方法检测帕博西尼对耐药细胞单克隆生长抑制作用,计算IC50和耐药指数。单克隆耐药指数≥5 时,认定耐药细胞株构建完成。本研究经过10个月获得了稳定的人乳腺癌帕博西尼耐药细胞株,命名为T47D-PalR(帕博西尼维持浓度为20 μmol)。所有实验均在停用帕博西尼抑制剂,正常培养基培养两周后取处于对数生长期的细胞进行。
1.4.3 细胞药物敏感度实验(CTG) 分别取对数生长期T47D和T47D-PalR细胞并采用血小板计数器进行细胞计数。通过台盼蓝排斥法检测细胞活力,确保细胞活力在90%以上。调整细胞浓度为5.55×103个/mL;分别添加180 μL 细胞悬液至96 孔板中,使细胞终密度为1 000 个/mL。将96 孔板中的细胞置于37℃、5%CO2、95% 湿度细胞培养箱中培养过夜。首先配制10×药物溶液,最高浓度为100 μmol,9 个浓度,稀释3.16 倍,实验时每个浓度设置3 个复孔。在接种有细胞的96 孔板中每孔加入20 μL 梯度稀释的10×药物溶液,使药物终浓度为最高浓度10 μmol,9 个浓度,3.16 倍稀释。将已加药处理的96 孔板置于37℃、5%CO2、95% 湿度条件下继续培养10 d(中途补液),后采用CellTiter-Glo Luminescent Cell Viability Assay(Promega) )多功能读板器上检测暴露10 d后的细胞存活率。使用GraphPad Prism8.0软件分析数据,利用非线性S 曲线回归来拟合数据得出剂量-效应曲线,并由此计算IC50值和耐药指数。细胞存活率/=(Lum 待测药-Lum 培养液对照)/(Lum 细胞对照-Lum 培养液对照)×100%;耐药指数=抑制剂对耐药细胞株生长的半数抑制浓度/抑制剂对亲代细胞株生长的半数抑制浓度。
1.4.4 实时荧光定量PCR 检测耐药基因表达 按照RNeazy Plus Mini Kit(250)(74136;QIAGEN)试剂盒说明书提取细胞总RNA,NanoDropND-2000 超微量分光光度计检测总RNA 的纯度和浓度。按照Prime Script RT Master Mix(RR036A,TAKARA)逆转录试剂盒和PCR 扩增操作说明进行逆转录和PCR 扩增。逆转录反应条件为:37℃预变性15 min;85℃变性5 s,循环1 次;4℃无限循环。使用SYBR Green qPCR Mas⁃ter Mix 荧光定量qPCR 试剂盒(Thermo,A25742)进行Real-time PCR,反应条件为:95℃预变性10 min;95℃变性15 s,60℃退火/延伸1 min,40个循环,以GAPDH为内参照,依据目的基因相对表达量RQ=2-△△Ct算法分析相关耐药基因mRNA相对表达量,各基因引物序列见表1。
1.4.5 免疫蛋白印迹检测 采用RIPA 蛋白裂解液进行细胞总蛋白的提取,并用Gold-BCA 蛋白质定量试剂盒进行总蛋白的浓度测定并对上清液进行定量。将等量的蛋白质样品加入6×loading buffer 中,95℃煮沸10 min变性。将总蛋白在4%~12%的聚丙烯酰胺梯度预制胶(SDS-PAGE)进行蛋白质电泳;待蛋白条带跑到胶底部0.5 cm 处,停止电泳,然后转印迹到PVDF 膜上。将目的蛋白条带置于5%脱脂牛奶中4℃过夜或室温2 h 封膜后,PBST 缓冲液洗涤3 次,每次5 min;之后进行抗体一抗孵育4℃过夜或室温2 h。次日洗膜后使用HRP 偶联的二抗在室温下于摇床上缓慢孵育1~2 h,PBST缓冲液洗涤3次,每次10 min;用增强的化学发光试剂(SuperSignal West Femto Maxi⁃mum Sensitivity Substrate, Thermo,34096;SuperSignal™West Atto ultra-sensitive substrate,A38555) 在Im⁃ageQuant ™LAS 4000 Image Analyzer (GE Healthcare Bio-Sciences AB, Uppsala, Sweden)上通过CCD 凝胶成像系统采集图像。使用ImageJ 软件(1.8.0,USA)对蛋白条带进行半定量分析。
1.5 统计学处理采用SPSS24.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,采用t检验;多组均数间比较采用单因素方差分析(one-way ANO⁃VA),检验水准α=0.05。
2 结果
2.1 细胞形态学观察可见T47D 细胞呈多角形,形态较一致,细胞内结构均匀;T47D-PalR 细胞大小、形态均发生变化,体积明显变小、触角明显增多,细胞更细长,向梭形转变,且生长相对松散,细胞内尤其是近胞膜处有较多深色物质聚集,见图1。
2.2 T47D/T47D-PalR 细胞的耐药程度及药物敏感度分析T47D-PalR、T47D-PalR-clone 39# 细胞对palbociclib 的敏感性弱于其亲本细胞T47D(P<0.05);IC50分 别 为(0.069±0.022)μmol 和(4.281±0.204)μmol,均大于10 μmol;T47D-PalR、T47D-PalR-clone 39#对帕博西尼的RI 分别为62.0 及>144.9,属高度耐药,见图2、表2。
表2 T47D细胞和T47D-PalR细胞及T47D-PalR-clone 39#对palbociclib的药物敏感度(±s,n=3)

表2 T47D细胞和T47D-PalR细胞及T47D-PalR-clone 39#对palbociclib的药物敏感度(±s,n=3)
注:与T47D比较,* P< 0.05。
cellline T47D T47D-PalR T47D-PalR-clone 39#IC50/μmol 0.069±0.022 4.281±0.204*>10 RI-62.0>144.9
2.3 T47D-PalR 乳腺癌耐药细胞对CDK4/6 抑制剂的交叉耐药性T47D 对Palbociclib、ribociclib、abe⁃maciclib 敏 感,IC50值 分 别 为(0.054±0.020) μmol、(0.145±0.050) μmol、(0.035±0.010) μmol;T47D-PalR对Palbociclib、ribociclib、abemaciclib 不敏感,IC50值分别为(4.281±0.167) μmol、>10 μmol、>10 μmol 耐药指数RI分别为91.2、>69.0、>285.7,见图3、表3。
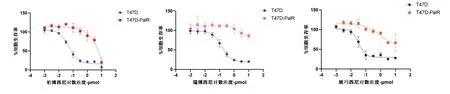
图3 不同浓度的CDK4/6抑制剂对T47D和T47D-PalR细胞的增殖抑制率影响
表3 T47D细胞和T47D-PalR细胞对3种CDK4/6抑制剂的IC50值及耐药指数(±s)
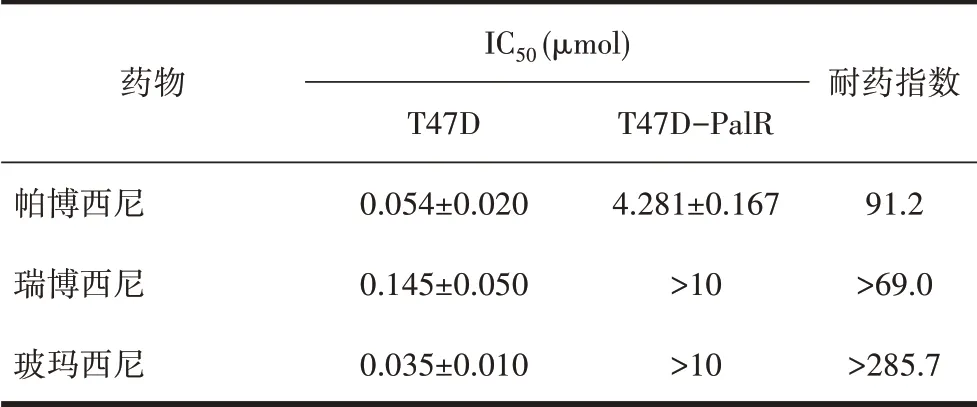
表3 T47D细胞和T47D-PalR细胞对3种CDK4/6抑制剂的IC50值及耐药指数(±s)
药物帕博西尼瑞博西尼玻玛西尼IC50 (μmol)T47D 0.054±0.020 0.145±0.050 0.035±0.010 T47D-PalR 4.281±0.167>10>10耐药指数91.2>69.0>285.7
2.4 T47D 和T47D-PalR 细胞中有关耐药基因的mRNA 表达与T47D 细胞相比较,T47D-PalR 细胞的CDK2、CDK4、CDK6、E2F1、CCND1 等耐药基因的相对表达量均有所升高,差异均有统计学意义(P<0.05),其中CDK6 显 著性高表达(P<0. 001);Rb 的mRNA 表达在T47D 与T47D-PalR 中差异无统计学差异(P>0.05),见图4。
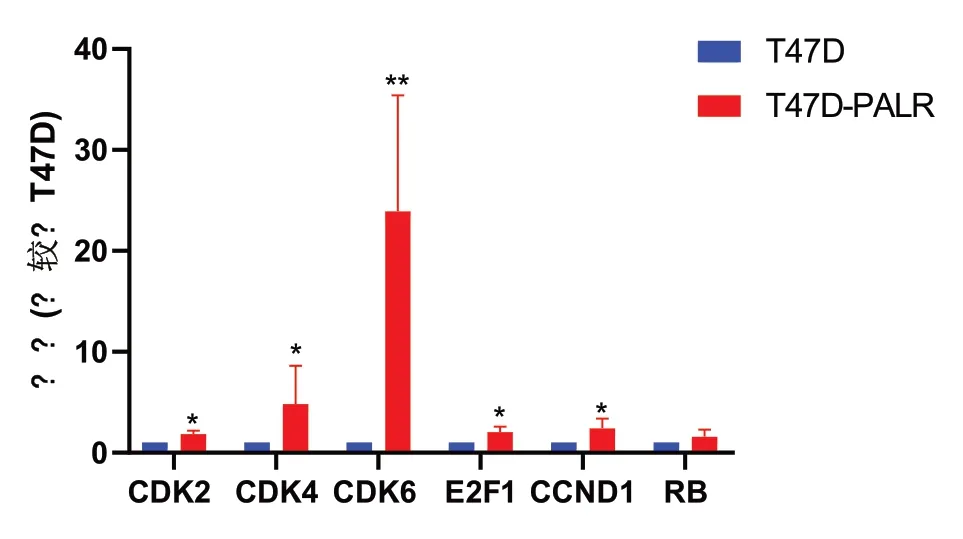
图4 T47D和T47D-PalR细胞的基因谱表达分析
2.5 免疫蛋白印迹(Western-Blot) 检测T47D 和T47D-PalR 细胞中有关耐药基因的蛋白表达与T47D 比较,T47D-PalR 细胞中P-Rb、CDK4、CDK6、E2F1、CCND1等蛋白表达增强,差异均有统计学意义(P<0.05),其中CDK6 的蛋白表达显著性升高(P<0.01);CDK2与总的Rb蛋白表达差异无统计学意义(P>0.05),见图5。
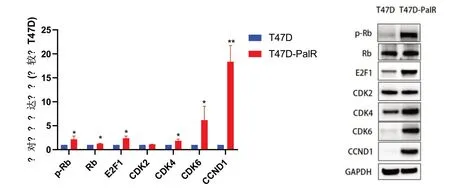
图5 T47D和T47D-PalR细胞中CDK2、CDK4、CDK6、E2F1、CCND1、P-Rb和Rb的蛋白表达
3 讨论
帕博西尼是首个获批的细胞周期蛋白依赖激酶4 和6(CDK4/6)抑制剂,与来曲唑联合用于雌激素受体阳性(ER+)、人表皮生长因子受体2 阴性(HER2-)的妇女晚期乳腺癌[7]。目前,CDK4/6细胞周期激酶的小分子抑制剂已在雌激素受体(ER) 阳性转移性乳腺癌中表现出了显著的临床疗效,尽管它们的细胞抑制作用受到原发性和获得性耐药性的限制[8]。为了探讨CDK4/6 抑制剂的获得性抗性的机制,本研究采用帕博西尼低浓度梯度递增法构建了长期暴露于CDK4/6 抑制剂帕博西尼(PD0332991) 的乳腺癌耐药细胞株T47D-PalR。有学者认为,耐药指数小于5 为低度耐药,耐药指数5~15 为中度耐药,耐药指数大于15 属于高度耐药[9]。据此标准,T47D-PalR 细胞不仅耐药性能稳定,且属于高度耐药。此外,T47D还对其他CDK4/6 抑制剂瑞博西尼、玻玛西尼具有交叉耐药性,是探究CDK4/6 抑制剂耐药机理以及药物逆转耐药筛选的理想细胞模型。
激素受体阳性乳腺癌的增殖依赖于细胞周期蛋白依赖性激酶4 和6。CDK4 和CDK6 在细胞增殖中起关键作用,细胞周期蛋白D 是CDK4 和CDK6 激酶的调节剂。CDK4/6和细胞周期蛋白D 一起形成活性复合物,磷酸化视网膜母细胞瘤基因(Rb)继而释放转录因子E2F,促进细胞周期相关基因的转录,使细胞进入S期[10]。在体外,CDK4/6抑制剂有效地阻滞肿瘤细胞从G1 期进展到S 期,防止ER 阳性乳腺癌细胞系的增殖[11]。 研究表明失调的细胞周期蛋白D1-CDK4/6 复合物在许多癌症(包括乳腺癌)的发生和进展中发挥重要作用[12]。cyclin D-CDK4/6-RB 通路的失调导致增值异常,是乳腺癌发病机制的早期步骤[13]。国内外已经有研究报道,CDK4/6 抑制剂的耐药机制包括细胞周期素(Cyclins) -CDKs 复合物增加、Cyclin-CDK4/6-P16-Rb 通路激活、肿瘤免疫微环境改变和肿瘤细胞适应[14]。
在雌激素受体阳性(ER+)乳腺癌中,CDK4/6 激酶的失调激活是大多数乳腺癌的标志。CDK4 的异常表达会激活细胞周期蛋白-CDK4/6-Rb 通路进而导致细胞耐药[15]。Pancholi 等[16]的研究发现CDK4 的表达增加导致了肿瘤细胞对palbociclib 产生耐药性。C Yang 等[17]研究发现获得性CDK6 扩增可以促进乳腺癌对CDK4/6 抑制剂的耐药性。本研究发现,耐药细胞T47D-PalR 中,CDK4 和CDK6 的mRNA 及蛋白的表达均明显升高,与上述研究一致,提示CDK4 或CDK6 的过表达是本研究中T47D-PalR 耐药细胞对CDK4/6 抑制剂耐药的主要机制。但CDK4、CDK6 的过表达导致对CDK4/6 抑制剂耐药的确切机制尚不清楚,亟待进一步研究发现。
作为CDK4/6抑制剂的主要靶点,RB被认为是治疗敏感性最重要的生物标志物之一,是细胞周期调节中的关键检查点[18]。E2F 是RB 的下游转录因子。细胞周期蛋白D-CDK4/6 对RB 的磷酸化释放E2F,导致细胞周期进程所需的蛋白质的转录[19]。近15%的乳腺癌已检测到细胞周期蛋白D2 基因及CCND1的扩增,并且已确定在超过一半的原发性ER+ 乳腺癌,细胞周期蛋白D1 在mRNA 和蛋白质上的表达上调。研究发现,细胞周期蛋白E-CDK2 复合物会磷酸化RB,释放E2F 并促进进入S 期,CDK2 通路的过度激活介导了对CDK4/6 抑制剂的抗性[20]。另有报道,在高达50% 乳腺癌中发生了细胞周期蛋白D1 的过度表达,可进一步导致Rb 蛋白的异常磷酸化和失活[21]。本研究发现,T47D-PalR 耐药后,CCND1、E2F1的mRNA 和蛋白表达均明显上调,另外还包括CDK2的扩增及Rb的磷酸化增强,提示Rb蛋白的异常磷酸化可能受CDK2 的异常表达和E2F1 的持续激活及CCND1 的过表达等多种因素的影响,而CCND1-CDK4/6-Rb-E2F1 的异常激活和CDK2 的扩增与CDK4/6 抑制剂的抗性有关。
综上所述,本研究通过选择性CDK4/6 抑制剂帕博西尼低浓度梯度递增成功构建了稳定耐受帕博西尼的人乳腺癌耐药细胞株T47D-PalR,其形态与亲本细胞T47D存在明显差异,且耐药性高,符合乳腺癌耐药细胞的特征。本次研究结果表明,乳腺癌细胞对帕博西尼耐药可能是一个多基因和多条通路共同参与的过程,CDK4 和CDK6 的CCND1、E2F1 水 平 是CDK4/6 抑制剂的潜在生物标志物,并为进一步研究CDK4/6 抑制剂耐药的确切机制提供了有力的实验依据。

