鸽乳中产纤维素酶和脂肪酶微生物的分离鉴定
朱建国,严璐,刘双倩,龚道清*,刘颖,谢鹏*
(1. 扬州大学动物科学与技术学院,江苏 扬州 225125;2. 淮阴师范学院生命科学学院,江苏 淮安 223001)
鸽子属于晚成雏鸟类,其嗉囊组织在结构和功能方面与其他禽类不同,除储存和软化食物外,还承担着类似于哺乳动物乳腺的“泌乳”功能。刚孵化的幼鸽由于不具备觅食能力,必须依靠亲鸽嗉囊形成的 “鸽乳(crop milk)”作为唯一营养来源[1]。鸽乳是由亲鸽嗉囊的上皮细胞层脱落形成,含有丰富的营养物质、免疫球蛋白、促生长因子等,对乳鸽的生长发育、机体免疫力和肠道微环境等起重要作用[2-3]。早期鸽乳的主要成分为蛋白质和脂肪,此外还包括少量的碳水化合物和矿物成分,随着幼鸽日龄的增长,其外观形态和营养成分均出现动态变化,自然状态下,0~5 d鸽乳为淡黄色乳酪状,5~7 d开始变为流质性液体并带有发酵软化的半颗粒状饲料[3],乳鸽发育中后期饲料及碳水化合物的比例需不断增加。研究表明:乳鸽采食鸽乳至3周龄,体重会增长近22倍,然而幼雏刚出壳不久,胰腺及小肠黏膜自身分泌的消化酶活性较低,消化道发育尚不健全[4-7]。Shetty等[4]发现鸽乳中存在多种微生物,已有研究证实微生物可通过产生相关酶类来提高宿主的消化能力[8],由此推测鸽乳中可能存在此类微生物,帮助雏鸽消化营养物质,使其肠道能够适应高含量蛋白和脂肪的鸽乳[3]。此外,已发现鸽乳中富含半乳糖酶、亮氨酸氨肽酶、谷氨酸转肽酶,脂肪酶和蛋白酶等也在脱落的嗉囊上皮细胞中持续积累,幼鸽依靠这些酶类进一步促进自身消化功能的发育[4, 9]。虽然有关人工仿制鸽乳的研究多见报道,但大都并未取得良好的替代饲喂效果,除人工配制技术尚不成熟外,未充分了解微生物在其中的作用可能也是原因之一[10]。鉴于此,本试验将采集哺育期的鸽乳样品,通过富集培养、初筛、复筛以及发酵培养,以期筛选出鸽乳中部分产酶微生物并对其进行初步研究。
1 材料与方法
1.1 样品采集
选取7、8日龄乳鸽各3只,鸽乳取样方法参考文献[11],具体操作如下:用酒精擦拭消毒乳鸽嗉囊无血管处,使用手术刀片小心切开(手术刀消毒),迅速收集鸽乳并装入10 mL 无菌离心管中,迅速置于4 ℃冰箱保存。立即缝合乳鸽伤口并移入窝中,将采集的鸽乳充分混合并称取5 g样品,供产酶菌株分离用。
1.2 培养基制备
产纤维素酶微生物培养基包括:富集培养基、刚果红培养基、摇瓶发酵培养基和保藏培养基,培养基成分参照文献[12];产脂肪酶微生物培养基包括:富集培养基、溴甲酚紫培养基、底物溶液、种子培养基和发酵培养基,培养基成分参照文献[13]。以上培养基使用前均需121 ℃灭菌20 min;底物溶液:大豆油和2%聚乙烯醇体积比为1∶3,混合后4 ℃静置1 h后高速匀浆5 min,现配现用。
1.3 样品处理
将采集的鸽乳样品加入到盛有45 mL无菌生理盐水的三角瓶中,置于摇床中,150 r/min,振荡l h,让鸽乳与生理盐水均匀混合,使产酶微生物悬浮于生理盐水中,振荡结束后静置15 min,备用。
1.4 产纤维素酶微生物的初筛、复筛及发酵
选用刚果红筛选培养基,利用菌周围出现透明圈现象来判断该菌种是否为产纤维素酶的菌种,其透明圈面积大小可以反映其产酶能力的高低。吸取5 mL振荡完毕的悬浮液,无菌接种到盛有45 mL富集培养基的三角瓶中,35 ℃恒温摇床中培养1~2 d,期间观察培养基的富集程度,然后稀释涂布于刚果红筛选培养基,35 ℃恒温培养2 d,期间观察菌落的生长状况,挑选符合预期的菌种进行复筛与纯化。
选取透明圈明显的菌种复筛划线培养2~3次,随后挑选明显的单菌落,无菌操作挑取菌落,一半接种于牛肉膏蛋白胨培养基(斜面保种),另一半继续划线于筛选培养基并使其传代5次以上。随后采用测量相对酶活的方法来评估其是否产酶,对能产生透明圈且酶活性较高的菌落进行鉴定。
挑取复筛分离菌种的单菌落,无菌操作挑入盛有发酵培养基的三角瓶中,150 r/min,37 ℃震荡培养48 h,随后测定产酶活性。
1.5 产脂肪酶微生物的初筛、复筛及发酵
采用溴甲酚紫显色培养基,根据菌种周围出现黄色透明圈,以此判断其为产脂肪酶菌种。吸取5 mL悬浮液,无菌接种到盛有45 mL富集培养基的三角瓶中培养24 h,随后稀释至10-4,各取0.2 mL涂布于溴甲酚紫显色培养基,37 ℃恒温培养48~72 h。观察菌落的生长情况及有无透明圈,并记录。
挑取初筛平板上透明圈明显的菌株进行复筛,划线培养2~3次,观察菌落生长状况,选取周围仍有透明圈的菌种测定酶活力,对能产生透明圈且有较高酶活力的菌落标号,并鉴定。
挑选复筛分离菌的单菌落至装有5 mL种子培养基的试管中,编号,在上述1.4条件下培养18 h之后,取0.5 mL接于4.5 mL发酵培养基试管中,混合均匀并标号,150 r/min,37 ℃,培养48 h后测定脂肪酶酶活。
1.6 酶活力的测定
1.6.1 羧甲基纤维素(CMC)酶活力的测定
CMC酶活力测定方法参考文献[12]:发酵酶液0.5 mL, 1%的CMC 0.5 mL为底物(40 ℃预热10 min),40 ℃保温反应30 min,加入3, 5二硝基水杨酸(DNS)3 mL,沸水浴5 min,冷却后在540 nm下测定吸光值,取3个平行样品(3支样品管、1支空白管)OD值的平均值,根据葡萄糖标准曲线[12]求出葡萄糖含量。1 h内催化底物CMC-Na形成1 mg还原糖所需的酶量为1个酶活力单位。公式:
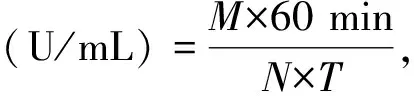
其中,M:根据标准曲线得出产生葡萄糖含量(mg);N:酶液的稀释倍数;T:反应时间。
1.6.2 滤纸酶活力的测定
取1 mL发酵酶液,分别加入pH值为4.8、0.1 mol/L的乙酸-乙酸钠缓冲液1 mL,0.05 g滤纸,40 ℃预热5 min后再保温反应1 h,之后加入DNS 3 mL,沸水浴10 min,流水冷却后在540 nm下测定吸光值,同时灭活发酵液做空白对照;根据吸光值参照葡萄糖标准曲线求出相应的葡萄糖含量,按公式计算:
其中,X:滤纸酶酶活力,单位U/mL;W:葡萄糖的浓度;N:酶液稀释总倍数;T:反应时间;M:样品的体积。
1.7 脂肪酶(LPS)活力测定
LPS活力方法按照LPS试剂盒(购自南京建成生物工程研究所)说明书测定,以U/gprot表示酶活。具体操作如下:分光光度计于420 nm处,1 cm光径玻璃比色皿,用Tris盐酸缓冲液调零;将底物缓冲液37 ℃预温5 min以上;在相应编号的试管中加入50 μL待测发酵液,吸取已预温好的底物缓冲液2 mL冲入试管中,快速混匀,并计时;迅速倒入比色皿中,在分光光度计420 nm处比浊,30 s时读取吸光度值A1;将此比色液倒入原试管中置37 ℃准确水浴10 min,再迅速倒入比色皿中,10 min 30 s时读取吸光度值A2;求出2次吸光度差值(ΔA=A1-A2)。
标准管吸光值(As):样品缓冲液2 mL,生理盐水50 μL,420 nm处比浊,读取吸光值,此值相当于标准管浓度(454 μmol/L)的吸光值。
单位定义:在37 ℃条件下,每1 mL发酵液在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位。计算公式:
1.8 PCR扩增及同源性分析
引物设计及测序工作均由南京金斯瑞生物科技有限公司完成。提取各菌株的基因组DNA,PCR扩增其16S rDNA片段,切胶回收并纯化PCR产物,经测序得到各菌株的16S rDNA序列,在GenBank中作同源性检索并利用MEGA4.0软件分析构建系统发育进化树。
1.9 数据分析
酶活力测定结果取3个样品重复的平均值,以“平均值±标准误”表示。
2 结果
2.1 产酶菌落的形态观察
在筛选培养基上发现了多个生长良好的菌落,通过复筛,最终挑选了4种菌落形态不同且酶活力较高的菌株作为目的菌株,编号XIAN1,XIAN3,XIAN2,XIAN4;产脂肪酶挑选ZHI1作为目的菌株。XIAN1菌落边缘薄中间厚,中间呈白色,不透明,形状圆形或椭圆形,山丘状(图1A);XIAN2的菌落因聚集刚果红而呈现出红色或淡红色,菌落呈颗粒状(图1B);XIAN3在刚果红选择培养基上并不明显,菌落色泽略呈淡黄色(图1C);XIAN4菌落呈白色实心状,圆形,表面光滑,油滴状(图1D);ZHI1在溴甲酚紫培养基上略呈蓝白色,菌落较小(图1E)。
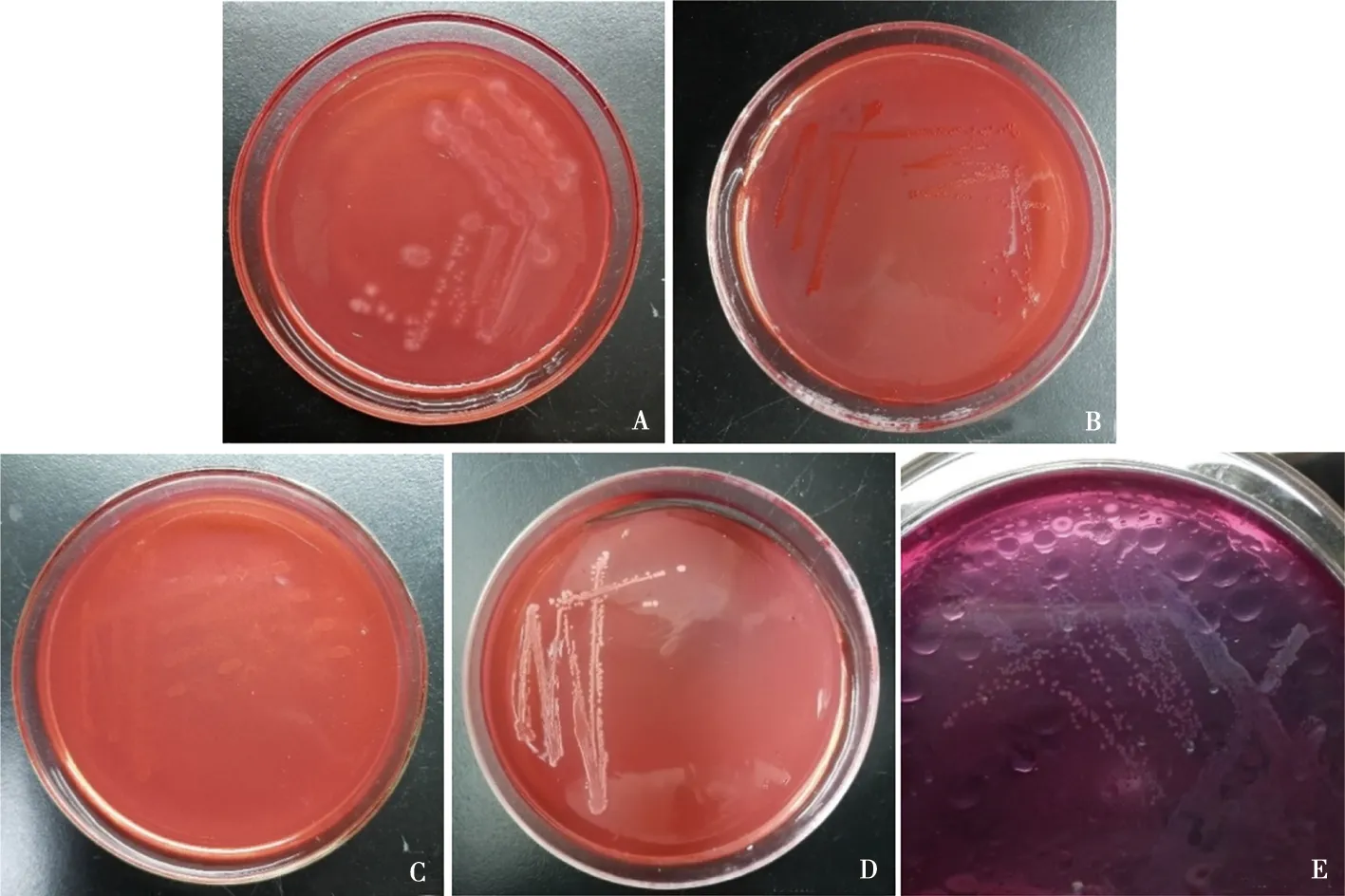
A~D. XIAN1、XIAN2、XIAN3、XIAN4的刚果红培养基观察;E. ZHI1的溴甲酚紫培养基观察
2.2 菌株产酶活力
对筛选分离的产纤维素酶及产脂肪酶共5个菌株分别进行了酶活力测定。结果如表1所示,筛选出的5种菌都具有较好的产酶能力。

表3 酶活力结果
2.3 菌株的PCR扩增
PCR扩增其16S rDNA片段,得到大小1 100 bp左右的DNA片段,如图2所示。
2.4 产酶菌株的测序及同源性比较
结果如图3所示:XIAN1为铜绿假单胞菌(Pseudomonasaeruginosa),XIAN2为大肠杆菌(Escherichiacoli),XIAN3为吉氏库特菌(Kurthiagibsonii),XIAN4为克雷伯氏菌(Klebsiellapneumoniae),ZHI1为变栖克雷伯氏菌(Klebsiellavariicola)。
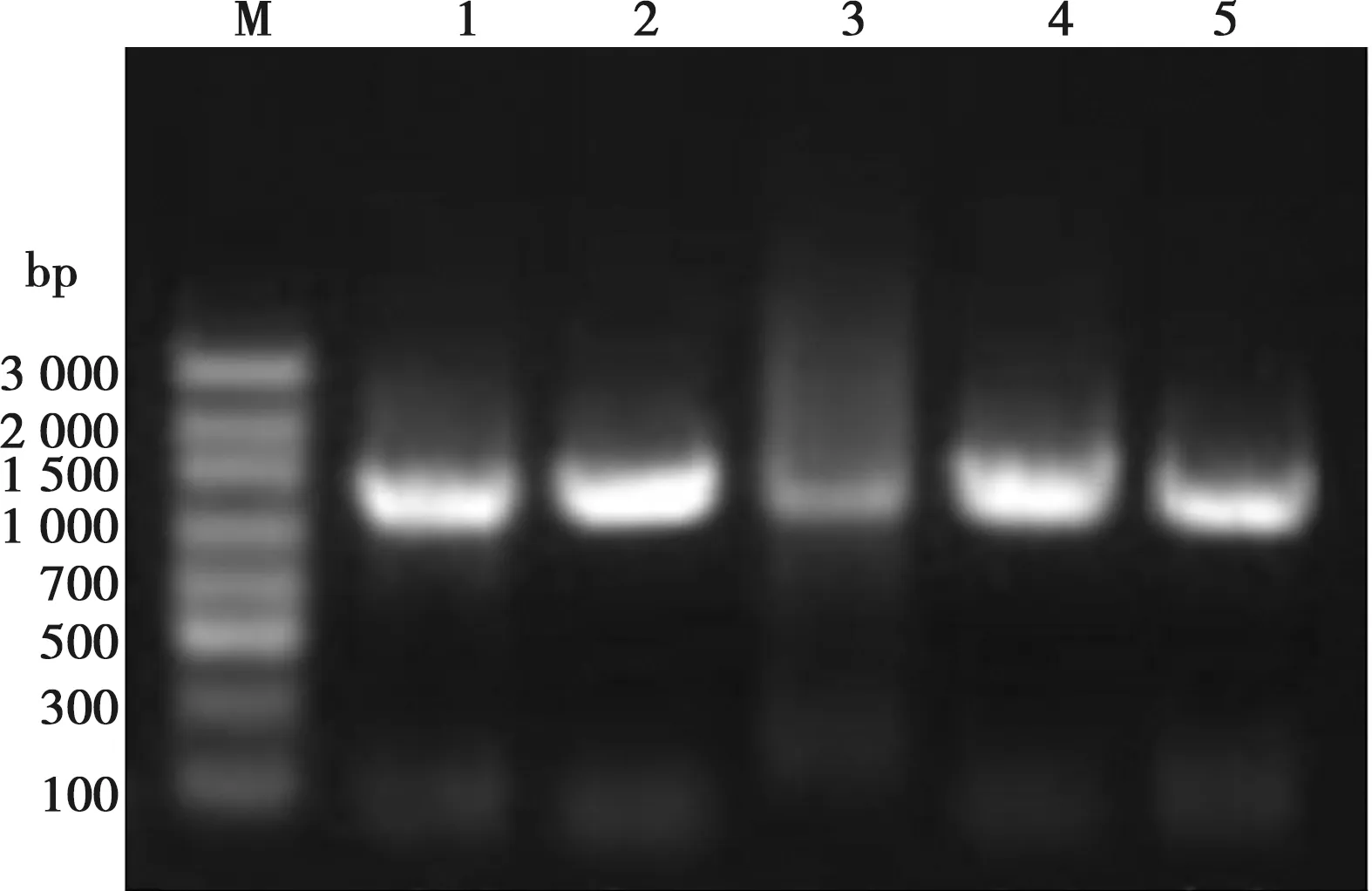
M. Marker; 1. XIAN1;2. XIAN2;3. XIAN3;4. XIAN4;5. ZHI1
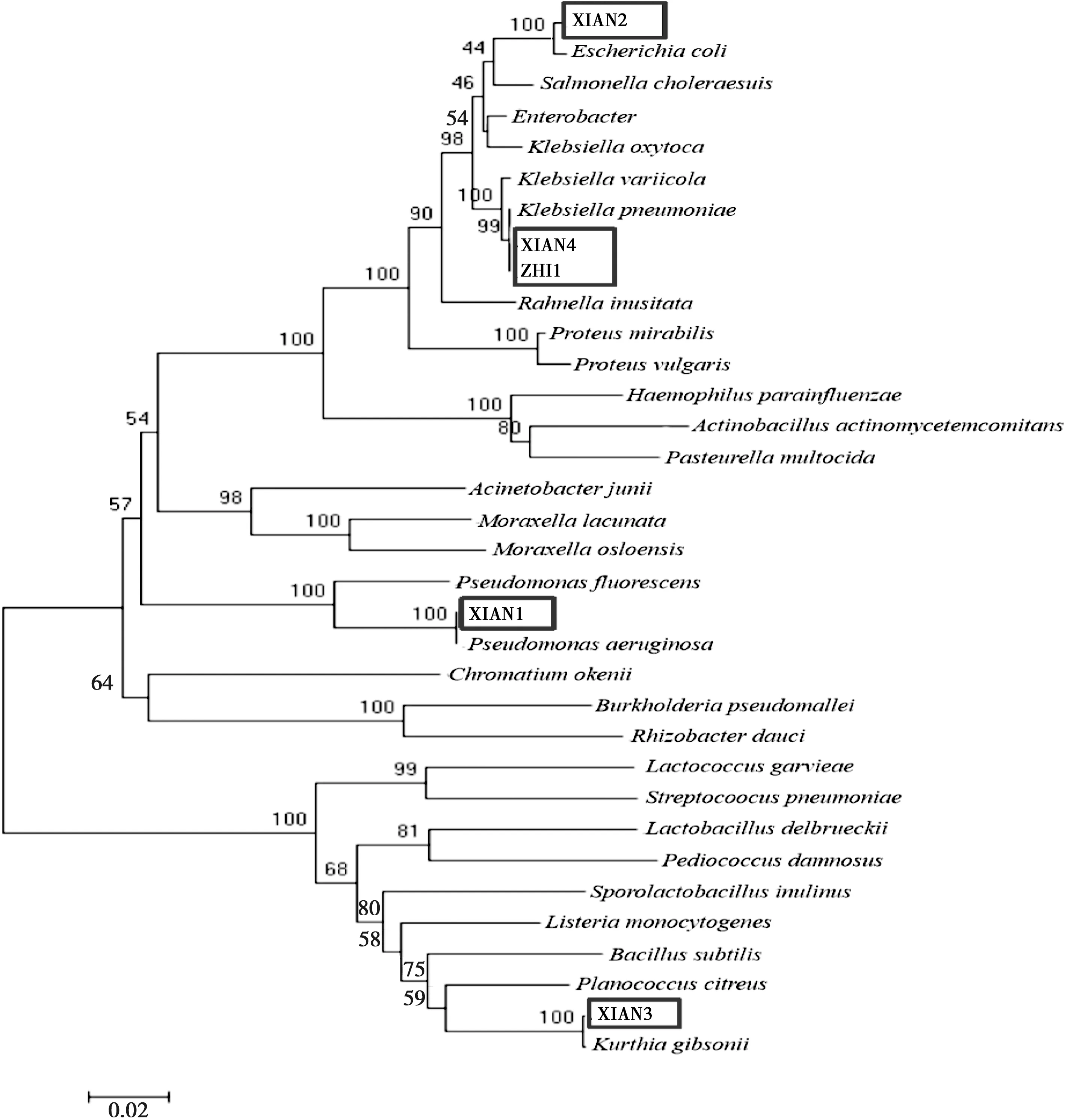
注:比例尺表示该遗传距离下序列之间的差异度为2%,黑色边框为分离的产酶菌
3 讨论
微生物在动物生长代谢的过程中扮演了十分重要的角色,不仅在调节宿主肠道微生物组成和能量摄入方面起着重要作用,其代谢产物还可以调节宿主体内营养代谢平衡、改善宿主肠道内的营养水平以及增强肠上皮屏障功能[14-15]。亲鸽将嗉囊内的鸽乳饲喂给幼鸽的过程中将相关微生物传递给幼鸽,从而有助于幼鸽肠道微生物的建立[3]。人类婴幼儿肠道微生物的建立得益于母乳中的益生元,而 Shetty 等[16]检测到了在第7天的鸽乳中亦存在一类潜在的益生元,并通过试验证实其可使鸡盲肠乳酸菌群发生变化,此外,IgA、IgG等免疫球蛋白广泛存在于鸽乳中,由此可以推测,幼鸽是通过摄入鸽乳建立与调节体内的微生物种群及提高免疫能力。
鸽乳是由哺育期亲鸽的嗉囊上皮细胞脱落所形成的乳酪状物质,并以4 h为周期不断往复形成,随着雏鸽的发育,鸽乳外观及营养成分比例会出现较大变化。本试验筛选分离的产纤维素酶菌种,酶活力相对较低。作者认为这是由于早期鸽乳成分主要为蛋白质和脂肪,以及碳水化合物含量很低的原因,而哺育期后期,其比例逐渐增加[9],产纤维素酶微生物种类和酶活力可能出现不同,这有待于后续进一步研究。而哺育期前期因脂肪含量较高,所以产脂肪酶分离菌的酶活力相对较高。
本试验分离出的XIAN1、XIAN4、XIAN2均为条件致病菌[17]。XIAN1为铜绿假单胞菌,革兰阴性好氧菌,主要通过种蛋污染、皮肤划伤、呼吸道及消化道途径感染宿主,并在一定条件下使其发病[18],如羊群的化脓性肺炎、鸡的败血症等,死亡率在1%~90%以上[19];XIAN4为肺炎克雷伯氏菌,革兰阴性杆菌,兼性厌氧,主要通过消化道传播,可引起哺乳动物肺炎、子宫炎、腹泻等疾病[20];XIAN2为大肠杆菌,是一种自然界常见的肠道寄居菌,在特定条件下可诱发多种动物的肠道感染,尤其鸡、猪对此最为敏感[21],可通过粪便途径传播。21世纪以来,随着养殖业规模的日益扩大,由条件致病菌引起的疾病有愈发严重的趋势,尤其是幼年动物,由于其免疫抵抗能力较弱,更容易感染此类菌,因此,在养殖过程中要加强饲养管理,及时清扫粪便,加强对环境的消毒,保持圈舍清洁卫生,采用优质饲料,保证饲料安全卫生等。
本试验筛选出的产酶菌多为条件致病菌,但在样品来源地实际生产中尚未发现疾病案例。上述产酶菌可能通过酶解底物为自身生存提供必要的能量和营养物质,同时也促进了宿主的消化吸收能力。目前国内有关动物体内产纤维素酶分离菌的报道以芽孢杆菌居多,如朱亚静[22]、张庆芳等[23]分别从鹅肠道及牛瘤胃中分离出高产纤维素酶的芽孢杆菌;韩生义等[24]从牦牛瘤胃中分离出高产脂肪酶的沙雷氏菌,同样为条件致病菌。此外已有研究发现肺炎克雷伯氏菌能够产菊粉酶、果胶酶、普鲁兰酶等[25-27],可见该菌产酶种类具有多样性,而变栖克雷伯氏菌除具有脂肪酶活性之外还具备固氮酶活性[28],虽同属于克雷伯氏菌,但其产酶种类并不完全相同,不同亚种之间基因序列的差异可能是导致这种变化的原因。吉氏库特氏菌具有产纤维素酶能力则为本试验首次发现。此外,本试验测序过程中发现大肠杆菌、肺炎克雷伯氏菌、变栖克雷伯氏菌具有多个突变位点,其产酶能力可能由此致使。
综上,本次试验中所分离出4种产纤维素酶和1种产脂肪酶细菌,其中铜绿假单胞菌、大肠杆菌、肺炎克雷伯氏菌、变栖克雷伯氏菌均为条件致性病菌,对乳鸽的生长发育是否有益及其具体作用还有待于进一步研究,本试验研究将为鸽子肠道微生物种类以及产酶微生物的研究及应用奠定基础。

