单增李斯特菌内化素基因inlG基因原核表达及小鼠免疫保护性分析
刘圆园,曹启航,孙亚楠,委慧玲,薛惠文,苟惠天
(甘肃农业大学动物医学院,甘肃 兰州 730070)
单核细胞增生李斯特菌(Listeriamonocytogenes,简称LM)也称单增李斯特菌,是一种重要的人畜共患病原菌,它主要以食物为传播媒介,是最致命的食源性病原体之一,其致死率高达30%[1-2],对人类安全构成很大威胁。研究显示,已有16种血清型被鉴定出来,主要有3种血清型常见于感染中,分别是谱系Ⅰ中4b型、1/2b型以及谱系Ⅱ中1/2a型菌株[3-4]。LM作为一种胞内寄生菌,能刺激宿主产生免疫应答,并诱导CD8+T和CD4+T特异性细胞免疫应答。CD8+T 细胞可分泌穿孔素、颗粒酶及释放γ干扰素(IFN-γ),CD4+T细胞产生Th1 细胞因子[5-6]。人主要通过粪-口途径感染李斯特菌,同时通过眼睛、黏膜和破损的皮肤也可感染[7-8]。LM入侵宿主细胞的过程极其复杂,涉及致病因子、黏附分子、内化素等多种蛋白分子[9]。
内化素(internalin,Inl)是LM中一个由基因编码的蛋白家族。目前己知有25种内化素,其中InlA和InlB为最早鉴定出的与细菌侵袭相关的内化素蛋白[10]。它们与LM毒力有着密切的关系,是参与细菌入侵宿主细胞的主要因子,其功能是对宿主的黏附、侵袭作用[11]。InlA通过与宿主的特异性受体E-cad相互作用来介导LM内化入上皮细胞内,使LM内吞而进入宿主的上皮细胞[12-13]。InlB可以与宿主细胞表面多种受体作用介导LM黏附、侵袭肝细胞及非吞噬细胞[14]。目前,研究表明仅有部分内化素在介导LM入侵时起作用[15-17]。Balandyte等[18]研究发现,InlG蛋白主要存在于环境分离菌株中,很少存在于LM临床分离的人和动物源菌株中,表明InlG在LM适应宿主外环境和生存息息相关;InlG属于大分子量的内化素,C端是含有LPXTG 结构的内化素,通过碳末端与细菌细胞壁相连,其基因的表达不受prfA的控制。有研究结果显示InlGHE基因簇的缺失导致对小鼠肝脏和脾脏的定植能力降低,细菌毒力显著性下降,表明基因簇与细菌致病力相关[19]。蒋建军[20]从133株单增李斯特菌分离株中研究发现InlG在谱系Ⅰ中不存在,谱系Ⅱ、Ⅲ中分别为74.2%和30.7%。胡杨峰[21]从分离的236株单增李斯特菌中发现inlG基因占41.1%。关于inlG基因在LM的致病力方面的研究较少,其功能需要进一步验证。因此,本试验以LM为材料,克隆inlG基因后进行测序比对,构建重组原核表达质粒,诱导表达蛋白,并免疫小鼠后以LM攻毒,评价免疫效果,旨在为进一步研究inlG基因功能奠定基础。
1 材料与方法
1.1 菌株、培养基、实验动物及血清
LM标准菌ATCC19111(禽源)购于中国普通微生物菌种保藏中心 (中国,北京),原核表达载体pET-28a(+)由本实验室保存,兔抗LM阳性血清由本实验室制备,7周龄昆明雄性小鼠购于兰州兽医研究所动物中心,脑心浸出液肉汤培养基(BHI)购自北京Solarbio科技有限公司,大肠杆菌DH5α、BL21(DE3)感受态细胞购自北京全式金生物技术有限公司。
1.2 主要试剂
细菌基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒提取试剂盒、DNA Marker、TMB底物显色液均购自天根生化科技(北京)有限公司;pMD19-T载体、限制性内切酶EcoRⅠ、HindⅢ和T4 DNA Ligase均购自TaKaRa公司;预染蛋白分子质量标准购自赛默飞世尔科技(中国)有限公司;弗氏完全佐剂、弗式不完全佐剂购自Sigma公司(美国);超敏ECL化学发光试剂盒、辣根过氧化物酶标记的羊抗鼠IgG(IgG-HRP)、辣根过氧化物酶标记的羊抗兔、BCA蛋白定量试剂盒购于碧云天生物技术有限公司;胰蛋白胨和酵母提取物均购自OXOID公司(英国)。其余试剂皆为国产分析纯产品。
1.3 引物设计与合成
参照GenBank中公布的inlG基因序列,设计inlG基因的特异性引物,其中InlG-F为上游引物,下划线部是EcoRⅠ的酶切位点。InlG-R为下游引物,下划线部位是HindⅢ的酶切位点,上游引物序列为:5′-CCGGAATTCATGAAACAGAGAAAAACCTCAGTA-3′;下游引物序列为:5′-CCCAAGCTTTTAAATGTTAGTAGTTTTTTTTCG-3′,扩增片段预期大小为1 473 bp。引物由金唯智生物公司合成。
1.4 目的基因扩增
将-80 ℃冻存的标准株LM在BHI固体培养基四区划线培养,挑取单个菌落培养12~14 h,提取基因组。已提取LM基因组为模板,设计合成的上游引物InlG-F、下游引物InlG-R扩增基因inlG片段。反应体系为:上、下游引物各1 μL、基因组1 μL、ddH2O 9.5 μL、2×PCR Mix 12.5 μL,总体积25 μL。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,35个循环;72 ℃最终延伸10 min。扩增产物经1.0%琼脂糖凝胶电泳检测,用DNA胶回收试剂盒回收inlG基因片段,与pMD19-T在16 ℃过夜连接,后转化至大肠杆菌DH5α中培养,筛选阳性克隆送金唯智生物公司测序。
1.5 构建重组表达质粒
将pMD19-T-InlG经EcoRⅠ与HindⅢ双酶切后回收inlG基因,pET-28a(+)经双酶切后回收,连接转化至大肠杆菌DH5α中培养,挑取单个菌落鉴定阳性的重组质粒。
1.6 重组蛋白的诱导表达与纯化
pET-28a(+)-InlG转化至大肠杆菌BL21(DE3)中,在卡那抗性的LB固体培养板上恒温培养,挑取单个菌落振荡培养14~16 h,以一定比例接种于5 mL液体培养基中,37 ℃培养至OD600为0.6~0.8时,加入1.0 mmol/L的IPTG诱导6 h,收集诱导后的菌液经SDS-PAGE分析重组蛋白表达情况。
1.6.1 重组蛋白表达条件优化
分3组优化表达条件:将菌液接种到液体培养基中,加入不同浓度诱导剂(0.5、0.7、0.9、1.0和1.2 mmol/L的IPTG),37 ℃诱导表达6 h;不同温度(16、28、30和41 ℃)诱导表达14 h;不同时间(6、8、10、12和14 h)诱导表达,分别收集处理诱导并超声后的样品。将上清和沉淀样品处理后经SDS-PAGE,分析蛋白表达形式。
1.6.2 表达产物的纯化
将诱导表达后的菌液处理、SDS-PAGE后,考马斯亮蓝染色,表达后的蛋白切胶条送往上海鹿明生物科技有限公司进行质谱鉴定。质谱鉴定后应用Ni-NTA亲和纯化层析柱纯化目的蛋白(操作参照试剂盒说明),SDS-PAGE分析表达纯化结果。
1.7 表达产物的Western blot鉴定
经SDS-PAGE分离后,切胶移至NC膜上,90 V湿转60 min后,用PBST洗涤NC膜3次后,LM兔阳性血清用PBST按1∶1 000稀释,将NC膜转移到稀释好的血清里37 ℃孵育1 h;用PBST洗涤3次后,加入稀释好的1∶5 000的羊抗兔IgG,于37 ℃放置2 h,最后用化学发光试剂盒显色。以诱导前的全菌作为阴性对照。
1.8 小鼠免疫及攻毒试验
1.8.1 LM对小鼠的半数致死量(LD50)测定
将LM在BHI培养基中划线,挑取单个菌落培养,测定OD600为1.0时,收集菌体用灭菌生理盐水洗涤3次后,调至不同浓度进行平板计数。昆明小鼠60只,6~8周龄均为雌性,随机分成6组,即:5个剂量组和1个对照组,每组10只。不同浓度菌分别腹腔注射小鼠,每只小鼠注射0.1 mL,感染小鼠菌量分别为1.0×109、1.0×108、1.0×107、1.0×106和1.0×105CFU/只,对照组小鼠注射同等体积灭菌生理盐水,在注射后不同时间段对小鼠进行观察。通过寇氏法计算LM对小鼠的LD50。
1.8.2 小鼠免疫及抗体效价测定
将7周龄雄性健康小鼠随机分为试验组和对照组,每组16只。纯化的InlG蛋白定量加弗氏完全佐剂乳化后,以100 μg/只的剂量多点皮下注射试验组小鼠,每只小鼠注射0.2 mL,对照组注射等体积的生理盐水,2组小鼠于相同条件下饲喂14 d后,试验组改为弗氏不完全佐剂加强免疫1次,免疫方法、剂量同第1次免疫;免疫后小鼠断尾采血,分离血清,检测效价。以InlG蛋白作为抗原包被于酶标板,利用间接ELISA方法检测小鼠抗体水平。
1.8.3 攻毒试验
测定效价后,用2 LD50的LM进行攻毒,LM经灭菌生理盐水洗涤3次,制备成菌悬液后腹腔注射给小鼠,观察记录小鼠精神状态,统计各组小鼠的存活率。
2 结果
2.1 inlG基因的扩增
琼脂糖凝胶电泳检测,PCR产物大小为1 473 bp,与预期相符(图1)。

M.DNA分子质量标准;1. inlG基因;2.阴性对照
2.2 重组表达载体的鉴定
重组表达载体pET-28a(+)-InlG经EcoRⅠ与Hind Ⅲ双酶切后,琼脂糖凝胶电泳分析得到,双酶切后有约5 400 bp的载体条带和1 473 bp的目的条带,大小与预期结果相符(图2)。
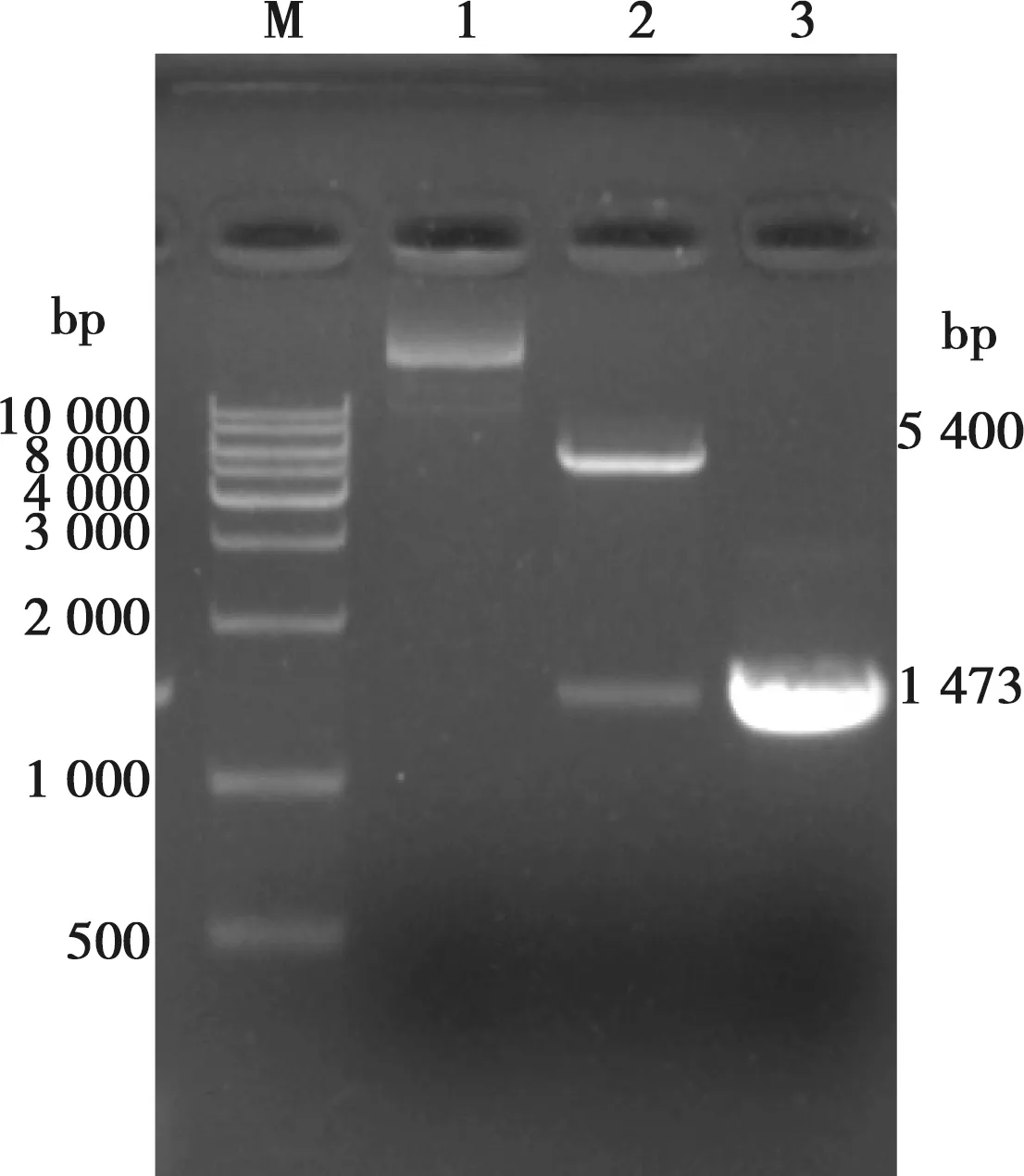
M. DNA分子质量标准;1. pET-28a(+)-InlG;2. pET-28a(+)-InlG的双酶切产物;3. inlG基因
2.3 重组蛋白表达产物的鉴定
经IPTG诱导后,收集处理菌体,经SDS-PAGE,在70 ku处有蛋白条带,诱导前的pET-28a-InlG菌液处理后未出现蛋白条带。pET-28a-InlG优化表达条件后,经SDS-PAGE分析(图3),IPTG终浓度为1.0 mmol/L时,37 ℃诱导表达6 h后,表达量较高,表达产物主要为可溶性蛋白。

M. 预染蛋白质分子质量标准;1. pET-28a-InlG诱导前全菌;2. pET-28a-InlG诱导后全菌;3. pET-28a-InlG诱导后上清;4. pET-28a-InlG诱导后沉淀;5. 纯化后的重组蛋白
预测InlG蛋白分子量约为53 ku,但经SDS-PAGE可见大小约70 ku,与理论预期不符。诱导表达的蛋白切胶条质谱鉴定结果与LM参考序列比对,其覆盖度和得分都比较高,肽段覆盖率可达79%,可进行下一步试验。
2.4 重组蛋白的反应原性分析
以LM阳性血清为一抗,羊抗兔IgG为二抗,结果显示诱导后蛋白与LM阳性血清反应出现特异性条带,未诱导的全菌未出现条带(图4),说明重组蛋白具有良好的反应原性。

M. 蛋白质分子质量标准;1. pET-28a-InlG诱导前全菌;2. pET-28a-InlG诱导后全菌
2.5 单增李斯特菌的LD50测定
不同剂量LM菌液注射小鼠后,根据每组小鼠死亡数计算死亡率(表1),根据寇氏法计算出LM的LD50为1.0×106.6CFU。

表1 小鼠半数致死量测定
2.6 小鼠攻毒试验
InlG重组蛋白为包被抗原,间接ELISA检测InlG蛋白免疫小鼠的抗体效价可达1∶52 000以上。LM腹腔感染小鼠后,对照组小鼠被毛粗糙、扎堆、精神萎靡,个别小鼠逐渐出现颤栗、眼角分泌物增多、呼吸频率加快和耳朵出血症状,15只小鼠72 h内陆续死亡,1只小鼠存活,存活率为6.25%。试验组中8只小鼠出现相似症状并陆续死亡,另外8只小鼠于攻毒后48 h开始恢复正常并存活下来,存活率为50%。
3 讨论
LM是重要的食源性人兽共患病原菌,其致病性与毒力因子相关。LM可穿越感染宿主的3道屏障,即肠道屏障、血脑屏障和胎盘屏障,感染过程与多种毒力因子和酶有关,如:内化素、p60蛋白、表面蛋白p104、纤连蛋白结合蛋白A、酰胺酶(Ami)、自溶素(Auto)等[22]。因此,研究与LM内化素相关毒力因子,对了解LM的致病原理和李斯特菌病的防治具有重要意义。
inlG基因编码490个氨基酸,预测分子量约为53 ku,经SDS-PAGE检测发现InlG蛋白约为70 ku,与预期相差17 ku,但InlG蛋白经质谱鉴定后,质谱结果与LM参考序列覆盖度和得分都比较高。蛋白质电泳结果大小和预测值存在偏差,分析可能与预染蛋白分子质量标准在不同浓度SDS-PAGE条件下蛋白分离的效率有关。蛋白经水煮变性处理后会形成棒状结构,表面均匀吸附离子,大小不同的蛋白形成相应的“棒状”体,SDS-PAGE时通过分子筛和电荷效应被分离。实际上,不同的蛋白由于氨基酸组成等原因,并不符合这一基本假设,因此有时会出现如上偏差。
用2 LD50的LM(1×108CFU)活菌腹腔感染小鼠,试验组16只小鼠死亡8只。分析小鼠死亡原因,试验中LM菌株是致病性较强的1/2a血清型,另外也可能与InlG蛋白免疫小鼠后产生的保护力不够有关。本试验只选取内化素家族的单个InlG进行免疫保护性研究试验。吴金花等[23]构建了奶牛乳腺炎无乳链球菌sip、pgk及fbsA基因主要抗原区域的融合表达,融合表达蛋白可具备Sip、Pgk及FbsA蛋白的三重活性,而且在小鼠的攻毒保护性试验中,重组融合抗原对攻毒小鼠的保护优于单个蛋白。姜秀云等[24]研究发现牛分枝杆菌mpb51与mpb70基因融合一起,纯化的融合蛋白比单一蛋白具有更高的抗原反应性。下一步可将内化素家族具有优势抗原表位的基因进行串联表达,研究串联基因表达的蛋白是否具有良好的抗原性。虽然InlG蛋白具有一定的抗原保护性,但在本试验中未与其他内化素(InlA和InlB等)的保护性进行比较,InlG蛋白是否有黏附、侵袭等特性还有待进一步研究。
综上,本研究成功表达出LM的InlG蛋白,该蛋白具有良好的反应原性。重组蛋白制备成亚单位疫苗免疫小鼠,小鼠能产生较高滴度的抗体,表明InlG蛋白具有良好的免疫原性,且对小鼠有一定的免疫保护性。研究结果为探讨inlG基因生物学功能和李氏杆菌病的防控奠定基础。

