新型鹅星状病毒ORF2基因的原核表达及多克隆抗体的制备
张硕,谢军,顾玲玲,方馨慧,嵇珊珊,陶静,朱善元*,陈丽,王安平*
(1. 江苏海洋大学食品科学与工程学院,江苏 连云港 222005;2. 江苏海洋大学江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;3. 江苏农牧科技职业学院江苏省兽用生物制药高技术研究重点实验室,江苏 泰州 225300;4. 江苏海洋大学江苏省海洋资源开发研究院,江苏 连云港 222005)
星状病毒是一种无囊膜、单股、正链RNA病毒,病毒衣壳呈二十面体结构对称,直径约30 nm,全长约6.1~7.9 kb。基因组包括5′非翻译区、3′非翻译区、3个开放的阅读框(ORF1a、ORF1b、ORF2)和1个多聚腺氨酸poly A尾[1]。3个开放的阅读框分别编码非结构蛋白、RNA依赖RNA聚合酶和衣壳蛋白。其中ORF2阅读框编码的病毒衣壳蛋白是病毒的抗原决定蛋白,能刺激机体产生免疫应答,是诱导机体产生保护性抗体的主要抗原[2]。
近年来,我国华北、华中、华南等多地鹅场暴发了一种以关节痛风和内脏痛风为主要特征的致死性传染病[3-5]。该病主要侵害5~20日龄的雏鹅,病鹅内脏器官表面及关节腔内部会产生大量白色尿酸盐沉积,死亡率可高达50%,对我国养殖业经济发展造成了严重的威胁[6-11]。造成鹅痛风的原因有很多,如:饲料蛋白水平不均衡、饲养环境不佳、肠道菌群失衡或星状病毒感染等[12-13]。但是在一些饲喂合理、环境温暖、干燥、保温性能好、空气流通、养殖密度合适的鹅场依然会出现痛风现象,因此怀疑此种痛风是由一种新型鹅星状病毒(goose astrovirus, GAstV)感染引起的[14-17]。
近年来国内外关于新型鹅星状病毒的报道逐渐增多,如目前已报道的分离株SD01、SDPY、JSHA株等[9, 18-19]。张清水[2]利用SD01毒株进行了健康雏鹅感染试验,Yang等[16]通过NGS技术对SDPY株进行全基因组测序,徐蓉等[9]验证了该毒株可感染鹅胚肾脏上皮细胞,姜胜男等[18]对山东部分地区新型鹅星状病毒ORF2基因进行了扩增并绘制了遗传进化树,但均未对星状病毒及其结构或功能蛋白进行更加深入的研究。本研究利用大肠杆菌表达系统表达新型鹅星状病毒结构蛋白ORF2基因,制备其多抗血清,为新型鹅星状病毒检测方法的建立及相关功能研究奠定基础。
1 材料与方法
1.1 病毒、菌种与细胞
本实验室自行分离鉴定的新型GAstV毒株YC20,GenBank序列号为MW536497;鹅抗GAstV阳性血清为此病毒攻毒雏鹅后康复鹅血清;10日龄鹅胚购于江苏省金鹏鹅业有限公司;pET-30a载体、鸡肝癌细胞(LMH)由江苏省兽用生物制药高技术研究重点实验室保存;大肠杆菌DH5α和BL21(DE3)感受态细胞购于大连TaKaRa公司。
1.2 酶类和试剂
核酸提取试剂盒、反转录酶、限制性内切酶BamHⅠ、XhoⅠ及T4 DNA连接酶、DNA胶回收试剂盒均购自大连TaKaRa公司;质粒抽提试剂盒、His柱纯化试剂盒、His组氨酸单抗、DAB显色试剂盒均购自康为世纪公司;辣根过氧化物酶(HRP)标记的羊抗鼠IgG、HRP标记的羊抗鸭IgG、HRP标记的山羊抗兔IgG、荧光素标记的山羊抗兔IgG购自美国KPL公司。
1.3 引物设计与合成
根据GenBank中公布的新型GAstV基因组序列,设计1对针对ORF2基因序列的特异性引物,由上海英潍捷基生物技术有限公司合成。引物序列为:GAstV-F:5′-TAAGGATCCATGGCAGACAGGGCGGTGGC-3′(下划线为BamHⅠ酶切位点);GAstV-R:5′-ATACTCGAGTCACTCATGTCCGCCCTTCTC-3′(下划线为XhoⅠ酶切位点)。
1.4 病毒增殖与RNA提取
取新型GAstV YC20 经尿囊腔接种10日龄鹅胚,弃去24 h内死亡的鹅胚,并在接种5 d后收取鹅胚尿囊液。参考核酸提取试剂盒说明书提取尿囊液总RNA,-80 ℃保存备用。
1.5 ORF2基因的扩增
根据RT-PCR反转录试剂盒说明书进行反转录操作,RT的程序为:37 ℃ 15 min,85 ℃ 5 s,4 ℃保存。PCR反应程序为:98 ℃预变性3 min;98 ℃变性10 s,54 ℃退火15 s,72 ℃延伸2 mim,35个循环后12 ℃保存。PCR产物经0.8%琼脂糖凝胶电泳检测。
1.6 重组表达载体pET30a-ORF2的构建
将PCR产物经0.8%琼脂糖凝胶电泳分离后,按胶回收试剂盒的说明书回收目的片段,经BamHⅠ、XhoⅠ双酶切回收后,与同样经过BamHⅠ、XhoⅠ酶切的pET-30a质粒22 ℃连接1 h。连接产物转化大肠杆菌DH5α感受态细胞,涂布于含有100 μg/mL卡那青霉素(Kan)的LB琼脂平板上,37 ℃培养过夜。随机挑取疑似单菌落,经PCR鉴定后提取质粒,进行琼脂糖凝胶电泳筛选,并用BamHⅠ、XhoⅠ双酶切进行鉴定。鉴定结果正确后送至江苏金唯智生物技术有限公司测序,测序正确的克隆命名为pET30a-ORF2。
1.7 pET30a-ORF2蛋白的诱导表达及可溶性分析
将鉴定正确的pET30a-ORF2重组质粒转化至大肠杆菌BL21(DE3)感受态细胞,挑取单菌落接种于新鲜含100 μg/mL卡那抗性的LB液体培养基中,37 ℃培养过夜。次日将过夜培养物按1∶100接种于5 mL含卡那抗性的LB液体培养基中,37 ℃震荡培养至OD600值为0.6~1.0之间时,加入1 mol/L的IPTG进行诱导,使IPTG终浓度为1 mmol/L,置于37 ℃摇床继续震荡培养3~5 h,离心收集菌体,沉淀溶于200 μL PBS中,超声波裂解后离心,分别收集上清及沉淀,于-20 ℃保存备用。同时设置pET-30a载体质粒转化BL21(DE3)感受态细胞同步诱导作为空白对照。
1.8 pET30a-ORF2蛋白的鉴定
诱导后,取100 μL菌液与100 μL 2×SDS上样缓冲液混匀后,沸水煮沸3 min,进行SDS-PAGE分析。同时转印至PVDF膜上,4 ℃、0.05 g/mL脱脂奶粉封闭过夜,分别以His组氨酸单抗(1∶1 000)、鹅抗GAstV阳性血清(1∶100)为一抗,37 ℃孵育2 h,以HRP标记的羊抗鼠(1∶5 000)、HRP标记的羊抗鸭(1∶5 000)为二抗,37 ℃孵育2 h,DAB显色试剂盒进行显色观察。
1.9 pET30a-ORF2重组蛋白的纯化
按上述1.7的方法重新诱导菌液100 mL,4 ℃、12 000 r/min离心10 min收集菌体,加入2 mL PBS,超声处理10 min,超声后收集上清,按照His柱标签蛋白纯化试剂盒说明书进行纯化操作,以200 mmol/L咪唑缓冲液进行洗脱,将洗脱液进行SDS-PAGE鉴定。
1.10 pET30a-ORF2多克隆抗体的制备
参照文献[19]制备多克隆抗体血清,将上述纯化的pET30a-ORF2重组蛋白,以背部皮下多点注射家兔,每只家兔免疫的蛋白量为300 μg,每隔2周免疫1次,前2次免疫后的第7天进行采血,第3次免疫后的第14天采血,分离血清,-20 ℃保存备用。
1.11 多克隆抗体的鉴定
1.11.1 Western blot鉴定
将表达的融合蛋白样品和空载体pET-30a经SDS-PAGE后,转印到PVDF膜上。4 ℃、0.05 g/mL脱脂奶粉封闭过夜,以制备的家兔多抗血清为一抗(1∶100),37 ℃孵育2 h,以HRP标记的山羊抗兔为二抗(1∶5 000),37 ℃孵育2 h,DAB显色。
1.11.2 间接免疫荧光(IFA)鉴定
参考文献[20-21],将分离得到的GAstV尿囊液感染LMH细胞,在感染48 h后弃去上清,PBS洗涤2次,用预冷的固定液(丙酮∶乙醇=3∶4)4 ℃固定5 min,PBS洗涤2次,以制备的家兔多抗血清为一抗(1∶100),37 ℃孵育2 h,PBS洗涤2次,以荧光素标记的山羊抗兔IgG为二抗,37 ℃孵育1 h,PBS洗涤2次后置于荧光倒置显微镜下进行观察。同时以未接种的LMH细胞作为阴性对照。
2 结果
2.1 ORF2基因的克隆
以新型GAstV尿囊液为模板进行PCR,经0.8%琼脂糖凝胶电泳,出现1条约2 100 bp大小的特异性条带(图1),与预期相符。

M.DNA分子量标准;1. PCR扩增产物
2.2 重组表达载体pET30a-ORF2的构建与鉴定
将克隆的重组表达载体pET30a-ORF2经BamHⅠ、XhoⅠ双酶切后得到约2 100 bp和5 400 bp 2个条带(图2),与预期结果相符,且DNA测序结果证明ORF2基因克隆正确。
2.3 pET30a-ORF2蛋白的诱导表达
将重组菌pET30a-ORF2用IPTG进行诱导表达,并以pET-30a载体质粒转化大肠杆菌BL21(DE3)感受态细胞同步诱导作为对照。SDS-PAGE显示,IPTG浓度为1 mmol/L,37 ℃诱导6 h,重组蛋白可以得到较高水平的表达,上清和包涵体中均存在。重组蛋白的相对分子质量约为84 kDa(图3),与理论值相符。Western blot结果显示,His组氨酸单抗(图4)、鹅抗GAstV阳性血清(图5)均能对重组蛋白特异结合。

M.DNA分子量标准;1. 质粒pET-30a BamHⅠ、XhoⅠ双酶切;2. 质粒pET30a-ORF2 BamHⅠ、XhoⅠ双酶切

M.蛋白质分子量标准;1. pET-ORF2重组蛋白未诱导破碎上清;2. pET-ORF2重组蛋白未诱导破碎沉淀;3. pET-ORF2重组蛋白诱导破碎上清;4. pET-ORF2重组蛋白诱导破碎沉淀
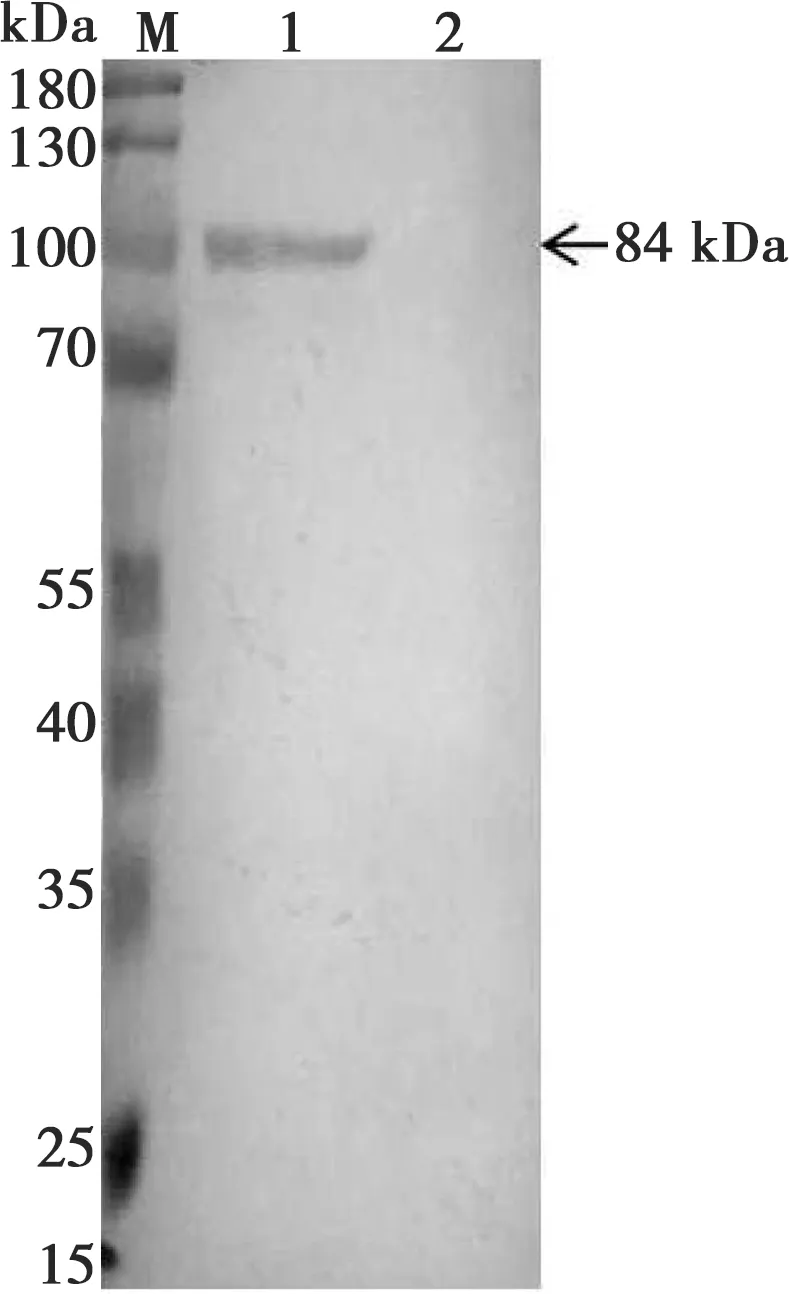
M.蛋白质分子量标准;1. pET30a-ORF2重组蛋白;2. pET-30a诱导产物

M.蛋白质分子量标准;1. pET-30a载体质粒;2. pET-ORF2重组蛋白
2.4 多克隆抗体的鉴定
2.4.1 Western blot鉴定
通过Western blot对制备的兔多抗血清进行鉴定,结果显示(图6),在分子量约84 kDa处出现特异条带,空白对照未出现,说明制备的兔多抗能与ORF2重组蛋白发生特异性反应,具有良好的反应原性。
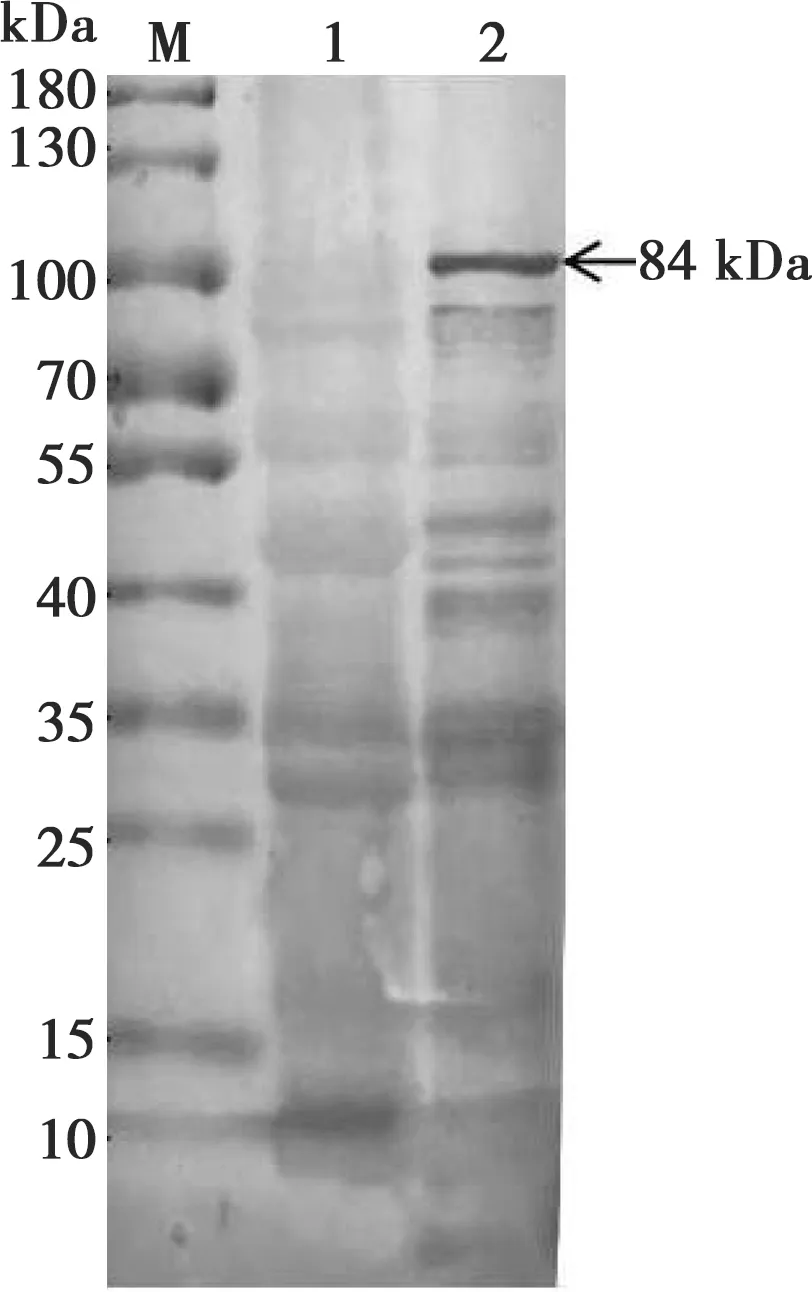
M. 蛋白质分子量标准;1. pET-30a诱导产物;2. pET-ORF2表达的融合蛋白
2.4.2 IFA鉴定
通过IFA对制备的兔多抗血清进行鉴定,结果显示,新型GAstV尿囊液感染的LMH细胞中有大量特异性免疫荧光(图7A),而未感染对照组未出现(图7B),说明制备的兔多抗血清能与GAstV尿囊液发生特异性结合。
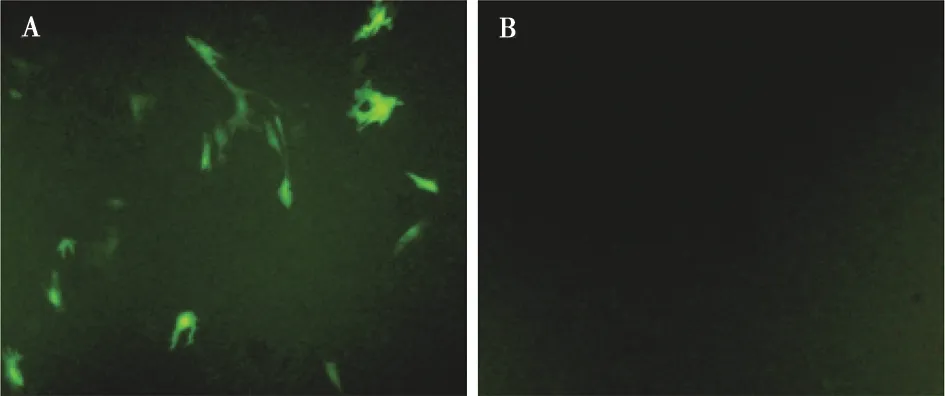
A.感染新型GAstV的LMH细胞;B. 未感染新型GAstV的LMH细胞
3 讨论
近年来,鹅痛风已成为影响鹅场生产的主要疾病之一。越来越多的研究证明鹅星状病毒是导致鹅痛风的主要原因之一,且鹅星状病毒又分为不同基因型,2018年后流行的主要为新型鹅星状病毒[11]。ORF2基因编码星状病毒的衣壳蛋白,该蛋白在病毒入侵宿主细胞、病毒粒子包装等过程中起关键作用,且可以刺激机体产生免疫应答,参与宿主的免疫反应[2]。由于鹅星状病毒的研究相对较晚,目前还没有成熟的鹅星状病毒检测用血清学方法及防控用生物制品。鹅星状病毒感染日益严重,迫切需要建立检测鹅星状病毒抗原抗体的检测方法,监测鹅星状病毒在鹅群中的感染情况。本试验以本实验室自行分离的新型鹅星状病毒YC20为模板,用pET原核表达系统表达重组蛋白ORF2。重组蛋白不仅能被组氨酸单抗特异识别,也能与鹅抗GAstV阳性血清发生特异性反应。由于无抗鹅二抗商品出售,本试验用抗鸭二抗代替,取得了较好的反应结果。以上说明,本试验表达的重组蛋白ORF2具有良好的反应原性,可以用作血清学检测的抗原。
原核系统表达的外源蛋白,虽然缺少翻译后加工,但依旧保持完整的抗原性,可以用于特定蛋白抗血清的制备。本试验将原核表达重组蛋白纯化后免疫家兔,制备多抗血清。Western blot和IFA结果均证明该血清不仅能与重组蛋白发生特异性反应,也能特异性结合新型鹅星状病毒。以上说明制备的多抗具有良好的反应原性,能特异性识别新型鹅星状病毒,将来可以用于检测抗原的血清学方法的探索。
本研究通过大肠杆菌原核表达系统成功表达了新型鹅星状病毒结构蛋白ORF2,并制备了多抗血清,均具有良好的免疫原性和反应原性,为鹅星状病毒检测方法的建立及疫苗的研发奠定了基础。至于表达的重组蛋白及制备的多抗,能否与传统的鹅星状病毒抗原抗体发生交叉反应,能否起交叉保护作用,还需要进一步开展研究。

