猪δ冠状病毒RBD蛋白在昆虫细胞中的表达
张爽,郝鹏飞,伊立超1,,姜宇航,郝嘉翼,李乐天,时小双,徐鹏,金宁一,贾立军,李昌*
(1. 延边大学农学院,吉林 延吉 133000;2. 中国农业科学院长春兽医研究所/中国医学科学院人兽共患病毒病防控关键技术研究创新单元,吉林 长春 130122)
猪δ冠状病毒(porcine delta corona virus,PDCoV)是套式病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒亚科(Coronavirinae)、δ冠状病毒属(Deltacoronavirus)成员[1],是近年来新发现的一种猪肠道致病性冠状病毒,可以感染各年龄段猪群,哺乳期仔猪最易感。临床症状表现为急性水样腹泻、呕吐、脱水等[2],具有较强的致病性,哺乳仔猪感染后死亡率可高达30%~40%[3]。PDCoV在2012年由Woo等[4]在我国香港家猪的粪便样本中首次发现,2014年在美国俄亥俄州腹泻仔猪和母猪的粪便中再次检测到PDCoV,并迅速波及美国多洲及加拿大部分地区。之后在韩国、中国大陆、日本、越南、泰国等地也检测到了PDCoV毒株,对世界养猪业造成重大经济损失[5-9],但目前关于PDCoV的致病机制及其与宿主细胞的相互作用关系仍不是很清楚。
PDCoV是一种有囊膜的单股正链RNA病毒,基因组大小约为25.4 kb,其病毒粒子直径约为60~180 nm,呈球形或椭圆形,外层有冠状纤突囊膜包裹,整体呈“皇冠”状[10]。与其他冠状病毒一样,PDCoV由4种主要结构蛋白构成:即刺突蛋白(spike protein,S)、包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)、核衣壳蛋白(nuecleocapsid protein,N)。其中S蛋白是Ⅰ型跨膜糖蛋白,能够介导细胞黏附、促进病毒与细胞膜融合,从而介导病毒入侵,此外S蛋白还能介导某些中和抗体的产生。S蛋白包括S1和S2两个部分,S1主要负责与受体细胞的识别与结合,S2则与膜融合相关。冠状病毒受体结合结构域(receptor-binding domain,RBD)是S1区域高度保守的一段序列,位于其结构域残基的318~510处[11],理论上RBD结合功能性受体(ACE2)的亲和力高于完整S1结合功能受体的亲和力[12],RBD区域决定病毒的宿主范围及嗜性,也是影响病毒与受体之间相互作用的重要因素。
目前尚无有效的药物和疫苗针对PDCoV,因此,本试验以PDCoV受体结合结构域RBD蛋白为研究对象,通过Bac-to-Bac杆状病毒表达系统表达RBD蛋白,为今后PDCoV的诊断和新型疫苗研究奠定基础。
1 材料与方法
1.1 质粒、菌株及细胞
杆状病毒双表达载体pFastBacTM、DH10 Bac感受态大肠杆菌购自Thermo Scientific公司;SF9昆虫细胞由中国农业科学院长春兽医研究所保存。
1.2 主要试剂
昆虫细胞培养基SF900 Ⅱ SFM购自GIBCO公司;转染试剂CellfectinTMⅡ Reagent购自Thermo Fisher公司;2×PCR mix buffer、T4-DNA连接酶、DNA Marker、Trans1-T1感受态细胞均购自大连TaKaRa公司;pFastBacTM双载体、EcoRⅠ、XbaⅠ均购自Thermo Scientific公司;BCA蛋白定量试剂盒购自Beyotime公司;Anti-strep tag抗体购自Abcam公司;HRP标记山羊抗鼠IgG、Cy3标记山羊抗鼠IgG购自碧云天生物技术公司。
1.3 目的基因的设计
根据PDCoV的S蛋白氨基酸序列(GenBank:QAA06990.1),选取其受体结合域RBD基因序列,并在N端插入Strep-tag标签,上下游分别添加EcoRⅠ和XbaⅠ两个酶切位点,将该段序列进行杆状病毒表达偏爱密码子优化,交由南京金斯瑞公司合成。
1.4 引物设计
依据pFast Bac Dual载体序列设计合成检测重组杆状病毒的通用引物。引物由吉林省库美生物技术有限公司合成。
1.5 重组穿梭质粒的构建与鉴定
将合成并测序正确的的基因PDCoV-RBD亚克隆至杆状病毒双表达载体的PH启动子下游,命名为pFBD-PDR(图1),提取质粒后利用EcoRⅠ、XbaⅠ进行双酶切鉴定。

图1 pFBD-PDR重组质粒设计示意
1.6 重组杆粒的制备
将重组质粒pFBD-PDR转化到DH10BacTM感受态细胞中,并涂布于蓝白斑筛选平板:含有四环素(10 mg/L)、硫酸卡钠霉素(50 mg/L)、庆大霉素(7 mg/L)、IPTG(40 mg/L)、X-Gal(100 mg/L)的LB固体培养基,37 ℃避光培养48 h以上。挑取较大的白色菌落在上述固体培养基上进行划线接种,37 ℃避光培养48 h以上。挑取划线平板上较大的白色菌落接种至含四环素(10 mg/L)、硫酸卡钠霉素(50 mg/L)、庆大霉素(7 mg/L)的三抗液体培养基中,37 ℃,220 r/min振荡培养12 h。以PH-F和M13-R游引物进行菌液PCR鉴定(上游引物5′-TTCATACCGTCCCACCAT-3′;下游引物:5′-AGCGGATAACAATTTCACACAGG-3′),验证杆状病毒基因组是否转座成功。并提取验证正确的菌株杆粒,命名为Bacmid-PDR。
1.7 重组杆状病毒的拯救
提前准备细胞密度为1.5×106~2.5×106个/mL且状态良好的SF9细胞6孔板,将培养基更换为1 mL双无Grace’s培养基。并另取2个100 μL双无Grace’s培养基,分别加入4 μL CellfectinTMⅡ Reagent 转染试和4 μg阳性重组杆粒,并轻轻混匀后静置15 min,再将二者轻轻混匀,静置20 min后缓慢、均匀加入到6孔板中。27 ℃培养6 h后更换培养基为2 mL SF9Ⅱ完全培养基。27 ℃培养5~7 d,待大部分细胞出现明显病变(CPE)后收取细胞上清液为第一代重组杆状病毒,命名为rBV-PDR,后继续盲传3代。
1.8 间接免疫荧光法(IFA)鉴定目的蛋白的表达
取生长状态良好的SF9细胞均匀铺入6孔板,待细胞长至60%~70%,每孔接种20 μL的P2代rBV-PDR,27 ℃培养48 h后弃掉培养基。用PBS轻洗3次,加入细胞固定液固定30 min,PBS洗3次;Trion X-100透化处理10 min,PBS清洗1次;5%脱脂乳封闭1 h,PBST洗3次;1∶1 000稀释Anti-strep tag一抗37 ℃孵育2 h,PBST洗3次;1∶2 000稀释Cy3-标记的山羊抗鼠IgG室温避光孵育40 min,PBST洗2次。荧光显微镜观察。
1.9 Western blot检测
PDCoV-RBD蛋白表达4 000 r/min离心5 min收集感染第3代rBV-PDR的SF9细胞,加入适量IP裂解液裂解破碎后12 000 r/min离心3 min,收取上清后制备蛋白样品。通过SDS-PAGE,将蛋白转印至硝酸纤维膜上,以1∶1 000稀释的Anti-strep tag为一抗,1∶5 000稀释的山羊抗鼠IgG为二抗,进行Western blot鉴定。
2 结果
2.1 目的序列分析
PDCoV-RBD氨基酸同源性分析与序列比对见图2。

图2 PDCoV-RBD氨基酸同源性分析(A)与序列比对(B)
选取的目的氨基酸序列来自于中国南方流行株CC-HN2K-02株S蛋白(GenBank:QAA06990.1)的302~422 aa处,将其与NCBI上我国其他已知典型毒株S蛋白上对应的RBD氨基酸序列(23条)进行同源性分析,结果显示,该氨基酸序列完全一致(图略);将其与国外流行株进行对比(图2),同源性介于98.3%~100%,除泰国的3株毒株氨基酸序列(ANK58278.1 Thailand 2015、AMN91712.1 Thailand 2015、AMN91700.1 Thailand 2015)第46位与48位分别突变为L与R外,其余毒株均未发生变化,表明RBD氨基酸序列具有高度保守性。
2.2 重组质粒的鉴定
利用EcoRⅠ、XbaⅠ对重组质粒pFBD-PDR进行双酶切鉴定,经1%琼脂糖电泳,结果显示,得到1条636 bp左右的目的条带(图3),与预期合成片段大小一致;胶回收DNA片段后测序,验证该序列为目的序列,表明重组质粒构建成功。
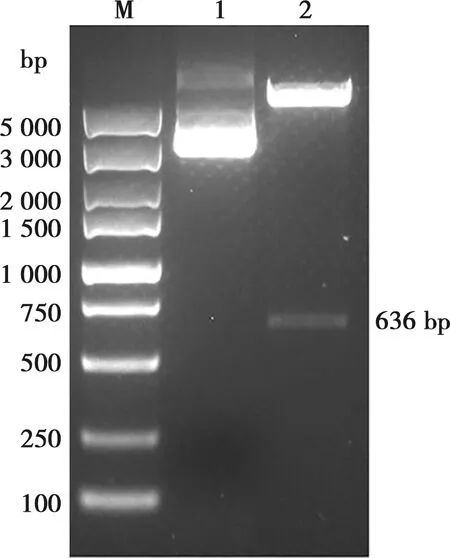
M.DL5000 Marker;1.重组质粒;2.重组质粒双酶切
2.3 重组杆粒Bacmid-PDR的鉴定
利用PH-F和M13-R引物对Bacmid-PDR 菌液进行PCR扩增,结果得到1条1 200 bp左右的条带(图4),与预期结果一致,表明重组杆粒Bacmid-PDR构建成功。
2.4 重组杆状病毒rBV-PDR的拯救
重组杆粒rBV-PDR转染SF9细胞产生P1代毒。与正常SF9细胞(图5A)相比,转染P3代毒的细胞在72~96 h后与出现典型CPE(图5B、5C)出现变大、变圆、细胞边界模糊、贴壁细胞数量减少、部分细胞破碎漂浮等情况,表明重组杆状病毒rBV-PDR拯救成功。
2.5 IFA鉴定PDCoV-RBD蛋白的表达
利用Strep-tag抗体对感染重组杆状病毒rBV-PDR的SF9细胞进行IFA检测,结果显示,正常SF9细胞未出现特异性荧光,而感染重组杆状病毒rBV-PDR的SF9细胞出现特异性红色荧光(图6),表明成功表达外源蛋白且表达的外源蛋白位于细胞核外。
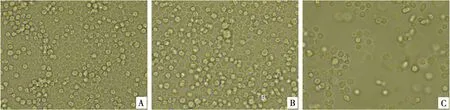
A.正常SF9细胞;B.重组杆粒Bacmid-PDR转染72 h的SF9细胞;C.P3代重组杆状病毒感染120 h的SF9细胞
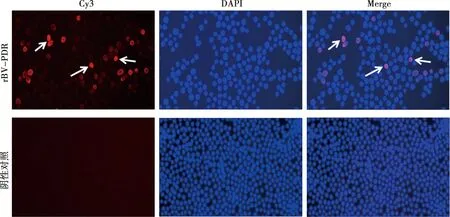
图6 IFA鉴定PDCoV-RBD蛋白的表达(400×)
2.6 Western blot检测PDCoV-RBD蛋白的表达
收集感染rBV-PDR的SF9细胞沉淀,进行裂解和破碎,12 000 r/min离心3 min后取上清裂解液制备蛋白样品。SDS-PAGE后,以Strep-tag抗体为一抗进行Western blot检测。结果显示,与正常SF9细胞裂解液相比,感染rBV-PDR的SF9细胞裂解液中检测到约22 kDa的蛋白条带(图7),与预期蛋白大小一致。进一步表明杆状病毒表达系统能够表达PDCoV-RBD蛋白。
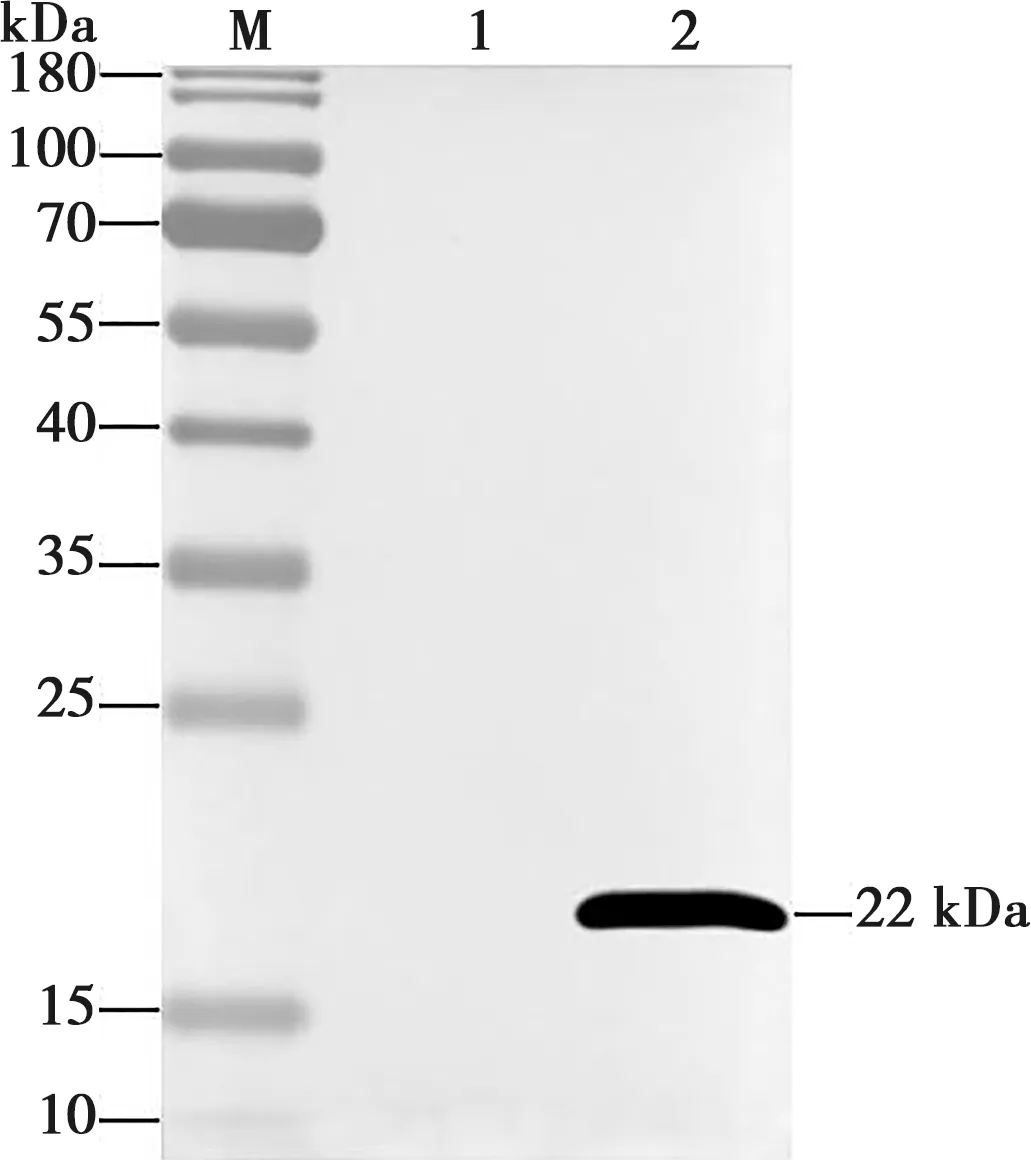
M.蛋白Marker;1.正常细胞;2.重组病毒感染细胞
3 讨论
PDCoV作为一种2012年新发现的猪腹泻病毒,常与猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)等其他病原发生混合或继发感染的情况,给多国养猪业带来严重经济损失[13-15]。冠状病毒的S蛋白具有识别受体、介导病毒侵入宿主细胞的功能,同时S蛋白也是决定病毒宿主范围及组织趋向性的关键结构[16-18]。另外,S蛋白作为重要抗原,能够刺激天然宿主产生中和抗体[19-21]。S蛋白由受体结合亚结构S1蛋白和膜融合亚结构S2蛋白组成,其中,S1结构域不止包含多个能够诱导产生中和抗体的中和表位[22],同时也具有识别受体、结合细胞的重要作用。候林杉等[23]以PDCoVHB-BD株的S1蛋白为基础,利用pET-32a载体构建了pET-32a-S1重组质粒,转化到BL21 (DE3) 感受态细胞中,诱导表达后利用His标签纯化蛋白,Western blot结果表明该方法表达的S1蛋白具有良好的免疫反应活性。Thachil等[24]利用真核表达载体成功表达了S1-Fc融合蛋白,在纯化后去除Fc标签,得到了PDCoV IA2014-1株(GenBank:KM613173)S1蛋白(氨基酸序列1~573),该蛋白具有良好的反应原性。S1结构域因其参与病毒入侵受体细胞、诱导产生中和抗体,成为PDCoV的重点研究区域。理论上PDCoV RBD结构域是S1蛋白的截短表达,含有多个抗原表位,是重要的免疫原性区域。Shang等[25]发现PDCoVS蛋白的S1-CTD区域能够与宿主表面的未识别受体结合,推测该段包含主要RBD,为PDCoV RBD的研究奠定了基础。
昆虫细胞-杆状病毒表达系统是以杆状病毒为载体、在昆虫细胞内表达外源蛋白的真核表达系统。该表达系统不但能对表达的重组蛋白进行糖基化、乙酰化、硫酸化、寡聚化、折叠等多种翻译后修饰,还因为具有高度的种属特异性,对包括人在内的哺乳动物无致病性的优点,具有良好的生物安全性[26-28]。因此,杆状病毒表达系统是以杆状病毒为载体的一种成熟、高效、安全的真核表达系统。本试验利用分子克隆技术将修饰后的PDCoV-RBD基因重组到杆状病毒表达载体中,构建了pFBD-PDR质粒,将获得的穿梭质粒转染到SF9昆虫细胞,获得重组杆状病毒。经间接免疫荧光和Western blot证明了感染rBac-PDR的SF9细胞能够正确表达PDCoV-RBD蛋白。
综上,本试验利用昆虫杆状病毒真核表达系统成功表达了PDCoV-RBD蛋白,为进一步研究PDCoV-RBD蛋白的生物学特性奠定了基础,也为后续PDCoV诊断试剂的研发、亚单位疫苗的制备等提供了新的思路。

