利福昔明与精油对乳房炎源大肠杆菌抗菌效果评价
缪颖雪,杨大伟,苗晋锋,郭凡溪,毛宁,余祖功*
(1. 南京农业大学动物医学院,江苏 南京 210095;2. 中国兽医药品监察所,北京 100081)
大肠杆菌是奶牛乳房炎的主要病原菌之一,发病率高,危害严重[1]。大肠杆菌能通过黏附在生物或非生物表面进行细胞分裂、定植形成生物被膜,增强对宿主免疫系统和抗菌药物的耐受性,据报道生物被膜中的细菌对抗菌药的耐受性往往是浮游菌的10到1 000倍[2]。也有报道大肠杆菌能入侵奶牛乳腺上皮细胞,引起持续的乳腺内感染,增加乳房炎防治难度[3]。
利福昔明(rifaximin, RIF)是利福霉素类抗生素,具有抗菌谱广、抗菌作用强等特点,已被批准于干奶期和泌乳期应用防治奶牛乳房炎[4]。精油具有抗菌、抗病毒、抗炎等多种药理作用[5],近年因其具有抗生物被膜和抑杀固着微生物的特点,使其在食品、医药和农业等行业越来越受重视。Goldbeck等[6]发现桉叶油能有效抑制变形链球菌形成生物被膜;黄卫峰等[7]研究发现鱼腥草素能抑制铜绿假单胞菌形成生物被膜,并能影响其群体感应信号分子高丝氨酸内酯的分泌;也有研究发现薄荷油能抑制链球菌生物被膜的形成[8]。精油与抗菌药物联用不仅有协同抗菌效果,还能通过阻抑生物被膜而减少细菌对抗菌药物的耐受性。消毒液中添加薄荷醇和柠檬精油后,消毒效果增强的同时还可阻止沙门菌在塑料表面上形成生物被膜[9]。
利福昔明与精油联用是否能够增强抗菌和抗生物被膜效果,值得关注。因此本试验测定了利福昔明与精油(桉叶油、薄荷油、鱼腥草油)单独或联合使用对奶牛乳房炎源大肠杆菌的体外抑菌作用、对大肠杆菌形成生物被膜的干预作用及对成熟生物被膜的消除作用,为精油在抗生物被膜感染方面的开发应用提供理论参考。
1 材料与方法
1.1 试验材料
RIF对照品,购自中国食品药品检定研究院;精油(essential oils,EOs):桉叶油(eucalyptus essential oil, EEO)、薄荷油(mint essential oil, MEO)、鱼腥草油(houttuynia essential oil, HEO)购自吉水县水南威霸香料有限公司;氨苄西林、阿莫西林、苄星邻氯、卡那霉素、林可霉素、头孢氨苄、头孢噻呋和头孢喹肟购自华北制药集团;水解酪蛋白肉汤培养基(MHB)、胰蛋白胨大豆肉汤培养基(TSB)购自青岛高科园海博生物技术有限公司。
大肠杆菌质控株ATCC25922购自中国兽医药品监察所, 47株大肠杆菌临床分离株由南京农业大学兽医药理组从乳房炎源牛奶样中分离、鉴定并保存。
1.2 药品储备液和菌液配制
RIF溶液的配制:精密称取RIF适量,用甲醇溶解配成浓度为1 280 μg/mL的药液,过滤分装后保存于-20 ℃冰箱。
精油溶液的配制:精油和吐温-80以1∶1的体积比例溶解,得到50%的精油溶液,过滤分装后,于4 ℃保存。
菌液:大肠杆菌接种于TSB培养基中,置37 ℃摇床孵育8~10 h至对数中期,用MHB稀释得到浓度约为1×108CFU/mL的菌液(酶标仪测量OD600 nm=0.1)备用。
1.3 大肠杆菌生物被膜形成能力的测定
根据Ikram等[10]的方法并加以改进,测定47株大肠杆菌临床株被膜形成能力。将菌液用TSB-g(含1%葡萄糖的TSB)稀释至107CFU/mL,测定其生物被膜在48 h时的形成量。对96孔板底经0.1%的结晶紫染色后的生物被膜用水漂洗3次后,加入200 μL无水乙醇脱色,并用酶标仪测量595 nm处的吸光度(OD595 nm),无菌的空白孔同样染色作为阴性对照。采用Yang等[11]的标准用光学密度截止值(ODc)对结果进行划分。ODc高于阴性对照的光密度(OD)平均值的3个标准差(SD),即:ODc=阴性对照的平均OD+(3×阴性对照的SD)。根据其光密度将结果分为4类:强成膜株(4ODc 根据临床和实验室标准协会(CLSI)制定的微量肉汤稀释法[12]测定RIF、批准经乳房注入的乳房炎常用抗生素和精油对47株临床株和质控株的最小抑菌浓度(MIC),以2倍稀释法于96孔板中用MHB稀释药液使1~11列皆含100 μL药液,再加入用MHB稀释至1×106CFU/mL的菌液各100 μL至前11列,第12列前4孔加入200 μL MHB,后4孔加入200 μL菌液。于37 ℃温箱培养16~20 h后,肉眼观察试验孔清澈无菌生长的最小药物浓度为MIC。MIC50为能抑制50%的菌株生长的最低药物浓度,MIC90为能抑制90%的菌株生长的最低药物浓度。根据Hendry等[13]的方法测定最小杀菌浓度(MBC),96孔板的无菌生长孔中每孔取50 μL菌液涂布于MH平板,37 ℃过夜培养后,无菌落生长的平板所对应的最低药物浓度为MBC。 选择质控株和19株成膜能力不同的临床株,其中:弱成膜1株(QM1)、中等成膜4株(E31、DS1、DS2、QM2)和强成膜14株(E1、E26、E27、E28、E29、E30、E32、E33、LN1、LN2、NMG1、NMG2、QTX1、QTX2),根据Buldain等[4]的方法,采用棋盘稀释法测定RIF和精油的联合抑菌指数(FICI), FICI=MICA药联合/MICA药单独+MICB药联合/MICB药单独。结果判断:FICI≤0.5为协同;0.5 选择与联合抑菌试验相同的19株临床株,根据Huang等[14]的方法加以改进,测定RIF和精油对大肠杆菌的最小抑制被膜浓度(MBIC)。在96孔板中加入稀释后的菌液和药液,使得96孔板中菌液(107CFU/mL)含药终浓度为1 MIC~16 MIC,培养板置于37 ℃培养48 h。染色步骤与被膜形成能力测定试验相同。MBIC为与阴性对照OD595nm相同的最小浓度。 选择5株强成膜株(E1、E26、E28、NMG1和NMG2),根据Federman等[15]的方法稍加改进,分别用1/2 MIC的RIF,不同浓度(0、1/2、1/4、1/8和1/16 MIC)的EEO以及上述浓度EEO联合RIF处理大肠杆菌,用结晶紫染色法测定药物对于被膜形成抑制作用和对预制被膜消除作用,以无药处理组作为对照组。其中测定对被膜形成影响的试验在37 ℃培养48 h;测定对预先形成的被膜(预制被膜)影响的试验中使被膜在37 ℃预生长48 h。结果表示为被膜形成率(或被膜留存率)。被膜形成率(或被膜留存率)=OD595 nm处理组/OD595 nm对照组×100%。 数据分析由SPSS 19.0进行,采用单因素方差分析(ANOVA)检验差异。数据用“平均数±标准差”形式表示。 47株大肠杆菌临床株在48 h时的被膜形成情况如图1所示。其中有7株菌OD值在0.114~0.228,为弱成膜株;12株菌OD值在0.228~0.458,为中等成膜株;28株菌OD值>0.458,为强成膜株。强成膜株占总数一半以上。 图1 47株大肠杆菌在48 h时的生物被膜形成量 RIF、乳房炎常用抗生素和3种精油对47株大肠杆菌临床分离株及质控株的MIC见表1。其中CLSI规定氨苄西林和阿莫西林的耐药折点为16 μg/mL,耐药率分别为59.57%和63.83%;头孢噻呋的耐药折点为4 μg/mL,耐药率为25.53%,另几种的耐药折点暂未列出。而RIF相较于林可霉素、氨苄西林、苄星邻氯、头孢氨苄、阿莫西林都有更小的MIC50和MIC90值;RIF与卡那霉素、头孢噻呋、头孢喹肟相比虽然MIC50更高,但MIC90值远小于这几种药;且RIF的MIC范围相对较低较窄。综合比较,RIF对临床株浮游菌的抗菌活性优于另几种抗生素。RIF对大肠杆菌的MIC值为1~128 μg/mL,EEO对大肠杆菌的MIC值为0.16%~2.5%,MEO对大肠杆菌的MIC值为0.04%~0.63%,HEO对大肠杆菌MIC值为0.04%~1.25%。其中RIF和EEO的MIC90皆为其MIC50的4倍,MEO和HEO的MIC90为其MIC50的2倍。3种精油中MEO的抑菌作用最强,HEO稍弱,EEO最次。 表1 乳房炎常用抗生素和3种精油对大肠杆菌的MIC和MBC(n=48) RIF和精油对大肠杆菌的MBC结果以MBC范围及MBC/MIC比值表示,比值分布见表2。RIF对大肠杆菌的MBC/MIC比值为1的有27株菌,为2的有17株菌,为4~8的有4株。EEO对大肠杆菌在3种精油中MBC/MIC比值为1的菌株最少,为16株菌,MEO和HEO分别为36和37株;EEO该比值为2的菌株为26株,多于MEO的8株和HEO的11株;EEO该比值为4的菌株为6株,也多于MEO的4株和HEO的0株。3种精油中MEO和HEO的杀菌活性水平相似,都稍高于EEO。RIF也有一定的杀菌活性,但稍弱于精油。 表2 RIF和3种精油对大肠杆菌的MBC/MIC比值分布(n=48) RIF和3种精油对19株临床分离大肠杆菌和质控株的联合抑菌效果见表3。RIF+EEO对4株菌为无关作用,对15株菌为相加,对1株菌为协同,相加或协同效果占受试菌株的80%;而RIF+MEO和RIF+HEO都对8株菌为无关作用,对11株菌为相加,对1株菌为协同,相加或协同效果占受试菌株60%。所以RIF+EEO在这3种组合中对大肠杆菌浮游菌的联合抑菌效果最好。 表3 RIF和3种精油的组合对大肠杆菌的联合抑菌效果(n=20) RIF和3种精油对19株临床分离大肠杆菌的MBIC结果以MBIC/MIC比值分布表示,比值越低,则抗被膜活性越好。结果见表4,MBIC/MIC比值在1~16不等,84%以上的菌株为1~4。其中RIF对58%的临床株MBIC/MIC比值为1~2,且有1株菌比值为16;EEO对74%的临床株MBIC/MIC比值为1~2;MEO对78%的临床株MBIC/MIC比值为1~2;HEO对32%的临床株MBIC/MIC比值为1~2。与抑制浮游菌活性相比,3种精油中HEO的抑膜效果最差,EEO与MEO相似,而RIF的抑膜效果也弱于精油。 表4 RIF和3种精油对大肠杆菌的MBIC/MIC比值分布(n=19) 亚抑菌浓度的EEO与1/2 MIC的RIF单独或联合对5株强成膜的大肠杆菌的被膜形成时影响如图2所示。与对照组相比,RIF单独使用对5株菌都有极显著抑制被膜形成的效果(P<0.01),被膜形成率在43.8%~77.9%。与对照组相比,不同浓度EEO的单独使用对5株菌的被膜形成大多有极显著抑制的作用(P<0.01),如当EEO浓度为1/2 MIC~1/16 MIC,NMG1形成率为11.3%~27.2%,NMG2形成率为5.8%~19.8%,E28形成率为67.1%~92.7%;但在EEO浓度为低浓度(1/8 MIC~1/16 MIC)时,对E1,E26被膜形成无显著影响。RIF与不同浓度EEO联合使用时,5株菌与对照组相比皆有极显著抑制作用(P<0.01);与RIF组相比,除E28在RIF联合1/4 MIC浓度EEO时无差异,对5株菌的被膜形成皆有极显著抑制作用(P<0.01),形成率6.9%~41.7%。即RIF单独使用、EEO单独使用和RIF+EEO都对大肠杆菌被膜形成有很好的抑制作用,且联合使用时效果优于单药。 亚抑菌浓度的EEO与1/2 MIC的RIF单独或联合对5株强成膜的大肠杆菌的预制被膜的影响如图3所示。RIF单独使用与对照组相比,除对NMG1无显著影响,对另外4株菌都有极显著消除预制被膜的效果(P<0.01),被膜留存率56.6%~85%。高浓度EEO的单独使用与对照组相比对大部分大肠杆菌预制被膜有消除作用(P<0.01),如当EEO浓度为1/2 MIC~1/8 MIC,E1留存率为44.8%~87.1%,E26留存率为59.5%~75.7%;在EEO浓度是1/2 MIC~1/4 MIC时,E28留存率为69.2%~81.1%;EEO浓度为1/2 MIC时,NMG1留存率为77.6%;但1/2 MIC~1/16 MIC的EEO都对NMG2的预制被膜无显著影响。RIF与不同浓度EEO联合使用时,与对照组相比5株菌的预制被膜皆被显著消除(P<0.05)。但与RIF组相比,仅含高浓度EEO的联用组对部分菌株预制被膜有显著影响(P<0.01),当1/2 MIC~1/8 MIC的EEO联合RIF时,E1留存率为57%~61.6%,NMG2留存率为54.3%~64.7%;而1/2 MIC~1/16 MIC的EEO联合RIF都对E26和E28预制被膜无显著作用。对于预制被膜,RIF+EEO的消除效果明显好于RIF或EEO单独使用。 注:对照组为无药组(1/2 MIC RIF且EEO浓度为0),RIF组为单独使用1/2 MIC RIF(即0 MIC EEO+1/2 MIC RIF)。与对照组相比,*P<0.05,**P<0.01,与RIF组相比,#P<0.05,##P<0.01。下同 A. E1菌株;B. E26菌株;C. E28菌株;D. NMG1菌株;E. NMG2菌株 RIF抗菌谱广,抗菌作用强,本研究中MIC测定结果也证实RIF对大肠杆菌有较好抗菌活性[5]。本研究中MIC测定显示EEO、MEO、HEO都对大肠杆菌具有抑菌作用。当MBC/MIC比值在4~16时,药物对菌株表现抑菌作用[16];MBC/MIC比值<4时,药物展现强杀菌作用[17]。本研究中RIF对大肠杆菌的该比值进一步表明RIF、精油对受试菌株均有杀菌或抑菌作用。但3种精油中EEO的抑菌能力稍弱,这可能与不同来源的EEO对大肠杆菌具有不同程度的抗菌作用有关[18]。 Buldain等[4]发现RIF与白千层精油联用对金黄色葡萄球菌表现协同的抑菌作用,也有研究表明MEO与莫匹罗星联用对金黄色葡萄球菌表现相加的抑菌作用[19]。本研究得到相似结果,EEO、MEO、HEO分别联合RIF都对抑制浮游菌表现出较好的相加作用。3种组合中EEO联合RIF的效果最好,这可能由于精油的不同成分间也具有不同的增效作用,例如肉桂醛和丁香酚联用对单核李斯特菌的抗菌活性大于肉桂醛和β-石竹烯联用[20]。 生物被膜中的细菌对抗菌药的耐受性通常是浮游菌的10至1 000倍[2]。精油中有牛至油等被证明对葡萄球菌的生物被膜的形成有阻抑作用[21]。本研究中的MBIC/MIC比值证实了RIF、EEO、MEO及HEO对大肠杆菌生物被膜都有很好的抑制作用,精油的抑膜作用优于RIF,且EEO与MEO的抑膜作用最好。这或许与精油除改变膜通透性外也可使细菌遗传物质功能紊乱达到抗菌作用有关[5]。虽然单独使用EEO对浮游菌抑菌效果稍弱,但EEO和RIF的联合抑菌效果最好,且EEO的抑膜效果优越,综合这几项试验结果,本研究选用了RIF和EEO进行亚抑菌浓度的被膜影响试验。 利福平在1/2 MIC浓度时可抑制表皮葡萄球菌的生物膜形成[22]。本研究中1/2 MIC的RIF也对大肠杆菌被膜形成和预制被膜都有破坏作用。亚抑菌浓度的1,8-桉叶素(EEO主要成分)可以抑制大肠杆菌形成的生物膜的活性[23]。本研究中EEO对被膜形成和预制被膜都有一定抑制作用,且呈现一定浓度依赖性。Liu等[24]发现利福平和麦卢卡蜂蜜对产金黄色葡萄球菌的生物膜具有很强的协同作用,也有研究证实EEO联合氯己定二葡萄糖酸盐与后者单用相比对表皮葡萄球菌被膜表现出更强的抑制作用[25]。本研究中1/2 MIC的RIF和亚抑菌浓度的EEO联用时,对大肠杆菌的被膜形成起抑制作用,但仅与高浓度EEO(1/2 MIC~1/4 MIC)联用时,对预制被膜有一定消除作用。亚抑菌浓度的RIF联合EEO抑制被膜表现出相加效果,但RIF和EEO单独及联用对预制被膜消除能力都弱于对被膜形成过程的抑制,这可能由于已存在的细菌聚集体比细菌聚集过程更难以破坏,如0.1%的柑橘油能抑制金黄色葡萄球菌被膜形成却无法消除预制被膜[15]。 本试验结果显示,与单独使用RIF或EEO相比,两者联合对于大肠杆菌的浮游菌、生物被膜都有更强的抑制作用,这为继续探究RIF和EEO联用应用于防治大肠杆菌感染的牛乳房炎提供了一定的研究基础。1.4 最小抑菌浓度和最小杀菌浓度的测定
1.5 联合抑菌试验
1.6 最小抑膜浓度的测定
1.7 RIF、EEO对被膜形成抑制作用和预制被膜消除作用的测定
1.8 数据分析
2 结果与分析
2.1 大肠杆菌被膜形成能力

2.2 RIF和精油对浮游菌的抑制作用


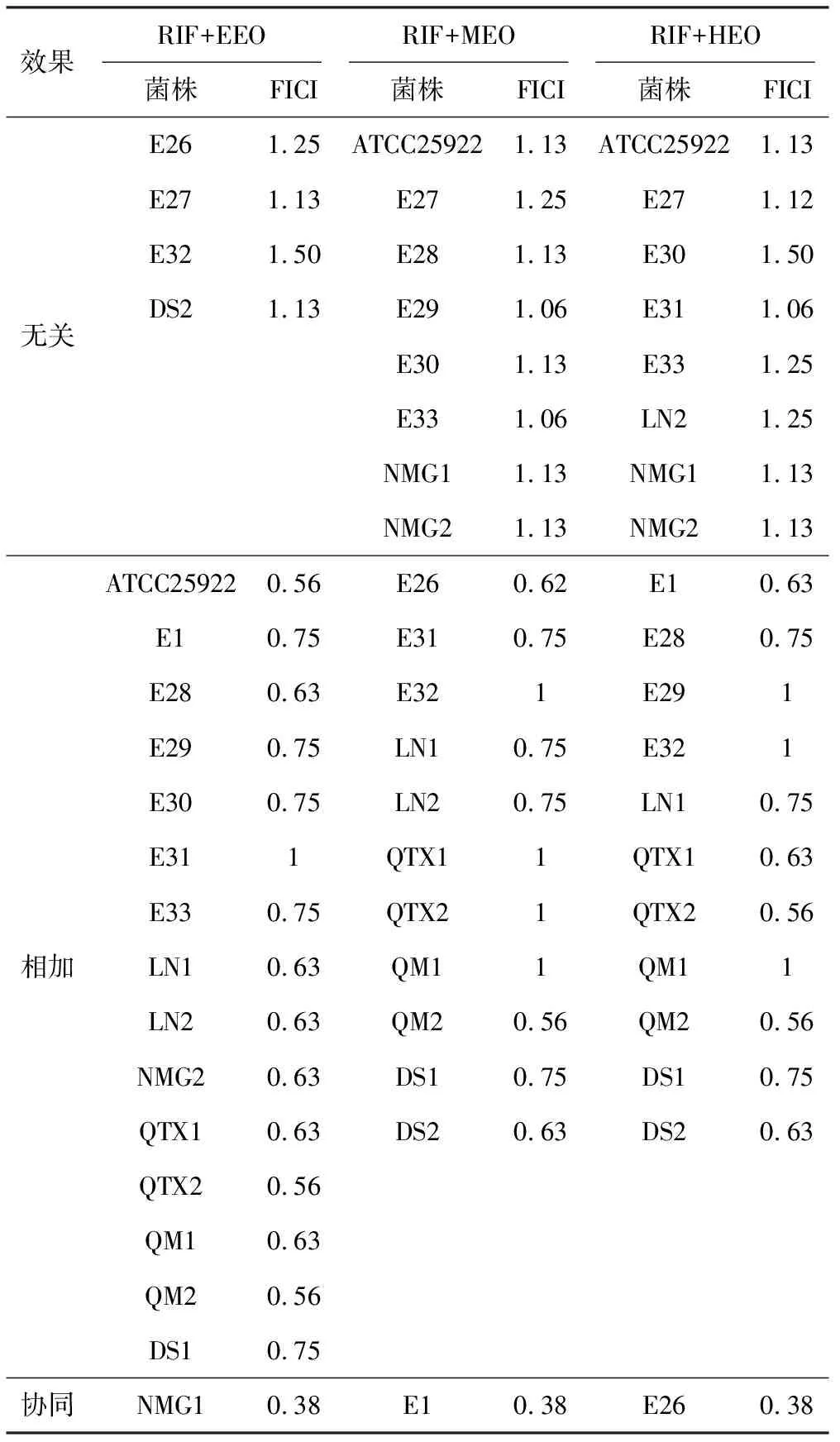
2.3 RIF联合精油对浮游菌的抑菌作用
2.4 RIF和精油对大肠杆菌的MBIC

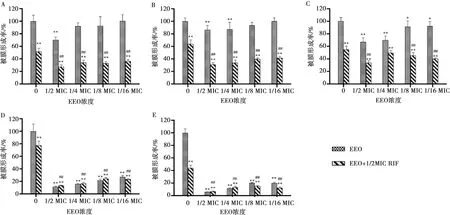
2.5 RIF、EEO单独及联合对被膜形成的抑制作用
2.6 RIF、EEO单独及联合对预制被膜的消除作用

3 讨论

