3株耐盐细菌对萘、菲、惹烯和苯并[α]芘的降解性能
陈弘昊,李作扬,陈泉睿,何洁,赵欢,王斌
(1.大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连 116023;2.大连海洋大学 海洋科技与环境学院,辽宁 大连 116023)
多环芳烃(Polycyclic Aromatic Hydrocarbons,PAHs)作为石油的主要成分,是最早发现的强致癌物[1]。由于其高疏水性和化学稳定性,极易在人体内富集,致癌、致畸和致突变[2-3],目前人类生态环境受到了多环芳烃的严重污染,因此,PAHs被美国环保局列入了129种优先控制环境污染物的黑名单[4]。全世界每年大约有23万t多环芳烃污染物进入海洋环境[5]。此外,大气中的PAHs通过迁移、沉降等作用进入水体和土壤,水环境中的PAHs最终也将以沉积形式存在,而土壤中PAHs会通过扩散和渗透作用进入地下水或者被植物吸收进入食物链。因此,土壤是多环芳烃污染物存在的主要生态环境[6]。全球范围内普遍存在土壤和海洋等区域多环芳烃污染的问题[7],陆地和海洋中石油的开采、储运和加工等过程中均可造成PAHs在土壤和海底的沉积,形成盐渍化石油污染的土壤和沿海滩涂[8],盐渍化土壤这类高盐环境的污染影响更加恶劣[9],其修复难度更大。
近年来,国内许多相关研究人员致力于从高度污染区域中筛选出高效降解PAHs的菌株,并对其降解性能进行初步研究[10]。倪雪等[11]从受到PAHs污染的植物体内分离到两株菲降解菌,邓军等[12]从PAHs污染较严重的土壤中分离到一株PAHs降解菌,田志刚等[13]也从胜利油田附近石油污染区筛选到一株PAHs降解菌。此外,也有关于耐盐细菌对常温和低温高盐土壤中PAHs降解情况的报道[14-17],而有关海洋环境PAHs污染细菌降解的报道较少。鉴于目前石油泄漏、工业排放所造成的海水及沉积质PAHs污染的生物修复需求,本研究中选用分离自辽宁盘锦红海滩地区翅碱蓬根系土壤及沿海滩涂土壤中分离出的高效降解石油菌株,处理高盐水环境中的4种多环芳烃(萘、菲、惹烯、苯并[α]芘),采用气质联用(GC-MS)技术测定处理前后目标化合物含量,同时研究试验菌株在不同浓度的共代谢基质(葡萄糖)存在下对4种多环芳烃标志物的降解效率,以期为高盐污水和海洋环境PAHs污染物的降解和生物修复筛选功能菌株,为今后实际应用提供借鉴参考。
1 材料与方法
1.1 材料
试验菌种为辽宁省海洋生物资源恢复与生境修复重点实验室从翅碱蓬根系及其土壤中筛选出的对柴油具有高降解性能的微杆菌Microbacteriumsp.(编号S1)、刘志恒菌Zhihengliuellasp.(编号G12)[18],以及分离自辽宁盘锦沿海滩涂土壤的恶臭假单胞菌Pseudomonputida(编号Y3)[19],菌种冻存管使用2216E液体培养基活化后使用。
试验用培养基分别为2216E液体培养基及固体培养基、无机盐基础培养基、PAHs-无机盐培养基。无机盐基础培养基包含NaCl(20 g/L)、NH4Cl(0.5 g/L)、KH2PO4(0.5 g/L)、K2HPO4(1 g/L)、KC1(0.01 g/L)、MgSO4·7H2O(0.5 g/L)、CaC12(0.002 g/L)、FeSO4(0.01 g/L)、蒸馏水(pH 7.2)。PAHs-无机盐培养基是用丙酮(分析纯,生工)充分溶解萘、菲、惹烯和苯并[α]芘4种PAHs,再用微孔滤膜过滤除菌后添加进已灭菌的无机盐培养基中,过夜使丙酮充分挥发后制成[20]。本研究中苯并[α]芘的浓度依照中华人民共和国国家海水水质标准[21]为基础进行设置,其他3种目标PAHs以苯并[α]芘浓度为基准,终浓度均为20 mg/L。
1.2 方法
本研究中依照海水水质标准GB 3097-1997[21]为基础,设置4种PAHs加标无机盐培养基,预先通过气质联用仪测定并绘制出标准品的浓度标准曲线,对3株菌作用7 d后,培养基中残留的PAHs进行测定。
1.2.1 色谱条件设置 采用气相-质谱(GC-MS)分析对萘、菲、惹烯和苯并[α]芘4种PAHs的含量进行测定,参考国家石油化工行业标准(SH/T 0606—94)[22]及多环芳烃标准品说明书设置具体色谱条件,结果见表1。

表1 萘、菲、惹烯、苯并[α]芘色谱条件Tab.1 Chromatographic conditions of naphthalene,phenanthrene,retene, and benzo [α] pyrene
1.2.2 4种PAHs标准曲线的绘制 采用外标法对4种多环芳烃标准品进行定量检测。以正己烷作为溶剂,分别准确配制浓度为2、20、200 mg/L的萘、菲、惹烯、苯并[α]芘标准液。按表1设置条件进样测定。根据Agilent 7890B/5977A型GC—MS仪器对不同浓度的4种多环芳烃标准品测定结果,使用Agilent MassHunter定量分析软件绘制标准曲线图,使用最小二乘法进行线性拟合得到标准曲线(表2),4种曲线的相关性系数R2均大于0.98,拟合度较好,可用于后续试验中萘、菲、惹烯、苯并[α]芘含量测定。
1.2.3 3株菌在4种PAHs-无机盐培养基中生长的测定 取3株菌的2216E液体培养物(1×109CFU/mL)0.1 mL,分别接种于50 mL PAHs-无机盐液体培养基中,每组设置3个平行,以不接菌的培养基作为对照组,置于30 ℃下避光恒温培养7 d后,用2216E平板测定其生长情况。同时分别配制葡萄糖浓度为0、0.5、1.0、1.5 g/L的4种PAHs-机盐培养基,同法接入3株试验菌并测定其生长情况。
表2萘、菲、惹烯、苯并[α]芘标准曲线及其相关系数
Tab.2Formulaofstandardcurvesandcorrelationcoefficientsofnaphthalene,phenanthrene,retene,benzo[α]pyrene
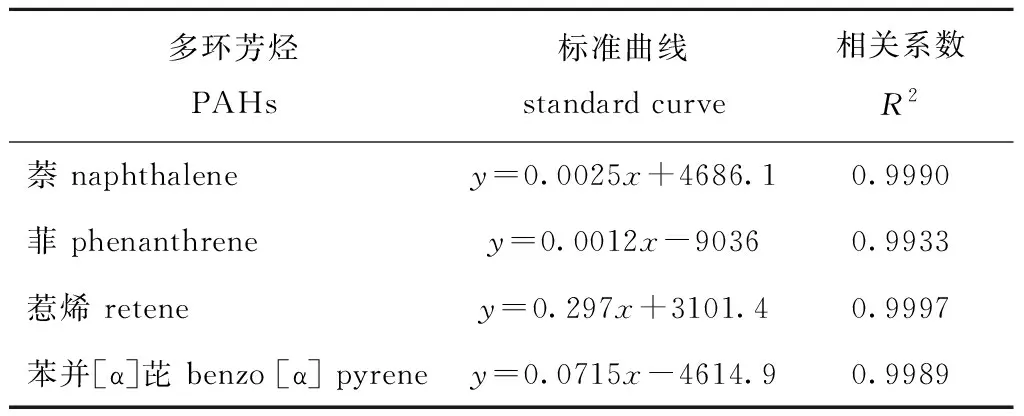
多环芳烃PAHs标准曲线standard curve相关系数R2萘 naphthaleney=0.0025x+4686.10.9990菲 phenanthreney=0.0012x-90360.9933惹烯 reteney=0.297x+3101.40.9997苯并[α]芘 benzo [α] pyreney=0.0715x-4614.90.9989
1.2.4 3株菌对4种多环芳烃降解性能的测定 将3株菌的2216E液体培养物(1×109CFU/mL)按1%的接种量,分别接种于含不同浓度葡萄糖(0、0.5、1.0、1.5 g/L)的PAHs-无机盐培养基中,每组设置3个平行,以不接菌的培养基作为对照组,置于25 ℃恒温振荡培养箱中以160 r/min避光培养7 d。利用紫外分光光度法测定菌悬液的OD值,根据标准曲线换算出菌体数[18],同时滴加5 mL二氯甲烷(色谱纯)至培养液中,混匀后移入分液漏斗,再取5 mL二氯甲烷清洗管壁黏附的多环芳烃,清洗液移入分液漏斗中,充分震荡后静置直至分层,收集分液漏斗下方有机相,移入1.5 mL色谱瓶中作为萃取液密封备用。将上述所得萃取液上机检测,分别进行定性、定量分析。其中降解率及平均降解速率计算公式为
自然降解率=(m0-m1)/m0×100%,
试验菌降解率=(m1-m2)/m0×100%,
降解速率 =(m1-m2)/(n×t)。
其中:m0为培养基中加标的PAHs含量(ng);m1为不接菌对照组7 d后的PAHs含量(ng);m2为接入3株试验菌培养7 d后的残余PAHs含量(ng);n为培养基中活菌数(CFU/mL);t为降解时间(d)。
3株菌在作用同样时间(7 d)后,同法测定其培养基中PAHs残余含量,采用平板菌落计数法,同时测定每个样品中的活菌数,用上述降解速率公式,计算出单位活细胞对4种PAHs的降解速率。
1.3 数据处理
试验结果使用Agilent MassHunter Qualitalive Analysis、Alient MassHunter 软件进行定量分析,应用SPSS 19.0软件对数据进行单因素方差分析和Duncan多重比较。
2 结果与分析
2.1 葡萄糖对3株菌在PAHs-无机盐培养基中生长的影响
从图1~图4可见:在无葡萄糖的4种PAHs-无机盐培养基中,3种菌生长情况均较好的是萘-无机盐培养基,S1、Y3和G12 菌株的菌量分别为4.12×109、3.12×109、2.00×109CFU/mL,说明3株菌均能较好地利用萘为碳源;无葡萄糖添加的其他3种PAHs-无机盐培养基中,3株菌生长均较差,生长量依次为菲-无机盐培养基、苯并[α]芘-无机盐培养基和惹烯-无机盐培养基。添加葡萄糖后,3株菌生长情况均有明显提高,除苯并[α]芘-无机盐培养基在1.5 g/L葡萄糖时较其他浓度组略有降低外,各葡萄糖浓度组均显著高于不加糖组(P<0.05);3株菌在萘、菲和惹烯3种PAHs培养基内生长量均与含糖量成正比,3株菌间比较显示,S1菌株在不同浓度葡萄糖的萘、菲和惹烯培养基中生长量均最大,在0.5、1.0 g/L葡萄糖浓度的3种PAHs-无机盐培养基和1.5 g/L葡萄糖浓度的惹烯-无机盐培养基中均明显优于Y3和G12菌株,且有显著性差异(P<0.05),而Y3菌株和G12菌株生长量则无显著性差异(P>0.05);G12菌株在不同浓度葡萄糖的苯并[α]芘-无机盐培养基中生长量最大,但仅在1.0 g/L葡萄糖浓度时G12菌株生长量与S1菌株有显著性差异(P<0.05),其他浓度下3菌株生长量均无显著性差异(P>0.05)。
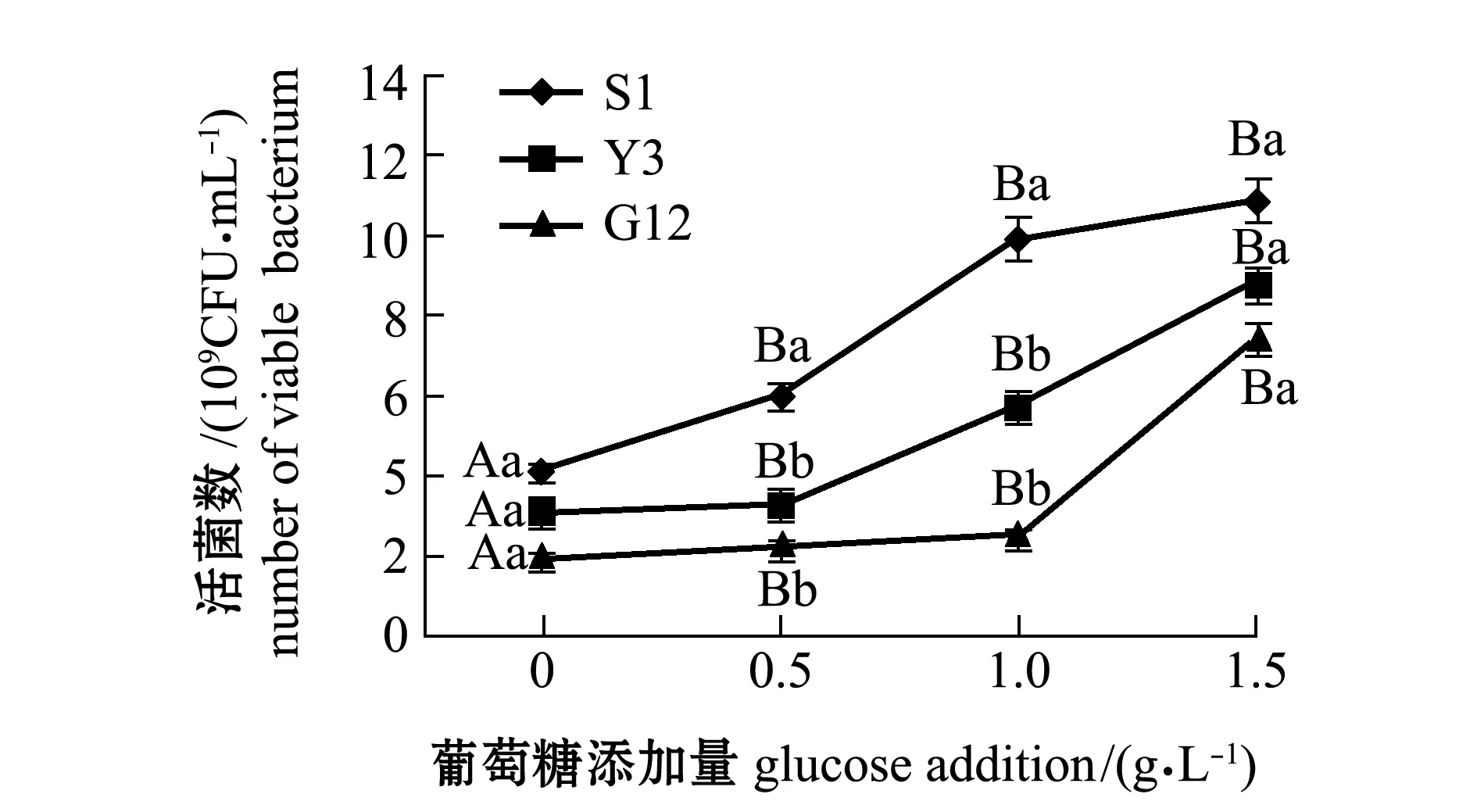
注:标有不同大写字母表示同一菌株不同葡萄糖浓度间生长量有显著性差异(P<0.05),标有不同小写字母表示同一葡萄糖浓度不同菌株间有显著性差异(P<0.05),标有相同字母者表示组间无显著性差异(P>0.05),下同Note:The means with different capital letters are significantly different at different glucose concentrations in the same strain at the 0.05 probability level; the means with different letters being significantly different in different strains at the same glucose concentration at the 0.05 probability level, and the means with the same letters are not significant differences, et sequentia图1 3株菌在不同葡萄糖浓度的萘-无机盐培养基中的生长情况Fig.1 Growth of 3 strains in naphthalene-mineral medium containing different concentrations of glucose
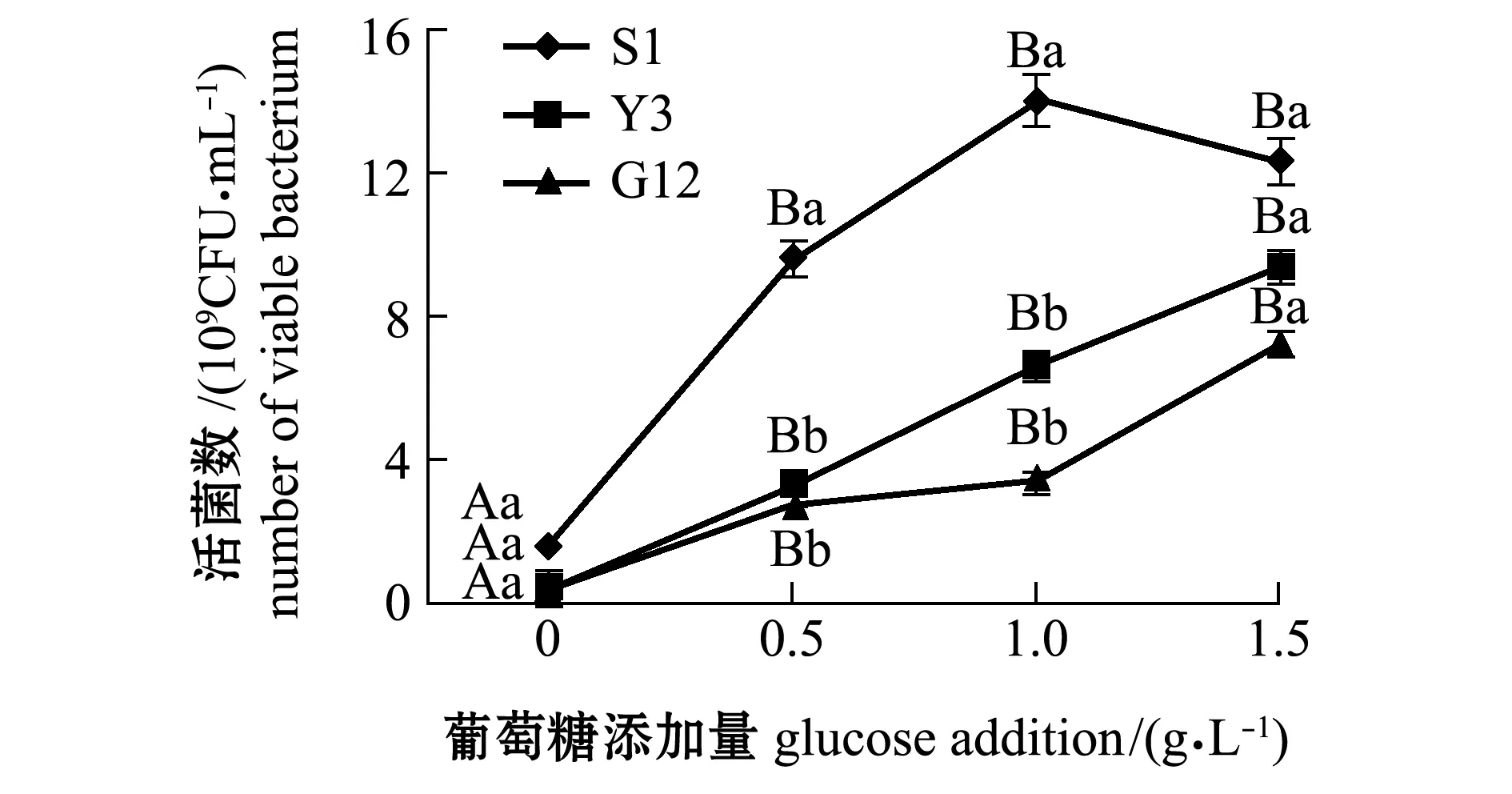
图2 3株菌在不同葡萄糖浓度的菲-无机盐培养基中的生长情况Fig.2 Growth of 3 strains in phenanthrene-mineral medium containing different concentrations of glucose
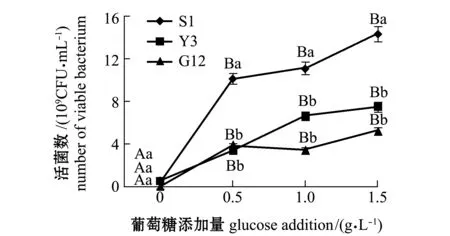
图3 3株菌在不同葡萄糖浓度的惹烯-无机盐培养基中的生长情况Fig.3 Growth of 3 strains in retene-mineral medium containing different concentrations of glucose
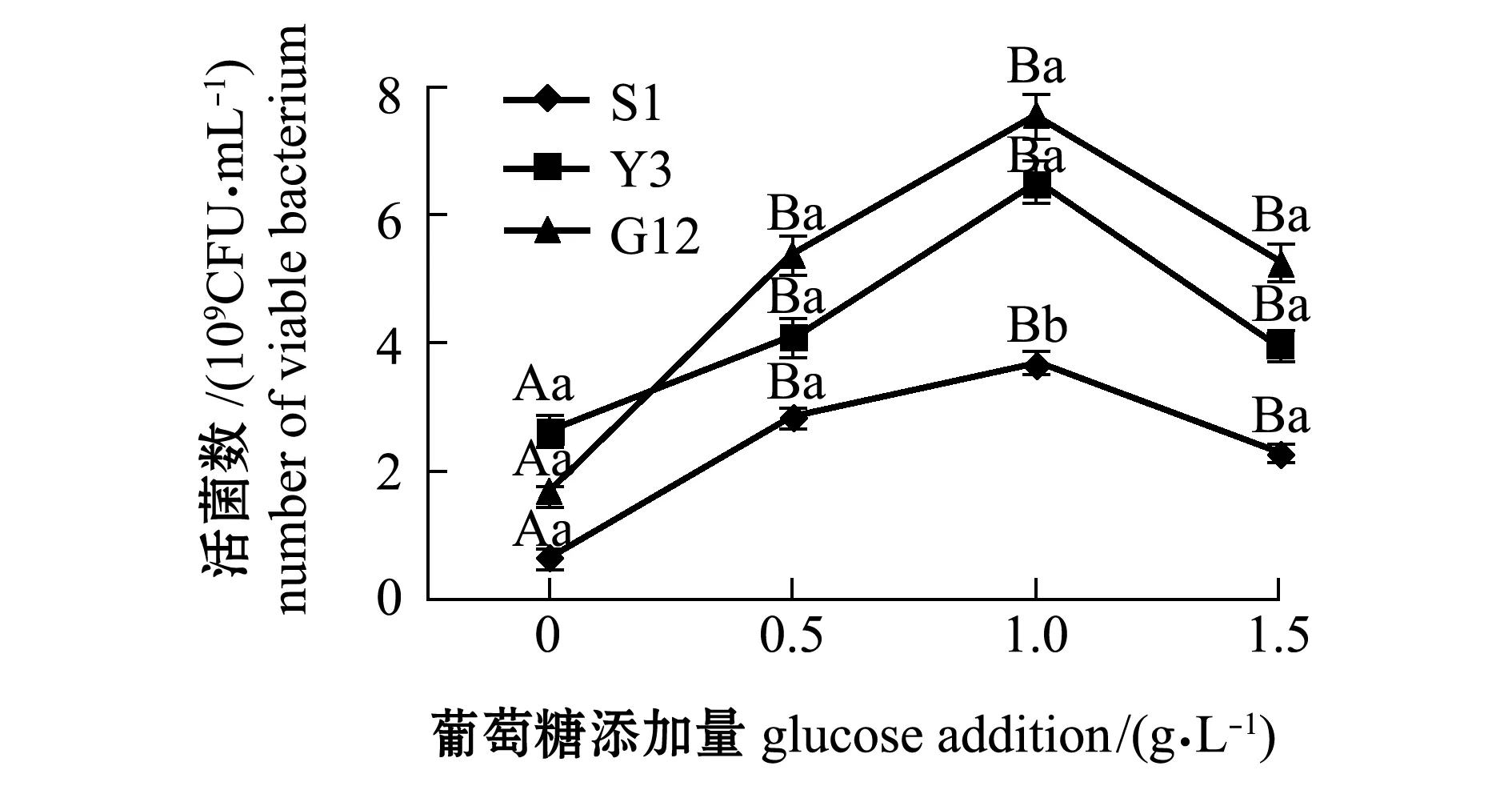
图4 3株菌在不同葡萄糖浓度的苯并[α]芘-无机盐培养基中的生长情况Fig.4 Growth of 3 strains in benzo [α] pyrene-mineral medium containing different concentrations of glucose
2.2 葡萄糖对3株菌降解速率的影响
2.2.1 试验菌对萘的降解率及单位细胞的降解速率 经计算得出,萘在含0、0.5、1.0、1.5 g/L葡萄糖的无机盐培养基中7 d后,自然降解率分别为5.49%、8.57%、7.52%、6.84%。从图5可见:不添加葡萄糖时,S1、Y3和G12菌株对萘的降解率分别为13.40%、19.92%、16.84%,且3株菌间无显著性差异(P>0.05);不同浓度葡萄糖可提高3株菌对萘的降解率,3株菌对萘的降解率在添加1.0 g/L葡萄糖时与无糖组和0.5 g/L葡萄糖组有显著差异(P<0.05),在1.0 g/L葡萄糖浓度时3株菌对萘的降解率依次为Y3(70.56%)>G12(67.82%)>S1(57.46%)。
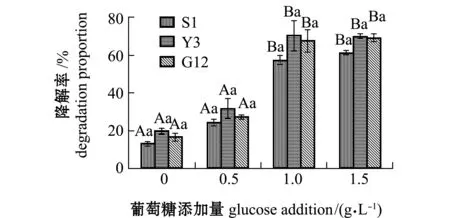
图5 3株菌对标准品萘的降解率Fig.5 Degradation proportion of 3 strains on naphthalene
从图6可见:通过计算单个细胞对萘的降解速率得出,无葡萄糖添加时,S1菌株对萘的降解速率最高,达到5.606×10-8ng/(CFU·d),G12菌株和Y3菌株对萘的降解速率依次为2.132×10-8、1.342×10-8ng/(CFU·d),S1菌株与其他2株菌(Y3、G12菌株)相比有显著性差异(P<0.05),但Y3与G12菌株间无显著性差异(P>0.05);随着葡萄糖浓度的增加,3株菌单个细胞的降解速率皆呈降低趋势,其中S1菌株较无糖组显著降低(P<0.05),最低降至5.257×10-9ng/(CFU·d),减小了一个数量级。
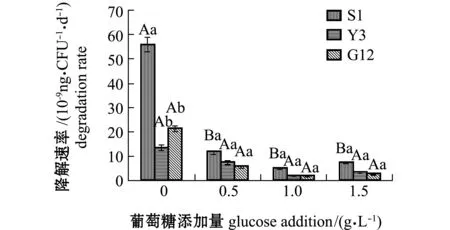
图6 3株菌对标准品萘的降解速率Fig.6 Degradation efficiencies of 3 strains on naphthalene
2.2.2 试验菌对菲的降解率及单位细胞的降解速率 经计算得出,菲在含0、0.5、1.0、1.5 g/L葡萄糖的无机盐培养基中7 d后,自然降解率分别为1.34%、1.76%、3.94%、3.34%。从图7可见:无糖组中,G12菌株对菲的降解率最高(22.04%),其次为Y3(17.33%)和S1菌株(11.24%),且3株菌间无显著性差异(P>0.05);Y3、S1和G12菌株对菲的降解率在添加1.0 g/L葡萄糖时提升最显著,分别为62.15%、60.51%、59.77%,且与无糖组和0.5 g/L葡萄糖组有显著性差异(P<0.05),各葡萄糖浓度下,3株菌间降解率无显著性差异(P>0.05)。
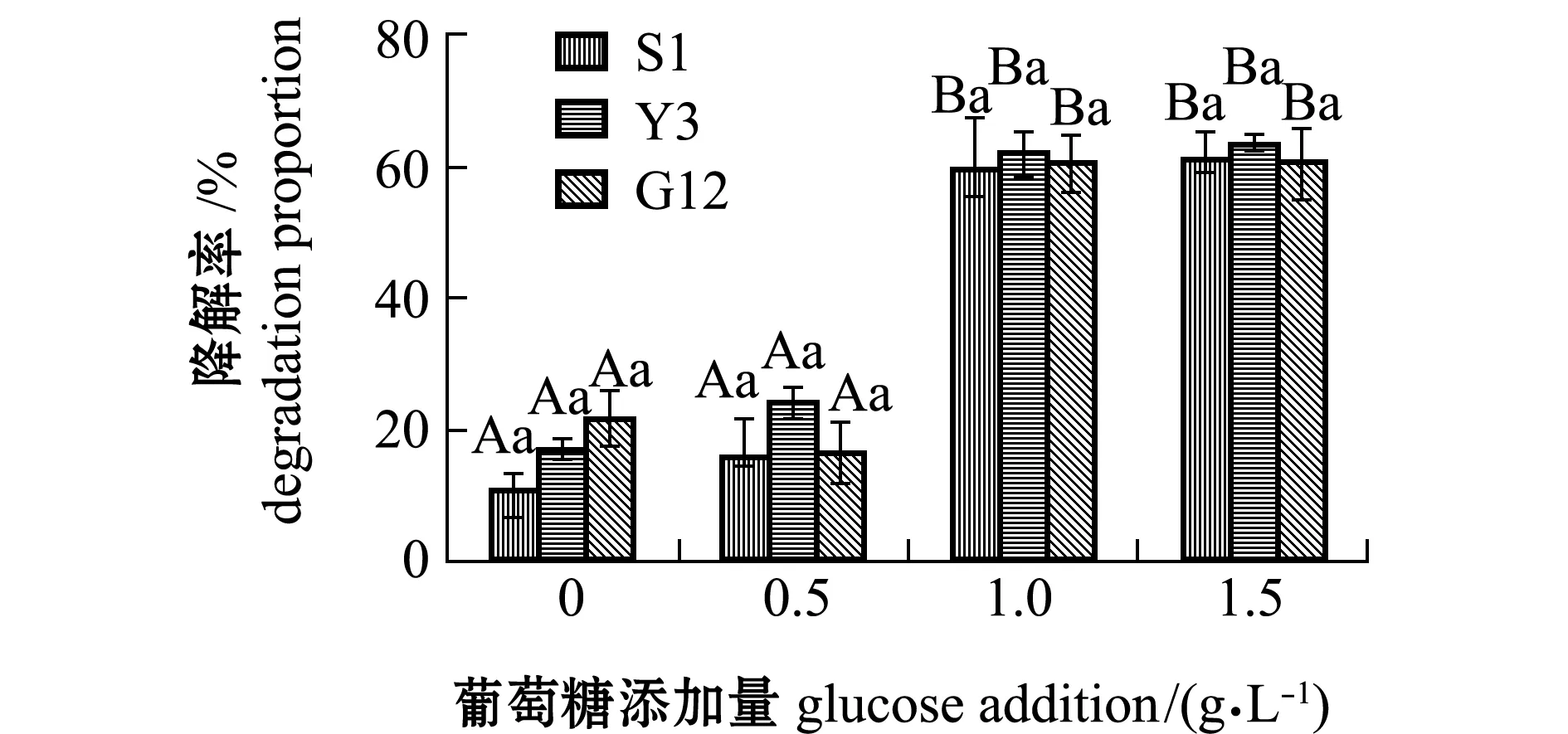
图7 3株菌对标准品菲的降解率Fig.7 Degradation proportion of 3 strains on phenanthrene
从图8可见:Y3菌株在无葡萄糖添加时,具有较高的菲降解速率[1.092×10-7ng/(CFU·d)],与S1菌株[2.569×10-8ng/(CFU·d)]相比有显著性差异(P<0.05),与G12菌株[7.975×10-8ng/(CFU·d)]无显著性差异(P>0.05);随葡萄糖浓度的增加,3株菌对菲的降解速率均呈下降趋势,且均较无糖组显著下降(P<0.05),各葡萄糖浓度下,3株菌对菲的降解速率或同一葡萄糖浓度下不同菌株之间均无显著性差异(P>0.05)。
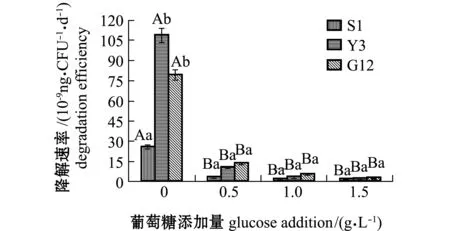
图8 3株菌对标准品菲的降解速率Fig.8 Degradation efficiencies of 3 strains on phenanthrene
2.2.3 试验菌对惹烯的降解率及单位细胞的降解速率 经计算得出,惹烯在含0、0.5、1.0、1.5 g/L葡萄糖的无机盐培养基中7 d后,自然降解率分别为0%、3.79%、1.20%、1.49%。从图9可见:无葡萄糖组,S1 、Y3和G12菌株对惹烯的降解率分别为0.05%、 5.18%和10.22%,且3株菌间有显著性差异(P<0.05),降解率依次为G12>Y3>S1;添加0.5 g/L葡萄糖浓度时,3株菌降解率均有所提高,降解率依次为G12>Y3>S1,与无葡萄糖添加相比,S1菌株对惹烯的降解率显著提高(P<0.05),Y3、G12菌株增加不显著(P>0.05);添加1.0 g/L葡萄糖时,3株菌对惹烯的降解率达到最高,降解率依次为Y3(66.49%)>G12(66.42%)>S1(66.18%);添加1.5 g/L葡萄糖浓度时,3株菌的降解率与1.0 g/L时的降解率无显著性差异(P>0.05),且3株菌间也无显著性差异(P>0.05)。
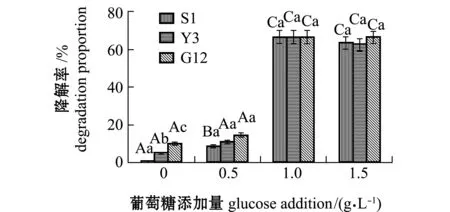
图9 3株菌对标准品惹烯的降解率Fig.9 Degradation proportion of 3 strains on retene
从图10可见:在无葡萄糖添加情况下,G12、Y3和S1菌株对惹烯的降解速率分别为3.859×10-7、1.012×10-7、6.835×10-8ng/(CFU·d),G12菌株显著高于S1和Y3菌株(P<0.05);在添加不同浓度葡萄糖后,G12菌株对惹烯的降解速率显著降低(P<0.05),其他2株菌对惹烯的降解速率也显著降低(P<0.05),但幅度不如G12菌株,不同葡萄糖浓度下3株菌对惹烯的降解速率相差不大,同一葡萄糖浓度下不同菌株间也无显著性差异(P>0.05)。
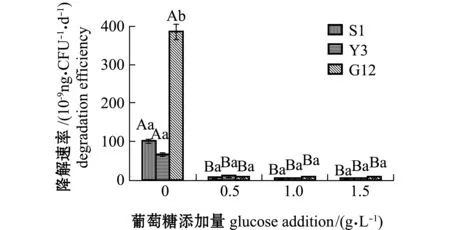
图10 3株菌对标准品惹烯的降解速率Fig.10 Degradation efficiencies of 3 strains on retene
2.2.4 试验菌对苯并[α]芘降解率及单位细胞的降解速率 经计算得出,苯并[α]芘在含0、0.5、1.0、1.5 g/L葡萄糖的无机盐培养基中7 d后,自然降解率分别为0.05%、0.06%、1.75%、1.86%。从图11可见:无糖添加时,S1、Y3和G12菌株对苯并[α]芘的降解率分别为2.49%、5.46%和5.49%,且3株菌间无显著性差异(P>0.05);添加0.5 g/L葡萄糖浓度时,3株菌对苯并[α]芘的降解率显著提高,降解率依次为S1>Y3>G12,但3株菌间降解率无显著性差异(P>0.05);1.0、1.5 g/L浓度组间的降解率和同一浓度下各菌株对苯并[α]芘的降解率均无显著性差异(P>0.05),最高分别为S1(71.91%)、Y3(71.25%)和G12菌株(70.50%)。
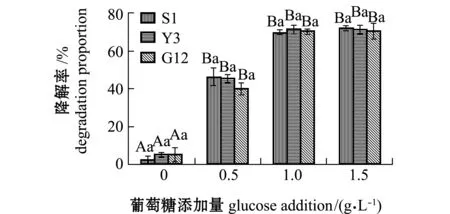
图11 3株菌对标准品苯并[α]芘的降解率Fig.11 Degradation proportion of 3 strains on benzo [α] pyrene
从图12可见:在无糖添加时,G12菌株对苯并[α]芘的降解速率为3株菌中最高,达到1.943×10-8ng/(CFU·d),其次为Y3菌株,为1.244×10-8ng/(CFU·d),S1菌株最低,为9.651×10-9ng/(CFU·d);3株菌对苯并[α]芘的降解速率均随葡萄糖添加量的增加呈下降趋势,3株菌对苯并[α]芘的降解速率在加糖后均显著低于不加糖组(P<0.05),G12菌株在0.5 g/L和1.0 g/L葡萄糖时对苯并[α]芘的降解速率显著高于其他2株菌(P<0.05),在1.5 g/L葡萄糖时3株菌对苯并[α]芘的降解速率无显著性差异(P>0.05)。
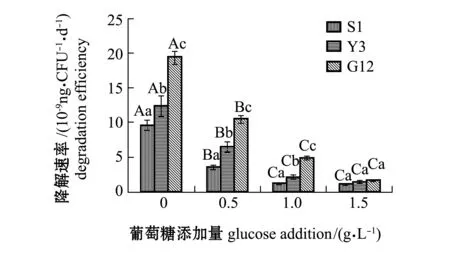
图12 3株菌对标准品苯并[α]芘的降解速率Fig.12 Degradation efficiencies of 3 strains on benzo [α] pyrene
3 讨论
3.1 试验菌株对4种PAHs的降解性能
本研究中选用的3株菌中,S1菌株是翅碱蓬根系表面附着细菌,经鉴定为微杆菌属Microbacteriumsp.,G12菌株是翅碱蓬根系内生菌,经鉴定为刘志恒菌Zhihengliuellsp.,Y3菌株为恶臭假单胞菌Pseudomonasputida,3株菌均耐盐生长。3株菌在无糖的4种PAHs-无机盐培养基中的生长状况显示,在萘-无机盐培养基中生长状况最好,在菲、惹烯、苯并[α]芘-无机盐培养基中长势较弱。分析其原因,可能与萘结构简单易于分解有关[23]。添加葡萄糖后,3株菌在4种PAHs-无机盐培养基中的生长量均有显著增加,G12菌株在葡萄糖添加量为1.0 g/L的苯并[α]芘-无机盐培养基中的生长量是无糖对照组的4倍,长势优于S1和Y3菌株。S1菌株在无糖的萘和菲-无机盐培养基中生长量高于其他2株菌,当葡萄糖添加量为1.0 g/L时,S1菌数与无糖添加时相比,分别增加了两个数量级(菲)和一个数量级(萘)。因此,S1菌株对结构简单的萘具有较好的利用性,G12菌株对结构复杂的苯并[α]芘有更好的利用性能,1.0 g/L葡萄糖即可显著提高3株菌在4种PAHs-无机盐培养基中的生长量。
对比4种PAHs的自然降解率和在含糖培养基中的降解率数据,萘的自然降解率最高,为5.49%,其他依次为菲、惹烯、苯并[α]芘,说明低分子量芳香烃较易在自然条件下被降解,而高分子量的苯并[α]芘较难以自行降解。培养基中加入不同浓度葡萄糖后,自然降解率有所改变,但差异不显著。3株试验菌在无糖添加时,均可有效降解4种PAHs,除S1菌株对惹烯的降解性能较差外,其他2株菌对惹烯的降解率与自然降解率比较,差异明显。添加葡萄糖后可显著提高3株菌对4种PHAs的降解率,虽然添加1.0、1.5 g/L葡萄糖浓度时3株菌的降解率均较高,但二者无显著性差异,从经济角度考虑,认为最适添加浓度为1.0 g/L。3株菌单位细胞降解速率结果显示,3株菌在添加不同浓度葡萄糖时,单位细胞的降解速率出现明显下降,且与葡萄糖浓度成反比关系。
目前,有关微生物降解PAHs的研究主要为土壤环境分离菌的相关报道,徐中阳等[24]、 廉景燕等[25]仅报道了不同种假单胞菌在3~4 d时对较高浓度加标萘的降解性能,而对耐盐微生物对PAHs的降解性能研究较少。王慧等[14]利用5%盐度矿物培养基(MSM)从石油污染土壤中富集分离出一株能降解多种PAHs的嗜盐菌TSL5-2菌株,鉴定为海旋菌Thalassospirasp.,该菌在5%盐度下25 d内,对菲、芘、荧蒽(初始质量浓度均为20 mg/L)、苯并蒽(初始质量浓度为8 mg/L)具有不同的降解率,但不能降解苯并[α]芘。王春明等[15]从胜利油泥中分离到的微杆菌3-28菌株Microbacteriumsp.3-28在萘、菲-无机盐培养基中生长状况较好,对萘、菲、蒽和芘均有较高的降解能力,单独作用112 h后萘与菲完全降解,而蒽和芘28 d时的降解率分别为97.54%、90.2%,3-28菌株也能够在盐度为10~30 g/kg的环境中良好生长。本研究中,PAHs浓度设置为20 mg/L,无葡萄糖添加时,微杆菌S1对4种PAHs的降解率均较低,在添加葡萄糖后,S1对萘、菲、惹烯、苯并[α]芘的降解率均有大幅提高,这与微杆菌3-28有一定差别。综上所述,土壤中存在的假单胞菌、微杆菌中的菌株具有降解不同PAHs的能力,同时能够耐盐生长。有关刘志恒菌(G12菌株)对PAHs降解性能的研究尚未见报道,尤其该菌株为翅碱蓬根系内生菌,因此,与翅碱蓬的相关性及在环境中的作用今后需要深入研究。另外,G12菌株的生物学特性目前也较少报道。本研究结果表明,该菌在无葡萄糖添加时,除对萘的降解率低于其他2株菌外,对菲、惹烯和苯并[α]芘的降解率明显高于S1菌株。鉴于这2株菌均分离自翅碱蓬,因此,该菌株作为滩涂耐盐植物共栖菌,可能在去除沿海沉积质中PAHs污染物方面具有潜在应用价值。
3.2 试验菌株对PHAs降解的共代谢作用机理
自然界微生物对很多复杂有机物的降解均存在共代谢作用。微生物共代谢(cometabolism)作用机理包括3种形式:第一种,基本生长基质存在时,可为微生物代谢提供充足的碳源和能源,同时诱导微生物产生降解非生长基质的某些关键酶[26];第二种,某些污染物在自然界中难于降解的根本原因在于微生物缺乏某些特定的关键酶或酶的活性不高[27],如果微生物本身存在对这些物质的降解酶类,但酶活性并不高,从而使这种非生长基质不能有效利用,微生物生长缓慢,而共代谢物作为生长基质提供了基础碳源和能源,促进了微生物的生长,群体的降解性能得到大幅度提升;第三种,在自然环境中或者混合培养中,微生物之间存在共酶效应,使得一种微生物部分分解的非生长基质成为其他种类微生物的生长基质,从而达到消除环境污染物的效果。
共代谢普遍存在于自然界不同环境中,当出现微生物难以直接利用的化合物时,其以不同的形式促进了环境污染物的降解。Chen等[28]运用假单胞菌,以菲为共代谢底物,对加标浓度为10 mg/L苯并[α]芘培养基作用48 h,苯并[α]芘的去除率为32%。巩宗强等[29]在研究芘在土壤中的共代谢降解特性时发现,微生物对芘的自然降解作用较缓慢,一般半衰期为20 d,但加入共代谢底物后25 d时芘的降解率可达80%。李政等[30]采用假单胞菌等复合降油菌剂处理多环芳烃,发现单一多环芳烃的生物降解中,结构简单的芴和菲的降解效果最好,在第7天时基本生成其他产物,而芘的降解效果最差。当3种多环芳烃混合降解时,芴、菲和芘分别在第3、5、8天时得到完全去除,呈现明显的共代谢作用。近期刁硕等[16]报道了一株低温耐盐芘降解菌DYC-1菌株(红球菌Rhodococcussp.)在高盐和低温状况下,添加不同共代谢底物后对芘的降解特性结果显示,葡萄糖、水杨酸和菲可显著提高试验菌株对芘的降解率,其中添加0.1 g/L葡萄糖时,降解率可达30%。
本研究结果显示,在未添加基础碳源(葡萄糖)时,3种菌对4种PAHs均具有一定的降解作用,葡萄糖添加后3株菌较无糖时对PAHs的降解率大幅度提升,添加1.0 g/L葡萄糖时,对萘的降解率分别提高了44.06%(S1)、70.56%(Y3)和50.98%(G12),对菲的降解率分别提高49.66%(S1)、45.87%(Y3)和38.29%(G12),对惹烯的降解率分别提高66.13%(S1)、61.31%(Y3)和56.20%(G12),对苯并[α]芘的降解率分别提高69.42%(S1)、65.79%(Y3)和65.01(G12),单个细胞降解速率均大幅度降低。据此认为,所采用的3株菌基本符合共代谢的第二个机理。从加糖后降解率提高的情况分析,结构相对复杂的惹烯和苯并[α]芘降解率提升幅度较大,因此,不能排除细胞内某种酶的活性发生改变,或某种酶被诱导产生的可能性,更为深入的分子机理有待下一步进行蛋白质组学和代谢组学的研究。
3.3 共代谢底物添加量对降解性能的影响
目前,土壤环境污染物的共代谢作用研究较多,包括多环芳烃的共代谢降解[31-32]。微生物对难降解有机物的共代谢基质因不同环境、不同微生物和不同底物而不尽相同。就多环芳烃而言,某些低分子的多环芳烃本身也可以作为复杂多环芳烃的共代谢基质[33-34],不同共代谢底物使得微生物目标化合物的降解率也有所不同。葡萄糖作为最基本的共代谢基质对微生物降解复杂有机物有较确切的作用[17]。本研究中,葡萄糖的添加量根据前期研究工作中3株菌对柴油降解时葡萄糖的添加量而设计。陈芳艳等[35]在研究外加碳源条件下尖镰孢菌对蒽的降解中发现,不同的葡萄糖浓度对蒽的降解情况有不同的影响,当葡萄糖浓度为1 mg/L时,蒽的含量变化较小;当葡萄糖浓度为5 mg/L时,蒽的去除率达到了95%;当葡萄糖浓度增加到20 mg/L时,蒽的降解率降为84.8%。据此认为,外源物质的添加量是调控底物共代谢性能的主要考察指标。在一定范围内,微生物对有机污染物的降解率随添加物含量的增加而提高。但超过一定剂量后,添加物的含量过高则抑制微生物的代谢活性乃至改变其生长状态。本研究中,葡萄糖的加入量为0.5 g/L时,3株菌对4种PAHs的降解率与无糖对照相比提高不够显著,当葡萄糖添加到1.0 g/L时,3株菌对4种PAHs均显著甚至极显著的提高,但葡萄糖添加1.5 g/L与1.0 g/L时相比差异并不显著,建议在实际应用中,葡萄糖添加量选用1 g/L或1 g/kg。
共代谢基质的添加是今后海洋多环芳烃污染修复中一个重要强化措施,本研究中所采用的3株菌中,S1和G12菌株分离自翅碱蓬,与翅碱蓬根系有较好的可接受性,可作为强化定植菌种用于构建降油菌-翅碱蓬复合载体,Y3菌株也可用于根际土壤强化,形成降油细菌-植物修复系统,应用于海洋滩涂沉积质中石油类和多环芳烃类污染物的去除,同时以科学的方法添加共代谢底物,达到高速率的修复效果。在海洋环境多环芳烃的修复过程中,共代谢基质的类型、添加量和添加方式是今后需要深入研究的问题。鉴于海洋环境多环芳烃污染的生物修复目前仍处于起步阶段,菌种的选择、环境影响因素、共代谢底物类型和降解菌共代谢的分子机理等均有待于深入的研究,力求能够较系统地探明有关科学问题,有效采用生物修复技术解决海洋环境多环芳烃污染状况。

