重组绵羊肺表面活性物质结合蛋白A的体外生物学活性检测
李增强,赵宁,张彦兵,李珂儿,魏立翔,孙延鸣
(石河子大学动物科技学院,新疆 石河子 832003)
在哺乳动物的肺泡表面覆盖有一层肺表面活性物质的蛋白(surfactant-associated protein,SP),SP分为 SP-A、SP-B、SP-C 和 SP-D共4种,其中SP-A为亲水的蛋白质,其含量在SP中约占50%,是肺泡表面的主要免疫防御和免疫调节分子[1],主要由肺泡Ⅱ型(AT-Ⅱ)细胞合成,也可以通过细支气管非纤毛上皮细胞(clara 细胞)和黏膜下层细胞分泌。SP-A是Ca2+依赖性的胶原凝集素成员,分子结构中均含有氨基N端区、胶原蛋白样区、颈区和凝集素活性区(即糖识别区,CRD)4个结构域,其中凝集素区可介导凝集素与多种不同病原体(细菌、病毒、真菌等)表面的糖类物质结合,引起病原体的凝集。研究发现,结合病原体的SP-A能增强吞噬细胞活性,促进吞噬作用;此外,SP-A可与巨噬细胞膜上受体结合,调理巨噬细胞对病原体的吞噬[2]。以往研究证实,人的SP-A不仅能显著增强IgG抗体介导的中性粒细胞对病原体的吞噬[3],还能以抗体非依赖的方式促进中性粒细胞吞噬杀灭病原菌[4]。中性粒细胞受抗原刺激后能够脱颗粒释放一种具有降解毒力因子和杀菌功能的中性粒细胞弹性蛋白酶(neutrophil elastase,NE),属于丝氨酸蛋白酶家族成员[5],NE能够抑制肺炎支原体(Mycoplasmapneumoniae,Mp)的生长[6]。研究证明,人的SP-A能够抑制大肠杆菌、金黄色葡萄球菌、肺炎链球菌等细菌的生长,表现出明显的抗菌活性[7-8]。此外,SP-A不仅在过敏反应和炎症的消退过程中发挥重要作用[9],还具有重要的抗病毒感染[10]和免疫调节功能[11]。
尽管人们对人和小鼠的SP-A有比较深入的研究,但对其他动物SP-A的研究报道较少。为此本实验室利用真核表达系统表达重组绵羊SP-A,并发现SP-A能够显著抑制绵羊肺炎支原体(Mycoplasmaovipneumoniae,Mo)的生长[12]。为了更深入探讨绵羊SP-A的功能,本研究对重组绵羊肺表面活性物质结合蛋白A(rSP-A)的部分体外生物学活性进行了检测分析,为进一步研究SP-A在绵羊体内的生物学特性以及将其作为抗菌制剂的临床应用奠定基础。
1 材料与方法
1.1 主要材料
绵羊由石河子大学动物科技学院实验站提供;rSP-A按照王继雪等[13]构建的重组绵羊SP-A毕赤酵母GS115真核表达系统诱导表达rSP-A,用His标签的Ni-NTA树脂纯化表达产物,经SDS-PAGE鉴定、浓缩后冻存于-80 ℃冰箱备用。酵母抽提物为GS115/pPIC9K空载体表达的产物。Mo 1412株为临床兽医学实验室保存菌种,与Mo Y-98标准株的同源性为98%;羊巴氏杆菌(CVCC3045)和肺炎链球菌(ATCC10015)由预防兽医学实验室馈赠。
1.2 主要试剂
牛脑心浸液(BHI)和支原体肉汤培养基购自青岛高科技工业园海博生物技术有限公司;HEPES购自北京博奥拓达科技有限公司;对硝基苯胺购自上海麦克林生化科技有限公司;RPMI 1640培养基购自赛默飞世尔生物化学制品(北京)有限公司;马血清、胎牛血清(FBS)和四肽底物(N-(methoxysuccinyl)-Ala-Ala-Pro-Val p-nitroanilide)均购自Sigma公司;羊外周血中性粒细胞分离液试剂盒、羊外周血淋巴细胞分离液试剂盒和MTT细胞增殖及细胞毒性检测试剂盒均购自北京索莱宝科技有限公司。
1.3 rSP-A对NE活性的调节作用测定
1.3.1 标准曲线的建立
使用甲醇配制浓度为2 mmol/L的对硝基苯胺标准溶液,二倍倍比稀释后(0.5~0.002 mmol/L)使用酶标仪测定各孔OD405值,甲醇作为空白对照;以标准液浓度为横坐标、OD405值为纵坐标绘制标准曲线,生成回归方程。
1.3.2 NE活性的检测
参照文献[6],向RPMI 1640培养基(含10%胎牛血清)中加入rSP-A,使其终浓度分别为0、10、20、40、80和160 μg/mL;颈静脉采集绵羊抗凝血液,使用羊外周血中性粒细胞分离液试剂盒分离中性粒细胞,添加含rSP-A的细胞培养基制成细胞悬液,调整细胞密度为1×106个/mL;Mo菌液(106CCU/mL)以12 000 r/min离心10 min后,收集菌体并按感染复数(MOI)为10∶1感染中性粒细胞。37 ℃、5% CO2条件下培养2 h后收集上清(含NE),与等体积0.1 mol/L HEPES缓冲液(含0.5 mmol/L NaCl,pH=7.5)混合后移入96孔板;每孔加入等量四肽底物(200 μL反应体系),37 ℃孵育5 min后用酶标仪测定菌液的OD405值,每孔重复3次。根据回归方程计算NE水解四肽底物生成的对硝基苯胺浓度。
1.4 rSP-A对淋巴细胞增殖的影响
参照文献[14],使用羊外周血淋巴细胞分离液试剂盒分离淋巴细胞,用台盼蓝染色法检测淋巴细胞活率后,体外培养于添加有rSP-A的RPMI 1640培养基,rSP-A终浓度分别为0、5、10、20、40和80 μg/mL;此外,另一试验组还需添加植物血凝素(PHA)至终浓度为5 μg/mL,每组3个重复;37 ℃、5% CO2条件下培养24、48和72 h,终止培养前4 h每孔加入10 μL MTT溶液,4 h后离心弃上清,每孔添加110 μL Formazan溶解液,低速振荡10 min后使用酶标仪测定各孔OD490值。MTT结果以刺激指数(SI)表示,即:PHA组OD490值/未刺激组OD490值。
1.5 rSP-A对Mo生长代谢和增殖的影响
参照文献[15],向Mo培养基中添加5%体积的0.4%酚红指示剂和CaCl2(终浓度为5 mmol/L),同时添加rSP-A至终浓度分别为0(用等量酵母提取物替代)、10、20和40 μg/mL,按照培养基与Mo菌液(106CCU/mL)体积比为4∶1的比例接菌,每组3个重复;37 ℃、5% CO2条件下培养0、1、3、5和7 d,使用酶标仪检测各组Mo菌液OD550值,并参考文献[16]测定Mo的菌落数。
1.6 rSP-A抗菌活性分析
参照文献[17],配制含CaCl2(终浓度为5 mmol/L)和rSP-A的脑心浸液肉汤(BHI)培养基,rSP-A含量分别为0(用等量酵母提取物替代)、40、80、120、160和200 μg/mL;按1%的接种量将巴氏杆菌和肺炎链球菌接种于上述培养基中,37 ℃、200 r/min震荡培养6、12和24 h,每组3个重复;各阶段培养结束后,使用平板菌落计数法测定菌液的含菌量。
1.7 数据处理
使用SPSS 24.0软件对试验数据进行One-way ANOVA分析,试验数据以“平均值±标准差”表示;P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 rSP-A对NE活性的调节作用
根据梯度稀释的对硝基苯胺标准液浓度和OD405值绘制标准曲线(图1),得到回归方程y=7.132 8x+0.027 2,回归系数R2=0.994 5。

图1 标准品线性回归曲线
各浓度rSP-A组的NE活性分析结果(图2)显示,20、40、80、160 μg/mL rSP-A组的NE活性均显著或极显著高于对照组(P<0.05或P<0.01),随着rSP-A浓度的升高,NE活性明显增强,说明rSP-A可显著增强Mo感染中性粒细胞释放的NE活性。

注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。下同
2.2 rSP-A对淋巴细胞体外增殖的影响
MTT检测结果(图3)显示,淋巴细胞体外培养24、48和72 h时,SI均随培养液中的rSP-A浓度的增高而减小,且对照组的SI始终大于其他各组。培养24 h后,10 μg/mL组的SI显著小于对照组(P<0.05),20、40和80 μg/mL组的SI极显著小于对照组(P<0.01);培养48 h后,20、40 μg/mL组的SI显著小于对照组(P<0.05),80 μg/mL组的SI极显著小于对照组(P<0.01);培养72 h后,20、40、80 μg/mL组的SI显著或极显著小于对照组(P<0.05或P<0.01),80 μg/mL组的SI极显著小于20 μg/mL组(P<0.01)。结果表明rSP-A对淋巴细胞体外增殖活性具有明显的抑制作用。
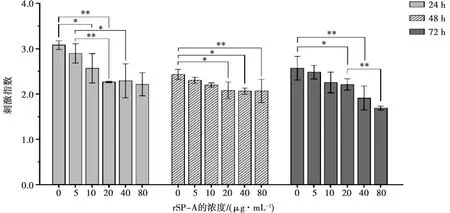
图3 rSP-A对淋巴细胞体外增殖活性的影响
2.3 rSP-A对Mo生长代谢和增殖的影响
rSP-A对Mo代谢的检测结果见图4,培养1 d后,20与40 μg/mL组Mo菌液OD550值显著低于对照组(P<0.05);培养3、5和7 d后,各试验组Mo菌液OD550值均极显著低于对照组(P<0.01),说明rSP-A对Mo的生长代谢有明显的抑制作用。
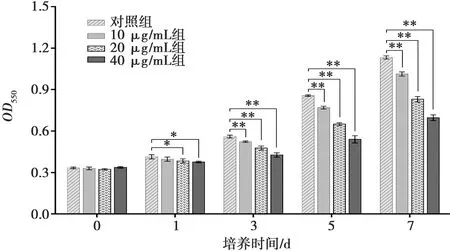
图4 rSP-A对Mo代谢的影响
Mo平板菌落计数结果(图5)显示,Mo活菌数随培养时长的增加而增多。培养时间超过3 d时,各组菌液浓度出现了显著性差异,rSP-A浓度越高,菌液浓度越低。培养3 d后,20与40 μg/mL组的Mo菌液浓度显著低于对照组(P<0.05、P<0.01);培养5 d或7 d后,各试验组的Mo菌液浓度均显著或极显著低于对照组(P<0.05、P<0.01)。结果表明,rSP-A可明显抑制Mo的体外增殖。

图5 Mo平板菌落计数结果
2.4 rSP-A的抗菌活性分析
肺炎链球菌和巴氏杆菌体外培养6、12和24 h后的菌液浓度检测结果(图6和图7)显示,2种菌液浓度变化均呈先增后降的趋势。对比各组菌液浓度差异可知,随着rSP-A添加量的增多,2种细菌的菌液浓度均显著或极显著降低(P<0.05、P<0.01);由此可知,rSP-A对致病性肺炎链球菌和巴氏杆菌均有明显抗菌活性。
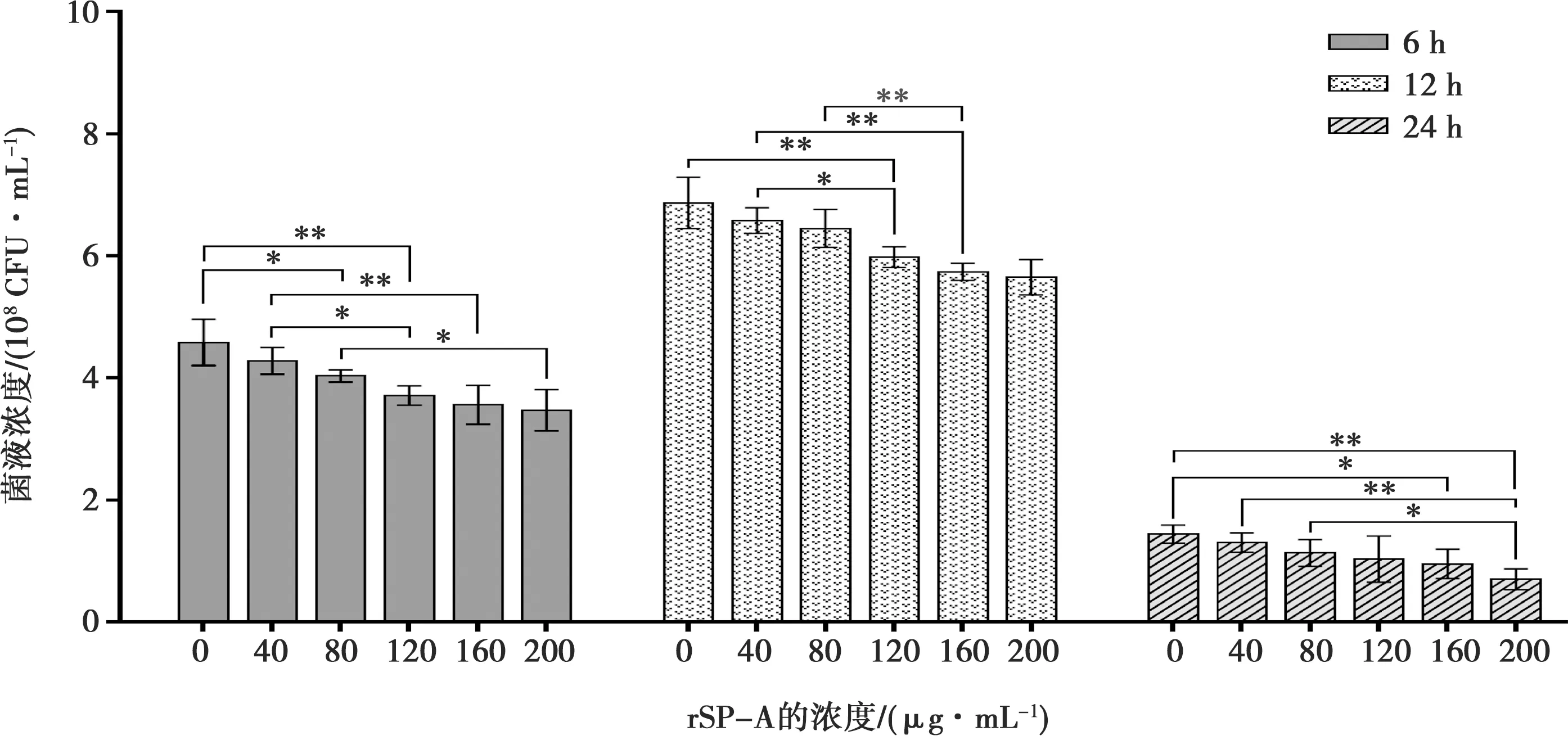
图6 rSP-A对肺炎链球菌的抗菌活性

图7 rSP-A对巴氏杆菌的抗菌活性
3 讨论
当呼吸道受到病原菌侵袭并发生炎症时,中性粒细胞便会发生聚集、活化及脱颗粒,释放NE[18]。NE是一种丝氨酸蛋白酶,能够破坏病原菌的结构,并促进吞噬细胞吞噬细菌,参与机体免疫防御。在NE活性检测试验中,不同浓度rSP-A与Mo感染的中性细胞共同孵育了2 h,由于rSP-A对Mo增殖具有抑制作用,从理论上来讲,各组Mo数量可能会有差异,从而影响NE的释放量,最终会影响试验结果。但实际上,Mo在本试验中的作用主要是刺激中性粒细胞释放NE,虽然rSP-A对Mo具有抑制作用,但Mo生长极其缓慢且本试验作用时间仅有2 h,所以rSP-A对Mo的作用很小,可忽略不计,不会干扰试验结果。在本试验中,rSP-A能显著增强Mo刺激中性粒细胞释放的NE的活性,提示rSP-A可能通过促进Mo介导的中性粒细胞的活化及NE的释放,使得NE活性进一步增强,有助于病原体的清除。然而,NE在动物体内也是一种具有破坏性的蛋白溶解酶,可破坏自身正常组织的完整性,与许多疾病的病理过程密切相关[19]。SP-A与NE同是机体的免疫蛋白分子,在体内是否存在某种关系,是今后需要研究的课题。
MTT试验结果表明,rSP-A能明显抑制淋巴细胞的增殖。Borron等[20]采用D-甘露糖亲和层析法从牛支气管肺泡灌洗液中分离纯化出天然SP-A,并使用氚化胸腺嘧啶核苷渗入法测定了该蛋白对人外周血淋巴细胞体外增殖的影响,结果证实了牛SP-A对淋巴细胞增殖具有明显抑制作用。本试验结果与之相似。
抗菌试验证明,rSP-A对肺炎链球菌、巴氏杆菌均有明显的抑制作用,该结果与张永红等[21]报道猪SP-A的抗菌活性结果相似。近几年,人们对SP-A的抗菌机制进行了研究,初步证实SP-A主要通过发挥调理素作用和对吞噬细胞吞噬/杀伤能力的增强作用,间接实现其抗菌作用[22]。此外,SP-A还具有直接抗菌作用,如SP-A可增强革兰阴性菌细胞膜通透性,抑制细菌的增殖。
绵羊支原体肺炎在我国发病率较高,其病原Mo对大多数抗生素均不敏感,临床治疗效果不佳。Mo基因组小,其自身生物合成能力较弱,体外培养主要以培养液中的葡萄糖作为能量来源。Mo分解葡萄糖产生的酸会改变培养液的pH值,酚红作为一种酸碱指示剂可根据溶液酸碱度发生颜色变化,使用酶标仪测定OD550值可间接反映Mo分解代谢葡萄糖的情况。本研究利用这一原理测定了rSP-A对Mo代谢的影响,结果发现rSP-A能够显著抑制Mo的生长代谢;同时应用平板菌落计数法检测了不同时期各组Mo菌量,证实rSP-A能够显著抑制Mo的增殖。赵宁等[12]利用平板菌落计数法和荧光定量PCR技术也证实了rSP-A对Mo具有抑菌活性。那么,rSP-A是通过抑制Mo的代谢而发挥其抑菌作用,还是其对Mo的抑菌作用导致Mo代谢减弱,这也是今后要深入探讨的问题。
呼吸系统疾病是阻碍养羊业健康发展的主要疾病之一,本试验选择了羊的肺炎链球菌、巴氏杆菌和Mo为试验对象,这是因为上述致病菌均是羊呼吸系统疾病的常见病原,为将来SP-A被开发为一种抗菌制剂广泛应用于羊的呼吸系统疾病的防治奠定基础。

