非洲猪瘟病毒逃逸抗病毒干扰素相关天然免疫应答的研究进展
罗佳,倪敬花,姜森,肖延昭,朱建中
(扬州大学兽医学院/江苏省动物重要疫病与人兽共患病防控协同创新中心/农业与农产品安全国际联合研究实验室,江苏 扬州 225009)
非洲猪瘟(African swine fever, ASF)是一种对家猪和野猪具有毁灭性打击的疾病,死亡率高达100%。目前世界上没有有效的疫苗,动物屠宰和区域检疫是控制该病的唯一方法,没有其他有效措施来控制疫情的蔓延,ASF给世界各国养猪业都造成了巨大的经济损失[1-3]。自从上世纪20年代在肯尼亚首次发现ASF以来,该病在非洲大陆迅速传播,并一直存在于撒哈拉以南非洲国家。1957年,ASF首次传播到欧洲,并一直在西班牙和葡萄牙流行,直到上世纪90年代中期才根除。ASF还传播到其他欧洲国家以及加勒比国家(古巴、多米尼加共和国和海地)和巴西,其中撒丁岛自1982年以来一直流行该病,除了撒丁岛外,上述国家均已根除该病[4]。自2007年以来,由于航运废物处理不当,ASF被引入格鲁吉亚共和国,随后蔓延到包括亚美尼亚、俄罗斯在内的东欧国家[5-6]。2017年,西伯利亚靠近中俄边境地区发生了多起ASF疫情[7]。而在2018年8月3日,非洲猪瘟首次在中国暴发,中国养猪业面临一场前所未有的灾难和挑战[8]。
非洲猪瘟是由非洲猪瘟病毒(African swine fever virus, ASFV)引起的,ASFV是一种大型、复杂的细胞质双链DNA病毒,它不仅是非洲猪瘟病毒科(Asfarviridae)家族的唯一成员,也是唯一虫媒DNA病毒[9]。ASFV是一种大型的包膜病毒,其二十面体由内而外具有4个同心圆层:中心拟核、核心壳层、内包膜和二十面体衣壳[10]。ASFV的平均直径约为200 nm,病毒基因组长度随着分离株的不同存在差异,范围在170~193 kbp之间,包含151到167个开放阅读框架[11]。
ASFV必须在体内复制才能建立感染。面对宿主强大的免疫机制,它进化出一系列的免疫逃避机制来逃避宿主的免疫应答。天然免疫是宿主免疫防御的第一步,其中干扰素(interferons, IFNs)是至关重要的天然免疫抗病毒因子。本文就IFNs的免疫效应和ASFV免疫逃逸Ⅰ型干扰素(type Ⅰ interferon, IFN-Ⅰ)相关免疫应答及其机制进行简要综述。
1 干扰素与宿主抗病毒天然免疫
1.1 干扰素的分类
1957年,Isaacs和Lindenmann利用鸡绒毛尿囊膜,观察到一种细胞因子能明显抑制流感病毒复制,并将之命名为IFNs。IFNs是一种广泛表达的细胞因子,与宿主免疫反应密切相关,可以诱导有效抗病毒反应,抑制病毒复制。根据其细胞来源和理化性质可将IFNs分为Ⅰ、Ⅱ和Ⅲ 共3大类。 IFN-Ⅰ是重要的抗病毒细胞因子,主要包括α、β、ε、κ和ω这5种类型,而α有13种亚型,因此共有17种IFN-Ⅰ亚型。当病毒感染宿主时,宿主的天然免疫模式识别受体(pattern recognition receptors, PRRs)识别病原体相关分子模式(pathogen associated molecular patterns, PAMPs),诱导一系列细胞内的信号级联反应,引起IFN-Ⅰ基因转录和蛋白表达,并通过诱导大量的干扰素刺激基因(interferon-stimulated genes, ISGs)表达,在细胞微环境中建立一种抗病毒感染状态[12]。目前研究表明,ASFV主要影响IFN-Ⅰ的产生和作用来逃逸宿主的抗病毒反应。但是关于其他类型IFNs的报道却很少。Ⅱ型干扰素也称为IFN-γ,是一个重要的免疫调节因子,主要由NK细胞和T细胞产生,能够增强抗原提呈,并促进NK和巨噬细胞的活化从而增强其吞噬功能,在免疫调节方面发挥着重要的作用[13]。Ⅲ型干扰素是IFN-λ,包括IFN-λ1、λ2、λ3、λ4亚型,IFN-λ同IFN-Ⅰ功能类似,也能诱导大量ISGs表达发挥强而有效的抗病毒作用[14]。由于IFN-λ由黏膜细胞表达分泌,能够诱导抗病毒天然免疫应答,这意味着IFN-λ在黏膜免疫中发挥巨大作用。而ASFV主要通过呼吸道和消化道侵入机体,主要触发黏膜免疫,能有刺激诱导大量的IFN-λ的产生,虽然目前还没有明确的报道IFN-λ对ASFV的作用,但可以推测IFN-λ可能在ASFV抗病毒免疫中发挥巨大作用,也有可能是ASFV为了生存,通过某些方式拮抗了IFN-λ的产生机制,从而抑制IFN-λ的抗病毒反应。目前IFN-λ在ASFV感染过程中发挥的作用尚不清楚,有待于进一步研究。
1.2 干扰素的抗病毒作用机制
IFNs具备多种功能,主要有抗病毒、抗肿瘤和免疫调节作用等。IFN-Ⅰ是发挥抗病毒作用的主要IFNs,能通过激活经典的JAK-STAT信号通路诱导多种ISGs的表达。ISGs是抗病毒作用的直接效应蛋白,不同的ISGs能够针对病毒生活周期的各个阶段并利用多种机制发挥作用,包括病毒入侵、脱衣壳、基因复制转录、蛋白翻译和病毒颗粒释放等方面。
ISG抑制病毒入侵:Mx蛋白具有非常广谱的抗病毒活性,Mx蛋白除了能够对许多RNA病毒有显著抗病毒活性外,还能抑制大型胞质DNA病毒的复制,如ASFV[15]。人类细胞中有2种Mx蛋白,分别为Mx1和Mx2(也称MxA和MxB)。Mx1能够与病毒衣壳相结合,阻止病毒入侵细胞;Mx2能够抑制人类免疫缺陷病毒(HIV)壳侵入细胞核,从而阻止反转录基因组入核,阻断HIV的复制。IFITM蛋白家族有4个成员:IFITM1、IFITM2、IFITM3和IFITM5,在抑制病毒进入细胞过程中也发挥作用。IFITM蛋白对其抑制的病毒表现出选择性,比如:IFITM1可以抑制丙肝病毒(HCV)感染,但IFITM3不能[16]。
ISG抑制病毒蛋白质合成:病毒利用宿主的核糖体进行蛋白翻译,合成各种蛋白进行和维持正常的生命活动。ISG蛋白能够通过抑制蛋白质合成来阻断病毒复制。蛋白激酶PKR识别病毒双链RNA或中间体双链RNA后会使翻译起始因子2的α亚单位(eIF2α)磷酸化,导致病毒的蛋白合成阻断,从而抑制病毒复制[17]。干扰素诱导的TRIM22则通过降解HCV非结构蛋白NS5A来抑制病毒的复制,也可以通过降低HBV的基因转录水平来抑制病毒蛋白合成及病毒复制[18-19]。
ISG抑制病毒的释放:在病毒生命周期的后期,病毒核酸被包装成衣壳,衣壳颗粒通过细胞裂解、胞吐或直接从质膜出芽离开细胞。Viperin蛋白通过抑制二磷酸合成酶(FBBS)从而抑制流感病毒和HIV的出芽[20-21]。另外Tetherin蛋白具有2个特殊的跨膜结构,能将HIV-1病毒粒子固定在细胞膜上,从而阻止病毒出芽[22]。
1.3 干扰素与细胞凋亡
IFNs在宿主抗病毒免疫反应中必不可少,其在限制病毒传播方面具有重要的功能。之前研究表明IFNs发挥抗病毒作用主要表现在未感染细胞中建立抗病毒状态,随之发现IFNs在建立细胞抗病毒状态的同时选择性地诱导病毒感染细胞的凋亡。在病毒早期防御机制中,IFNs诱导产生的双链RNA依赖的蛋白激酶(double-stranded RNA-activated protein kinase, PKR)是促使病毒感染细胞凋亡的重要调节因子[23]。研究表明,一方面,PKR能通过磷酸化翻译起始因子eIF2α诱导凋亡;另一方面,还通过NF-κΒ、p53多种信号通路来调控凋亡[24]。所以在病毒早期防御过程中,IFNs通过产生PKR引起感染细胞凋亡,抑制病毒的复制,从而发挥重要的抗病毒作用。
1.4 干扰素与抗原递呈细胞的活化
在宿主免疫应答过程中,抗原递呈细胞(antigen-presenting cells, APCs)能够摄取、加工和处理抗原并将抗原信息递呈给T淋巴细胞。MHC类分子直接参与APCs对内源性和外源性抗原的递呈过程。MHC Ⅰ类分子主要递呈内源性抗原,MHC-I抗原肽复合物被CD8+T细胞识别;MHC Ⅱ类分子递呈外源性抗原,MHC Ⅱ抗原肽复合物被CD4+T细胞识别[25]。IFNs在抗原呈递的过程中也发挥着重要的作用,主要是通过调节MHC类分子的蛋白表达实现。IFNs能够加速MHC类分子编码基因的转录过程,并增强其表达。IFN-Ⅰ能增加抗原递呈细胞尤其是树突细胞(DCs)表达MHC Ⅰ类分子,并抑制MHC Ⅱ类分子表达,促进CD8+T细胞活化。IFN-γ不仅能使MHC Ⅰ类分子表达增强,还能诱导MHC Ⅱ类分子的表达,增强CD4+T和CD8+T细胞反应[26]。总之,IFNs通过上调MHC类分子的表达,促进抗原递呈细胞的活化,增强其抗原递呈作用,活化效应T细胞,使宿主处于最佳的免疫状态。
2 ASFV逃逸抗病毒IFN相关天然免疫反应
目前已知ASFV可能逃逸IFN相关介导的天然免疫途径:一是通过抑制IFN-Ⅰ的应答来逃避IFNs的抗病毒功能;二是在宿主免疫基因合成的过程中,干扰宿主免疫基因的转录和蛋白合成,有利于逃避IFN介导的免疫反应;三是ASFV能抑制感染细胞的凋亡,有利于病毒的复制;四是ASFV能够损害重要APC的功能,影响宿主的免疫应答。
2.1 ASFV感染拮抗IFN-Ⅰ应答及其机制
TLRs作为最早发现的PRRs,为Ⅰ型跨膜糖蛋白受体,由胞外区、跨膜区和胞质区组成,TLRs识别病毒PAMP后被激活,发生二聚化,启动细胞内信号级联反应,诱导细胞分泌IFNs、炎症因子、趋化因子[27]。研究表明,ASFV I329L是高度糖基化的Ⅰ型跨膜蛋白,富含329个氨基酸,包含17个信号肽(1~17 aa),1个N-末端的胞外区(18~239 aa),1个跨膜区(240~260 aa),1个C-末端胞内区(261~329 aa),与Ⅰ型跨膜糖蛋白TLR3结构类似,是TLR3 同源蛋白。能够靶向接头蛋白TRIF抑制TLR3诱导IRF3和NF-κΒ的活化(见图1),从而抑制诱导IFN-β和趋化因子应答,进而逃避宿主抗病毒免疫应答[28-29]。
ASFV多基因家族MGF360和MGF530基因能促进受感染细胞的存活, 允许病毒在巨噬细胞中有效复制,并且与病毒的毒力密切相关[30]。其中,MGF360基因是ASFV感染蜱虫宿主的重要的决定因子,是蜱虫寄主中ASFV复制和扩大感染所必需[31]。已有研究表明,MGF360、MGF530除了抑制IFNs的诱导外,还能使ASFV克服细胞抗病毒状态。作为MGF360的一员,A276R基因可以通过抑制天然免疫RNA受体TLR3和RIG-Ⅰ/MDA5下游的转录因子IRF3,抑制IFN-Ⅰ的产生,但对Ⅰ型和Ⅱ型IFN的JAK-STAT途径和信号通路无影响。与A276R相比,MGF505家族成员A528R,不仅抑制TLR3和RIG-Ⅰ/MDA5下游的转录因子IRF3,而且抑制信号通路下游的NF-κΒ(见图1)。此外,A528R除了抑制IFN-Ⅰ的产生,对Ⅰ型和Ⅱ型IFN的JAK-STAT途径和ISGF3信号也起抑制作用[32]。研究表明ASFV MGF360和MGF530基因缺失株上调IFN-β的表达,病毒毒力下降,对猪进行免疫后,可诱导对亲本病毒攻击的保护性反应[33]。表明IFN逃逸基因缺失是构建合理减毒ASFV候选疫苗株的有效途径。
DP96R(UK)表达于ASFV感染早期,蛋白序列保守,是ASFV毒力基因。DP96R能够通过靶向TBK1抑制DNA受体cGAS-STING介导的IFN-Ⅰ的产生,同时也能抑制TBKI和IKKβ介导的NF-κΒ的活化(图1),最终实现免疫逃避。DP96R免疫逃逸可能通过其C端结构域发挥作用,提示我们可以通过缺失DP96R C端结构域来消除ASFV的免疫逃逸作用[34]。其他ASFV基因如K205R也能有效抑制IFN-β的表达,与免疫逃避有关,但是免疫逃避机制尚不清楚[35]。目前还需要通过大量筛选发现更多的IFNs免疫逃逸基因,并且弄清其免疫逃避机制。
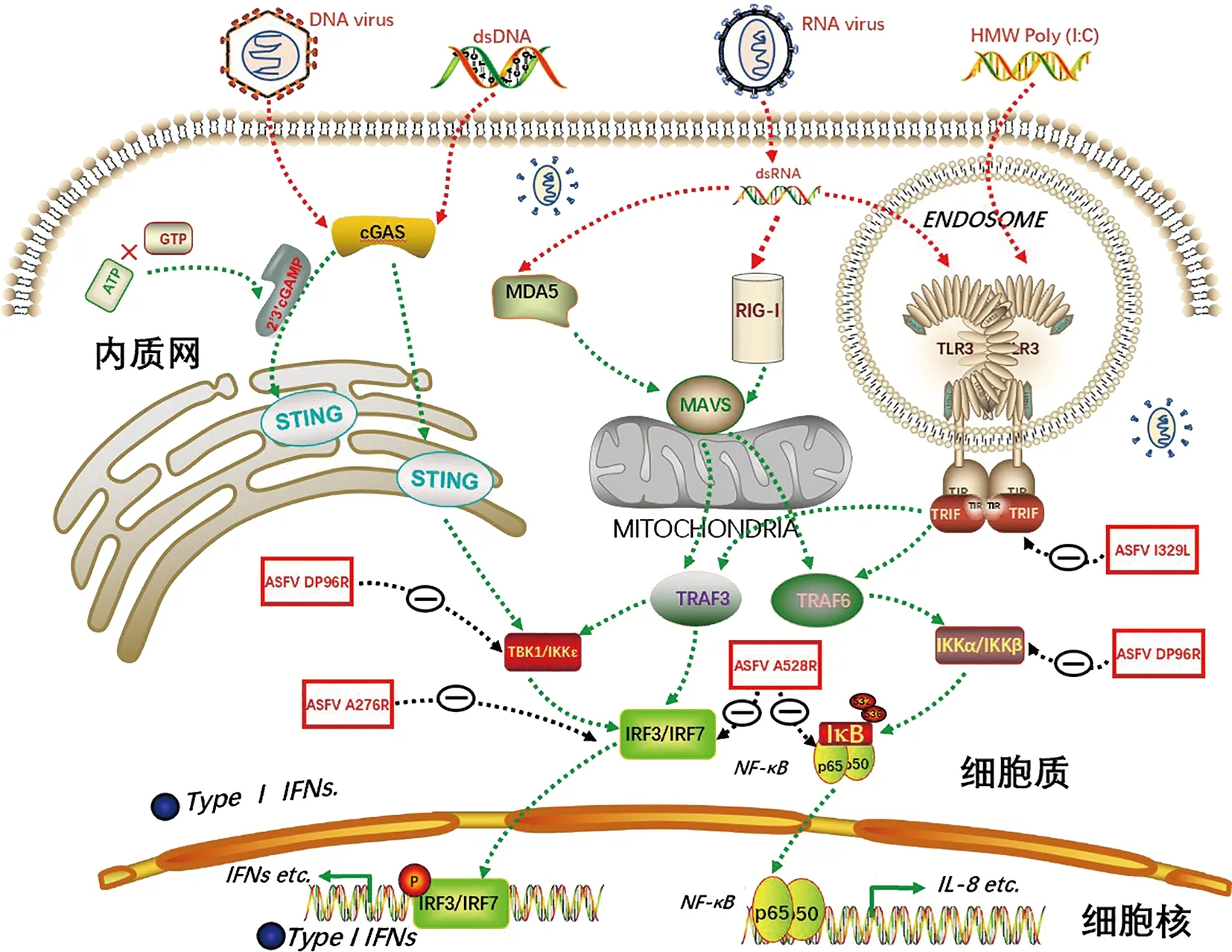
注:红色矩形框中是ASFV蛋白名称,黑色圆圈中负号表示抑制作用
2.2 ASFV干扰宿主免疫基因转录和蛋白合成
ASFVA238L基因编码蛋白是一种能够影响宿主功能的蛋白,能够同时存在感染细胞的胞质和核中,分子量存在差异,可能是由于翻译后不同加工而造成。A238L的锚蛋白重复序列与IκΒ家族成员类似,因此被认为是IκΒ的同源蛋白,并且能够可以像IκΒ一样直接与NF-κΒ结合,抑制NF-κΒ的激活,阻止宿主基因转录并下调炎性因子的产生,干扰依赖NF-κΒ的抗病毒机制。A238L还抑制钙神经磷酸酶的活性,与钙神经磷酸酶结合干扰转录因子NF-AT的激活[36]。此外,A238L通过CBP/p300转录辅激活物的机制来抑制TNF-α转录[37]。因此,A238L可能通过干扰宿主免疫应答基因的转录激活,造成广泛的免疫抑制。DP71L为ICP34.5类似物,它的C末端结构域与单纯疱疹病毒的ICP34.5蛋白相似,能够通过与机体内的蛋白磷酸激酶1(PP1)结合,导致真核生物翻译起始因子2(eIF-2α)去磷酸化从而抑制宿主蛋白的合成,却有利于病毒的合成和释放[38]。
2.3 ASFV抑制感染细胞凋亡
病毒感染细胞时,感染细胞凋亡是宿主控制病毒感染的重要机制。多种因素可促发细胞凋亡,而IFNs是其中之一。ASFV进化出了抑制感染细胞凋亡的策略。 ASFV EP153R主要编码一种非必需蛋白,具有C型凝集素样的结构域,在病毒感染早期和晚期,蛋白都可表达。该蛋白主要参与ASFV感染细胞诱导的血液吸附过程,最近研究发现,EP135R含有细胞黏附区域并与细胞黏附和T细胞活化相关CD44分子显著同源,能抑制ASFV感染时caspase-3的活化,从而抑制其诱导的凋亡[39]。研究建立了EP153R的三维模型表明,EP153R编码的蛋白能够抑制细胞表面MHC I分子的表达,并且还能抑制宿主细胞p53的活性,抑制细胞凋亡[40](图2)。ASFV存在2种蛋白分别是IAP和Bcl2同源物,可以抑制感染细胞的凋亡,从而促进子代病毒粒子的复制。A224L基因编码IAP样蛋白,序列比较保守,表达在病毒感染晚期,该蛋白能够通过与caspase-3蛋白水解酶片段相互作用,抑制水解酶的活性,并能够激活NF-κΒ的活性。A224L还编码了一种类似Bcl2分子具有抗凋亡的功能,从而促进病毒颗粒的形成[41](图2)。而A179L基因编码的Bcl2样蛋白在感染早期和晚期均有表达,它包含Bcl2相关蛋白特征性的BH1、BH2和BH3高度保守结构域与促凋亡Bcl2家族蛋白相互作用抑制其细胞凋亡作用(图2)。除此之外,A179L与Beclin 1在线粒体和内质网处共定位,并通过BH3同源结构域与Beclin 1相互作用来调控自噬[42]。前面提到的DP71L能够并且能够抑制促凋亡CCAAT增强剂结合蛋白同源蛋白(CHOP)的转录激活,起到抑制细胞凋亡的作用(图2)。并且研究还进一步发现,ASFV感染宿主时,未感染淋巴细胞大量凋亡,降低了宿主免疫应答的有效性,有利于病毒复制[43]。

注:红色矩形框中为ASFV蛋白名称,红色圆圈中负号表示抑制作用,正号表示促进作用
2.4 ASFV损害抗原递呈细胞功能
巨噬细胞具有一定的吞噬能力,能吞噬杀死入侵机体的大多数病原体,在免疫调节,抗病毒和抗肿瘤等方面都发挥着重要的作用,除此之外,巨噬细胞还是重要的抗原递呈细胞。ASFV感染巨噬细胞,并在其中大量复制、增殖,会对巨噬细胞产生损害,也是造成免疫逃避的重要原因之一。研究发现,ASFV感染巨噬细胞时,会下调巨噬细胞表面CD14和CD16的表达,损害了吞噬细胞的功能和抗病毒活性;另一方面,在体外ASFV感染巨噬细胞时,相对于强毒株L60,弱毒NH/P68能增强IFN-α、TNF-α和IL-12等细胞因子的表达[44]。这些表明强、弱毒株在感染巨噬细胞中存在差异,有可能强毒株可能进化出逃逸巨噬细胞细胞因子/趋化因子反应的机制。
树突状细胞在免疫反应中发挥重要作用,DCs能够高效地摄取、加工和递呈抗原。主要分为2类,第1类起源于髓系,包括cCD1s、 cCD2s;第2类为淋巴系树突细胞pDCs,为天然免疫IFN-Ⅰ的主要产生细胞。ASFV会感染皮肤来源的DCs,感染后会严重损害DCs的功能,甚至造成树突细胞的死亡,影响宿主的免疫反应。同巨噬细胞相比,ASFV感染DCs后未诱导IFN-β、IL-8和TNF-α等细胞因子的表达,病毒可能通过抑制细胞因子的转录,来逃逸DCs 细胞触发的免疫反应[44]。
NKT细胞、rδT细胞也是抗原递呈细胞,可是目前没有明确的报道阐明这2种细胞在ASFV免疫应答中的作用。有研究表明,rδT细胞能够诱导细胞因子和趋化因子的产生,包括IFN-λ,表明 rδT细胞在ASFV感染时能发挥天然免疫的作用。
3 前景与展望
ASF作为猪的一种烈性传染病,给世界养猪业造成毁灭性的打击。因此,对ASFV的免疫逃逸机制深入研究,对疫情防控工作有重大意义。ASFV编码160多种蛋白,包含54种结构蛋白和100多种非结构蛋白,但大多数蛋白不是病毒复制所必需,但对ASFV在宿主体内的存活和传播起着重要作用。目前已知功能的仅50多种,大多数蛋白的功能是未知。这些蛋白是否参与病毒免疫逃避过程需要进一步研究。
黏膜免疫是防止病毒感染的第一道防线,而非洲猪瘟主要通过消化道和呼吸道进入机体,首先触发的应该是黏膜免疫。黏膜免疫中扮演重要角色的天然免疫抗病毒因子主要是IFN-λ,但是目前有关报道都集中在IFN-Ⅰ,对于IFN-λ在抗ASFV和ASFV逃逸IFN-λ方面却知之甚少。具体来讲,IFN-λ引发的免疫反应能否有效地抑制ASFV复制,以及在长期的进化中,ASFV是否编码出相关蛋白来逃避IFN-λ触发的黏膜免疫,以及如何有效利用IFN-λ来做好非洲猪瘟防控工作应该是今后工作的关注点。
总之,非洲猪瘟疫情形势依旧严峻,随着抗病毒药物和试验性疫苗应用,ASFV发生变异形成新的免疫逃避可能性极高。深入了解ASFV逃避宿主尤其是逃逸IFN免疫的机制,有助于阐明病毒与宿主的相互作用及ASFV的致病机理,为ASF的防控工作提供新的思路和方法。

