Npas4在小鼠原代神经元体外氧糖剥夺/复氧损伤中的保护作用及其可能机制*
石子璇, 饶 维, 姬广辉, 腰向颖△
(解放军总医院第六医学中心1中医内科,2神经外科,北京100048)
脑卒中是神经系统的常见急重症,其流行率、发病率和死亡率均较高,已成为我国居民的首要死因及成人首要致残原因[1-2],而缺血性脑卒中在其中占比高达67.3%~80.5%[3]。尽管目前多种再灌注治疗手段(如溶栓、取栓及闭塞再通等)在临床广泛应用,但目前仍缺乏有效的临床干预靶点及神经保护药物[4-5]。神经元PAS结构域蛋白4(neuronal Per-Arnt-Sim domain protein 4,Npas4)是碱性螺旋-环-螺旋转录因子家族中的一员,几乎仅表达于脑组织,参与调节抑制性突触发育及突触可塑性,在学习和记忆中发挥重要作用;同时,Npas4也是一种神经元兴奋相关的即早基因,与多种神经退行性疾病关系密切[5]。部分研究也揭示Npas4可减轻缺血性脑损伤,具有一定的神经保护作用[6]。然而,神经元氧糖剥夺/复氧(oxygen-glucose deprivation/reoxygenation,OGD/R)损伤后,Npas4的表达规律及其具体作用目前尚不清楚。本项工作拟构建小鼠原代皮层神经元OGD/R模型,观察损伤后Npas4的时间变化规律,并通过基因干预下调Npas4的表达,探讨其在神经元OGD/R损伤中的作用及其可能机制。
材料和方法
1 实验材料与主要试剂
C57BL/6孕鼠,孕14~15 d,22~25 g,SPF级,由空军军医大学实验动物中心提供,实验动物合格证编号为SCXK(陕)-2019-001。神经元培养液(Neuro⁃basal®、B27和GlutaMAX™)及Dulbecco改良Eagle培养 液(Dulbecco's modified Eagle medium,DMEM)(Thermo Fisher Scientific);RNA提取、反转录及实时定量PCR试剂盒(TaKaRa);细胞计数试剂盒8(Cell Counting Kit-8,CCK-8;上海生工生物工程公司);Western blot试剂盒(上海碧云天生物技术有限公司);抗Npas4抗体(NeuroMab);抗Homer1a抗体(Santa Cruz);抗caspase-3和cleaved caspase-3抗体(Cell Signaling Technology);无关序列(scramble)及Npas4短发夹RNA(short hairpin RNA,shRNA)慢病毒颗粒(上海吉凯基因化学技术有限公司)。
2 主要方法
2.1 小鼠原代皮层神经元培养 孕14~15 d C57BL/6小鼠予以颈椎脱臼处死,无菌条件下分离胎鼠皮层,置于含有预冷的DMEM中,剪碎后加入0.15%胰蛋白酶37℃孵箱酶解10 min,于DMEM(含10%胎牛血清)中终止酶解,54×g离心5 min,弃上清,重复终止酶解步骤1次,加入DMEM(含10%胎牛血清),轻柔吹打制备单细胞悬液,70µm细胞滤网过滤,接种于100 mg/L多聚赖氨酸包被的培养皿,置于37℃细胞培养箱培养;培养6 h后,更换为Neurobasal完全培养液,置于37℃细胞培养箱继续培养,后每3 d半量换液,培养至第9天待用。
2.2 OGD/R模型制备 选取生长状态良好的成熟原代神经元,更换培养液为无糖Neurobasal培养液,置于缺氧培养箱(氧浓度监测<1%,N∶2CO2=95%∶5%)中培养3 h后更换为Neurobasal完全培养液,正常培养箱(空气∶CO2=95%∶5%)中培养至实验所需时点后,予以下一步处理。
2.3 乳酸脱氢酶(lactate dehydrogenase,LDH)检测 采用Cytotoxicity Detection Kitplus进行LDH检测,收集培养液上清离心,后取上清液100µL加入96孔板中,加入100µL工作液,震荡后避光孵育30 min,加入50µL终止液,酶标仪(波长490 nm)测定吸光度(A)值,绝对测量值=测量值−空白对照值(正常完全培养液)。神经毒性(%)=(实验组A值−低对照A值)(/高对照A值−低对照A值)×100%。(低对照:未处理组培养液上清液;高对照:未处理组加入酶解溶液后的培养液上清液;实验组:处理组培养液上清液)。
2.4 Npas4-shRNA慢病毒载体的构建及感染Npas4-shRNA(5′-GGTTGACCCTGATAATTTA-3′)及其无关序列(5′-GGTTCAGCGTCATAATTTA-3′)载体构建及慢病毒包裹均委托于上海吉凯基因公司。待神经元培养至第5天,按梯度浓度加入慢病毒颗粒,6~8 h后予以换液,培养至第8天后造模并提取mRNA及蛋白,验证转染效率,选取合适的感染指数,后按此感染指数进行神经元基因干预造模。
2.5 RT-qPCR实验 按照TaKaRa MiniBEST Uni⁃versal RNA Extraction Kit说明书提取RNA,浓度定量后,据说明书进行20µL体系反转录及25µL体系qPCR,待反应结束后,进行mRNA相对表达水平的分析。所使用引物均由TaKaRa合成:Npas4的上游引 物 序 列 为5′-CAGGATGACTCACACTGACAG⁃TATTTTTAG-3′,下游引物序列为5′-GTGGGAGA⁃AGAGCTATTTATATCACCAG-3′;Homer1a的上游引物序列为5′-GGCAAACACTGTTTATGGACTGG-3′,下游引物序列为5′-GTAATTCAGTCAACTTGAG⁃CAACC-3′;GAPDH的上游引物序列为5′-GGGT⁃CAGAAGGATTCCTATG-3′,下 游 引 物 序 列 为5′-GGTCTCAAACATGATCTGGG-3′。
2.6 Western blot检测蛋白表达 使用RIPA裂解液(含1%蛋白酶及磷酸酶抑制剂)提取全细胞蛋白,BCA法测定蛋白浓度后,取20µL总蛋白行10%~12%SDS-PAGE,湿转于醋酸纤维膜,5%脱脂牛奶封闭1.5 h,分别加入I抗孵育过夜[Npas4(1∶500),Homer1a(1∶200),caspase-3和cleaved caspase-3(1∶1 000)及 β-actin(1∶4 000)],PBST润洗3次,加入Ⅱ抗,室温孵育1.5 h,PBST洗膜3次,增强型HRP化学发光液显影压片,采用Gel-pro软件进行各个蛋白的相对表达水平分析。
3 统计学处理
采用GraphPad Prism 6软件进行统计分析及图表制作,数据均以均数±标准误(mean±SEM)表示。多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法。以P<0.05为差异具有统计学意义。
结 果
1 OGD/R损伤后,小鼠原代皮层神经元中Npas4和Homer1a表达水平上调
与对照组相比,OGD/R损伤后原代皮层神经元胞体皱缩、空泡化,并出现部分突起连接断裂,见图1;OGD/R损伤早期,Npas4(OGD 3 h和OGD/R 1 h)及Homer1a(OGD/R 1 h、OGD/R 3 h和OGD/R 6 h)的mRNA水平显著高于对照组(P<0.05),后逐渐恢复至正常水平,见图2。我们进一步检测其蛋白表达水平,Western blot结果显示Npas4和Homer1a的蛋白表达与mRNA变化趋势基本一致(P<0.05),见图3。

Figure 1.Morphological changes of primarily cultured cortical neurons.The scale bar=50µm.Compared with con⁃trol group(left),significant morphological changes were observed in OGD 3 h group(right),including neuronal debris,vacuolation and breakdown of neuro⁃nal networks.图1 原代皮层神经元的形态改变
2 Npas4-shRNA显著降低OGD/R引起的Npas4表达上调
为明确Npas4在OGD/R中的作用,采用Npas4-shRNA下调Npas4的表达水平。OGD/R损伤后1 h,其mRNA及蛋白水平均达高峰,故此时点用于Npas4-shRNA下调效率验证。与无关序列组相比,Npas4-shRNA可显著降低OGD/R所引起的Npas4蛋白表达上调(P<0.05),见图4,以此条件用于后续实验。

Figure 2.The mRNA levels of Npas4 and Homer1a in neurons were up-regulated in the early stage of OGD/R injury.Mean±SEM.n=3.*P<0.05 vs control group.图2 OGD/R损伤早期神经元中Npas4和Homer1a的mRNA水平上调

Figure 3.The protein levels of Npas4 and Homer1a in neurons were up-regulated in the early stage of OGD/R injury.Mean±SEM.n=3.*P<0.05 vs control group.图3 OGD/R损伤早期神经元中Npas4和Homer1a的蛋白表达水平上调
3 下调Npas4加重OGD/R引起的神经元损伤
下调Npas4的表达后予以OGD/R造模,24 h后采用CCK-8检测细胞活力,结果显示,与对照组相比,OGD/R组神经元细胞活力显著降低(P<0.05);与OGD/R组及无关序列组相比,Npas4-shRNA组神经元细胞活力进一步降低(P<0.05),而OGD/R组与无关序列组间差异无统计学意义(P>0.05),见图5A。进一步采用LDH释放实验检测验证神经元损伤情况,与对照组相比,OGD/R组LDH释放显著增加(P<0.05);与OGD/R组及无关序列组相比,Npas4-shR⁃NA组LDH释放进一步升高(P<0.05),OGD/R组与无关序列组间差异无统计学意义(P>0.05),见图5B。
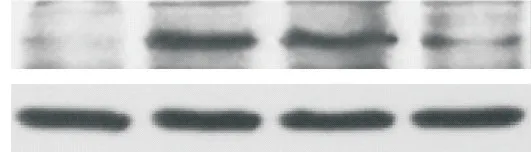
Figure 4.The expression of Npas4 was knocked down by trans⁃fection with Npas4-shRNA.The protein level of Npas4 at 1 h after OGD/R injury were detected by Western blot.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs scramble+OGD/Rgroup.图4 Npas4-shRNA敲减神经元中Npas4的表达
4 下调Npas4加重OGD/R诱导的神经元凋亡
进一步采用Western blot检测凋亡相关蛋白的表达以明确神经元凋亡的改变,结果显示,与OGD/R及无关序列组相比,Npas4 shRNA组中Bax/Bcl-2及cleaved caspase-3的蛋白表达水平均显著升高(P<0.05),见图6。
5 下调Npas4降低OGD/R引起的Homer1a表达上调
与对照组相比,OGD/R组Homer1a蛋白水平显著上调(P<0.05);与OGD/R组及无关序列组相比,Npas4-shRNA组Homer1a蛋白水平显著降低(P<0.05),OGD/R组与无关序列组间蛋白表达差异无统计学意义(P>0.05),见图7。

Figure 5.Down-regulation of Npas4 aggravated neuronal injury after OGD/R.A:the cell viability was detected by CCK-8 assay;B:the LDH release was detected by Cytotoxicity Detection KitPLUS.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs scramble+OGD/R group.图5 下调Npas4加重OGD/R引起的神经元损伤
讨 论
Npas4是新近发现的钙依赖性转录因子,参与调节突触兴奋-抑制的动态平衡,在神经环路的形成及调控突触可塑性中发挥重要作用。本研究通过体外培养的小鼠原代皮层神经元建立OGD/R模型,模拟脑缺血再灌注损伤,揭示Npas4在OGD/R损伤中可能发挥重要的调控作用。
既往研究表明,Npas4可被多种应激条件快速诱导表达,如神经元兴奋、癫痫及缺血等[7-8]。本研究显示,OGD/R损伤可引起Npas4的表达动态升高——损伤早期显著升高,后逐步恢复至生理水平。而神经元兴奋-抑制失衡,即兴奋性毒性,是脑缺血性损伤的关键致伤机制;同时,已有研究表明Npas4可增强抑制性突触传递,是神经元兴奋-抑制平衡重要调节分子[4,9]。据此,我们推测OGD/R损伤后,诱导高表达的Npas4可能通过减轻神经元兴奋-抑制失衡,从而减轻兴奋性毒性而发挥神经保护作用。进一步的Npas4基因干预实验也证实上述推论。慢病毒介导的Npas4表达下调,加重OGD/R所引起的神经元损伤,包括神经元活性降低、LDH释放量增加及细胞凋亡增加。因此,我们推测Npas4可减轻OGD/R诱导的神经元损伤。

Figure 6.Down-regulation of Npas4 aggravated neuronal apopto⁃sis after OGD/R.The protein levels of Bax,Bcl-2,caspase-3 and cleaved caspase-3 at 1 h after OGD/R injury were detected by Western blot.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs scramble+OGD/Rgroup.图6 下调Npas4加重OGD/R引起的神经元凋亡

Figure 7.Down-regulation of Npas4 inhibited the up-regulation of Homer1a induced by OGD/R.The protein expres⁃sion of Homer1a at 1 h after OGD/R injury were de⁃tected by Western blot.Mean±SEM.n=3.*P<0.05 vs control group;#P<0.05 vs scramble+OGD/Rgroup.图7 下调Npas4抑制OGD/R引起的Homer1a表达上调
作为一重要的转录调控因子,Npas4的神经保护作用机制及其下游效应分子仍需进一步探讨。既往研究提示,Homer1a是突触兴奋-抑制平衡的重要直接调控分子,也是神经元兴奋性损伤的重要保护分子,然而其具体表达调控机制仍尚不清楚[10-13]。部分研究提示,Npas4与Homer1a基因启动子存在相互作用[14-15];此外,脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)不仅是Homer1a的表达上调分子,同时也是Npas4重要的靶基因之一[7]。据此,我们推测Npas4可能通过上调Homer1a的表达,从而减轻OGD/R介导的神经元兴奋性损伤。我们的研究结果表明,OGD/R损伤后,Npas4的mRNA与蛋白表达高峰均早于Homer1a,提示Npas4可能诱导Homer1a表达;同时,下调Npas4的表达后,Homer1a的表达水平也显著降低。总结上述结果,OGD/R损伤后,Npas4的表达上调,并可能通过上调Homer1a的表达,从而调控神经元兴奋-抑制平衡发挥神经保护作用。
综上所述,OGD/R损伤后,Npas4表达呈动态上调,且可能通过上调Homer1a发挥一定的神经保护作用。然而,本研究仅通过基因下调反向证明Npas4的神经保护作用,Npas4过表达及其在体脑缺血再灌注实验仍需进一步完成,以阐明Npas4在脑缺血再灌注损伤中的确切作用及机制,为脑缺血治疗提供一定的参考资料。

