脂联素调控miR-221/Timp3信号对糖尿病肾病小鼠肾脏的保护作用*
冯 敏, 吕 琦, 林 婷, 陈霞霞, 杨小玲, 林开平, 温俊平
(1福建省老年医院内分泌科,福建福州350009;2福建省立医院内分泌科,福建福州350001)
糖尿病肾病(diabetic nephropathies,DN)约占糖尿病患者的40%,是糖尿病最常见的慢性微血管并发症之一,是导致慢性肾脏病的主要原因[1]。研究发现,血清脂联素(adiponectin,ADPN)水平与糖尿病微血管并发症的发生有密切联系,ADPN可通过多种途径保护高糖环境下的肾系膜细胞[2-3],对延缓DN的进程具有重要意义。微小RNA-221(microRNA-221,miR-221)是与肾脏生理功能密切相关的调节性miRNA,参与了ADPN抑制肾系膜细胞增殖的过程[4]。生物信息学研究发现金属蛋白酶组织抑制物3(tissue inhibitor of metalloproteinase 3,Timp3)是miR-221负调控的重要靶基因。Timp3在肾脏中高表达,是调控组织微环境和肾脏纤维化的重要因子,研究证实小鼠肾脏损伤和肾脏纤维化的发生与Timp3的表达缺失密切相关[5]。我们的前期研究发现,在体外高糖环境下,ADPN可通过下调miR-221靶向负调控Timp3表达来实现对小鼠肾系膜细胞的增殖抑制作用[6]。因此,本研究拟通过构建DN小鼠模型,探讨ADPN在体内调控miR-221/Timp3信号对小鼠肾脏生理功能和病理状态的影响,以期进一步揭示ADPN在DN中的保护机制。
材料和方法
1 动物
健康清洁级雄性C57BL/6小鼠36只,8周龄,体重约20~25 g,由福建医科大学实验动物中心提供,生产许可证号为SCXK(沪)2012-0002。
2 主要试剂
链脲佐菌素(streptozotocin,STZ)购自Sigma;血糖试纸购自强生公司;pcDNA 3.1质粒、Lipo⁃fectamine 2000脂质体和Trizol试剂均购自Invitro⁃gen;血清ADPN检测试剂盒购自武汉云克隆科技公司;血清肌酐(serum creatinine,SCr)测定试剂盒购自Thermo Fisher;尿蛋白测定试剂盒购自R&D;Mir-X™miRNA First-Strand Synthesis Kit、Prime Script RT Master Mix和SYBR Advantage qPCR Premix均购自TaKaRa;miR-221抑制剂和miR-221抑制剂对照试剂均购自广州锐博生物科技公司;抗Timp3和GAPDH鼠单克隆抗体购自Abcam;辣根过氧化物酶标记的抗鼠II抗购自中杉金桥公司;引物由Invitrogen合成。
3 主要方法
3.1 DN小鼠模型的建立 36只清洁级C57BL/6小鼠,经标准饲料喂养、自由进食水、每日普通光照12 h的适应性饲养1周后,随机抽取6只为正常对照组(control组),其余30只被用于建立DN小鼠模型:高脂高糖饲料喂养8周后,用0.1 mmol/L柠檬酸缓冲液(pH 4.2)溶解STZ,按35 mg/kg的剂量腹腔注射,每天1次,连续5 d。以随机血糖≥16.7 mmol/L达3 d以上为糖尿病小鼠造模成功[7]。糖尿病小鼠模型在STZ注射4周以后,继续高脂高糖喂养,每周留取一次24 h尿液标本,应用试剂盒测定24 h尿总蛋白(urine total protein,UTP)水平,当24 h UTP≥30 mg提示DN小鼠模型建立成功。
3.2 脂质体/pCMV-ADPN转染复合物的制备 根据Lipofectamine 2000说明书,重组质粒pCMV-ADPN或pcDNA 3.1与脂质体按1µg∶0.5µL的比例配制成转染复合物,用量根据小鼠体重按1µg/g的剂量进行腹腔注射,每周注射1次,连续8周,进行重组质粒pCMV-ADPN的转染[8]。
3.3 实验动物的分组与干预 造模成功后的DN小鼠根据干预因素的不同被随机分为5组:(1)DN组:造模成功后不给予任何处理;(2)pCMV-ADPN转染组(DA组):造模成功后将配制好的脂质体/pCMVADPN转染复合物腹腔注射入小鼠体内,每周1次,连续8周;(3)空载体组(DP组):造模成功后将配制好的脂质体/pcDNA 3.1转染复合物腹腔注射入小鼠体内,每周1次,连续8周;(4)miR-221抑制剂组(DM组):造模成功后,根据小鼠体重按1µg/g的剂量,尾静脉注射内源性miR-221抑制剂,每周1次,连续8周;(5)miR-221抑制剂对照组(DC组):造模成功后尾静脉注射miR-221抑制剂对照试剂,每周1次,连续8周。
3.4 血、尿标本和肾脏重量的检测 各组连续干预8周后,称取小鼠体重(body weight,BW);每周一次将小鼠置于金属代谢笼中,用代谢笼收集小鼠24 h尿液标本并检测UTP水平;腹腔注射10%水合氯醛(3 mL/kg)麻醉小鼠后心尖采血并分离血清,检测SCr和血清ADPN水平;采血后剖腹,经腹主动脉灌注生理盐水后称取肾脏重量(kidney weight,KW),由KW(mg)与BW(g)比值得出肾脏肥大指数(KW/BW)。
3.5 肾脏组织的病理学检查 用10%水合氯醛按3 mL/kg的剂量腹腔注射,麻醉后取出双肾,将部分肾组织经10%福尔马林固定、乙醇脱水、二甲苯透明、石蜡包埋、4µm厚切片后,常规HE染色,在显微镜下观察肾脏组织的病理学改变。
3.6 RT-qPCR检测肾组织miR-221和Timp3 mRNA的表达 Trizol试剂一步法提取肾组织总RNA。采用逆转录试剂盒进行miR-221和Timp3的cDNA合成。应用SYBR Advantage qPCR Premix试剂盒进行PCR扩增(25µL的反应体系)。miR-221的上游引物序列为5'-AGCUACAUUGUCUGCUGGGUUUC-3',下游引物为Mir-X™miRNA First-Strand Synthesis Kit提供的通用引物mRQ 3'Primer;其内参照U6的上游引物序列为5'-CTCGCTTCGGCAGCACA-3',下游引物序列为5'-AACGCTTCACGAATTTGCGT-3’。Timp3的上游引物序列为5'-CGTGCAGTACATTCACACG⁃GAAG-3',下游引物序列为5'-ACCCAGGTGGTAGC⁃GGTAATTG-3';其内参照GAPDH的上游引物序列为5'-CAAGGTCATCCATGACAACTTTG-3',下游引物序列为5'-GTCCACCACCCTGTTGCTGTAG-3'。反应条件为:95℃30 s;95℃5 s,58℃1 min,40个循环。采用2−ΔΔCt法计算目的基因的相对表达量。
3.7 Western blot检测肾组织Timp3的蛋白表达将小鼠肾组织研磨后加入裂解液,提取总蛋白,用BCA法测定蛋白浓度。取30µg总蛋白,进行10%SDS-PAGE,接着以300 mA电转膜1.5 h,将蛋白转移到醋酸纤维膜上。在室温下应用5%的脱脂奶粉封闭醋酸纤维膜条2 h,分别与抗Timp3鼠单克隆抗体和抗GAPDH鼠单克隆抗体4℃孵育过夜,洗膜后分别与辣根过氧化物酶标记的抗鼠Ⅱ抗孵育1 h,加入ECL发光剂后在暗室曝光显影,应用图像分析扫描软件对条带进行灰度分析并计算蛋白相对表达量。
4 统计学处理
采用SPSS20.0统计软件进行资料分析。计量资料以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 ADPN过表达对小鼠血清ADPN及肾功能的影响
DN小鼠成模后,与control组比较,DN组小鼠血清ADPN水平显著降低(P<0.05),而24 h UTP水平显著升高(P<0.05);pCMV-ADPN连续干预8周后,与DP组比较,DA组小鼠血清ADPN水平显著升高(P<0.05),而24 h UTP显著降低(P<0.05);DA组小鼠SCr水平虽有所降低,但与DP组比较差异无统计学显著性(P>0.05),见表1。
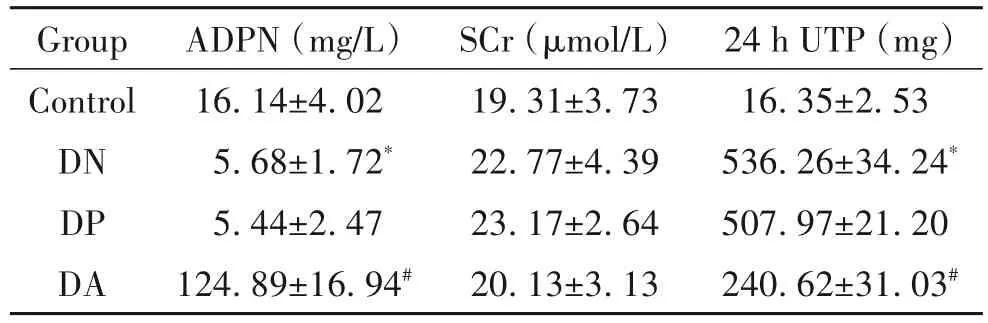
表1 ADPN过表达后小鼠血清ADPN水平及肾功能的变化Table 1.The changes of serum ADPN level and renal function after over-expression of ADPN gene(Mean±SD.n=6)
2 ADPN过表达对小鼠体重、肾脏重量及肾脏肥大指数的影响
DN小鼠成模后,与control组比较,DN组小鼠体重显著下降(P<0.05),肾脏重量显著增加(P<0.05),KW/BW显著升高(P<0.05);pCMV-ADPN连续干预8周后,与DP组比较,DA组小鼠体重显著增加(P<0.05),肾脏重量显著减轻(P<0.05),KW/BW显著降低(P<0.05),见图1。
3 ADPN过表达对小鼠肾脏miR-221和Timp3表达的影响
DN小鼠成模后,与control组比较,DN组小鼠肾脏miR-221相对表达量显著升高(P<0.05),而Timp3的mRNA和蛋白表达水平均显著降低(P<0.05);转染pCMV-ADPN后,与DP组比较,DA组miR-221表达被抑制(P<0.05),Timp3的mRNA和蛋白表达均显著上调(P<0.05),见图2。
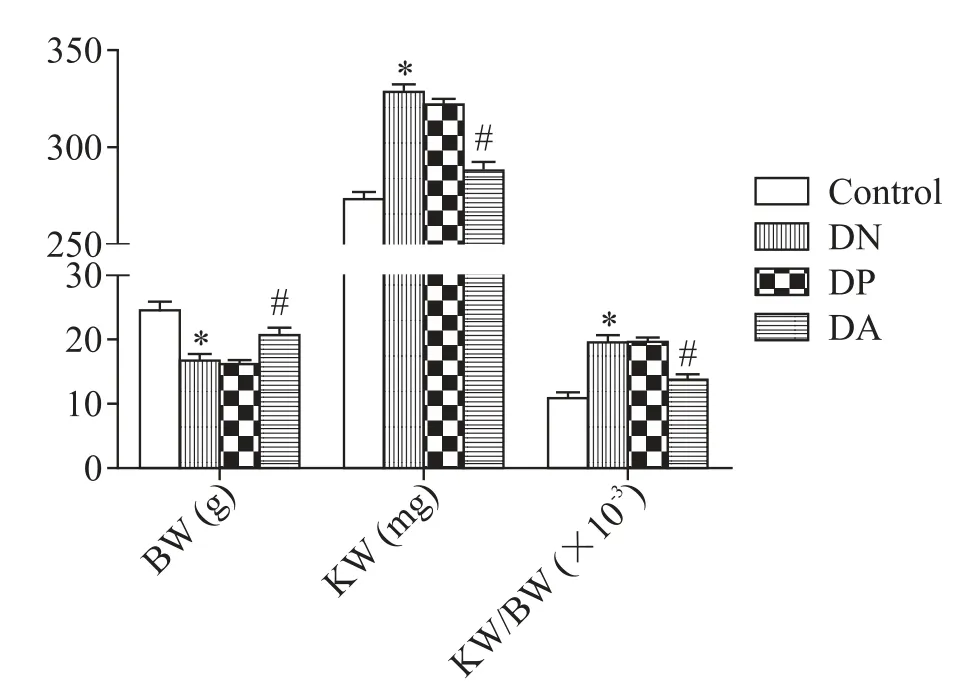
Figure 1.The changes of body weight(BW),kidney weight(KW)and renal hypertrophy index(KW/BW)after over-expression of ADPN gene.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs DPgroup.图1 ADPN过表达后小鼠体重、肾脏重量及肾脏肥大指数的变化
4 抑制miR-221对小鼠肾脏miR-221和Timp3表达水平的影响
miR-221抑制剂尾静脉注射后,与DC组比较,DM组小鼠肾脏miR-221表达被抑制(P<0.05),而Timp3的mRNA和蛋白表达水平均显著升高(P<0.05),见图3。
5 抑制miR-221对小鼠肾功能的影响
miR-221抑制剂尾静脉注射后,DM组小鼠SCr水平有所下降,但与DC组相比差异无统计学显著性(P>0.05),而24 h UTP水平降低,与DC组相比差异有统计学意义(P<0.05),见表2。

表2 miR-221阻断后小鼠肾功能的变化Table 2.The changes of renal function after treatment with miR-221 inhibitor(Mean±SD.n=6)
6 抑制miR-221对小鼠体重、肾脏重量及肾脏肥大指数的影响
与control组比较,DC组小鼠体重显著下降(P<0.05),肾脏重量显著增加(P<0.05),KW/BW显著升高(P<0.05);miR-221抑制剂尾静脉注射8周后,与DC组比较,DM组小鼠体重显著增加(P<0.05),肾脏重量显著减轻(P<0.05),KW/BW显著降低(P<0.05),见图4。
7 ADPN过表达和抑制miR-221对小鼠肾脏组织病理形态的影响
光镜下HE染色显示,control组小鼠肾脏肾小球和肾小管结构正常,毛细血管清晰可见;造模成功后,DN组小鼠出现明显的肾组织损伤,可见肾小球体积增大,系膜细胞增生,肾小管水肿明显,部分肾小管上皮细胞见颗粒状或空泡样变性、萎缩、坏死;而分别给予pCMV-ADPN转染和miR-221抑制剂干预后的DA组和DM组,肾组织病理损伤明显减轻,表现为肾小管和肾小球损害明显减轻,系膜细胞增生减少,见图5。
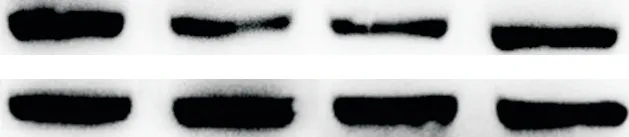
Figure 2.The changes of renal expression of miR-221(A)and Timp3(B and C)after over-expression of ADPN gene.Mean±SD.n=6.*P<0.05 vs control group;#P<0.05 vs DPgroup.图2 ADPN过表达后小鼠肾脏miR-221和Timp3表达水平的变化
讨 论
DN是由于糖尿病患者肾脏中发生特定的病理改变和功能变化所导致的以尿蛋白增多、肾小球高滤过,逐渐发展为肾小球滤过率下降、SCr升高,最终出现肾衰竭为主要临床表现的综合征,其发生机制复杂,临床治疗手段有限。

Figure 3.The changes of renal expression of miR-221(A)and Timp3(Band C)after treatment with miR-221 inhibi⁃tor.Mean±SD.n=6.△P<0.05 vs DCgroup.图3 抑制miR-221后小鼠肾脏miR-221和Timp3的表达变化
Figure 4.The changes of body weight(BW),kidney weight(KW)and renal hypertrophy index(KW/BW)after treatment with miR-221 inhibitor.Mean±SD.n=6.*P<0.05 vs control group;△P<0.05 vs DCgroup.图4 抑制miR-221后小鼠体重、肾脏重量及肾脏肥大指数的变化

Figure 5.The pathological changes of renal tissues after over-ex⁃pression of ADPN gene or treatment with miR-221 in⁃hibitor(HEstaining,×400).图5 ADPN过表达和抑制miR-221后小鼠肾脏组织的病理学变化
ADPN是由脂肪细胞分泌的一种生物活性多肽,具有抗炎和抗氧化应激等作用,其活性水平与高血糖所致肾脏细胞内炎症、氧化应激损伤有关,可通过调控转化生长因子的表达及AMPK信号通路减轻肾脏细胞内的氧化应激损伤[9-10]。在ADPN基因敲除的小鼠中,尿白蛋白增加、肾小球肥大和肾小管间质纤维化均更显著[3]。在肾小管-间质纤维化小鼠模型的研究中发现,罗格列酮可通过提高ADPN水平而抑制炎症因子释放,并下调转化生长因子β1(trans⁃forming growth factor-β1,TGF-β1)的表达,从而减缓DN进程和肾小管间质纤维化[11]。这些对动物模型的实验研究表明,ADPN对延缓DN的发生发展具有重要作用,对DN的临床治疗具有潜在的应用价值。
miRNA是一类内源性非蛋白质编码RNA分子,通过与靶基因mRNA的3'非翻译区互补结合,降解靶基因mRNA或抑制其翻译,从而抑制靶蛋白的表达,对细胞增殖、凋亡、分化、代谢等发挥调控作用。研究发现,在高糖诱导的足细胞损伤中许多miRNA的表达水平可以发生改变,同时DN患者足细胞损伤与血液、尿液和肾脏中的miRNA表达水平之间具有显著相关性[12]。已有研究表明,多个miRNA在DN的发生过程中起重要作用。在体外高糖环境的刺激下,肾系膜细胞增生伴有miR-34a表达增高,生长停滞特异性蛋白1(growth arrest-specific protein 1,GAS1)是miR-34a的靶基因,抑制miR-34a/GAS1信号可抑制肾系膜细胞的增生和肾小球的肥大[13]。另有研究显示,抑制miR-135a表达也能够降低DN中肾系膜细胞的增殖和细胞外基质的聚集,进而阻止肾脏纤维化[14]。在经TGF-β处理的肾系膜细胞中,miR-216a、miR-217和miR-200均表达上调,并能够激活PI3K/Akt信号通路,引起肾系膜细胞增生、肥大及细胞外基质的生成[15]。随着miRNA的发现以及miRNA失调在DN发病机制中的重要作用,越来越多的证据显示miRNA可能是DN潜在的生物学标志物及药物治疗新靶点[16-17]。基于此,我们在前期的体外实验中,筛选出能够参与改善胰岛素抵抗作用并受ADPN信号调控的miR-221作为研究对象,经过生物信息学技术和萤光素酶报告基因实验验证Timp3是miR-221的靶基因,并经体外研究证实在高糖培养环境下小鼠肾系膜细胞的增殖与miR-221的表达水平呈正相关,且这种增殖效应能够被ADPN抑制,在减缓细胞增殖的同时,ADPN可显著抑制miR-221并上调Timp3基因的表达[6]。同期有研究发现,在DN足细胞损伤的过程中,miR-221通过直接靶向DKK2(Dickkopf-related protein 2)基因的表达,调控Wnt/βcatenin信号并介导近端小管细胞的损伤[18]。
Timp3是TIMPs家族在肾脏中表达水平最高的一种细胞因子。Timp3基因表达缺失的小鼠模型表现出对肾脏纤维化的敏感性增高;Timp3的表达上调可抑制高糖刺激下肾小管导管上皮细胞的纤维化进程[19]。Timp3表达缺失能够加重DN小鼠的肾脏损害,主要表现为间质性肾炎、间质纤维化、肾脏重量增加、肾小球系膜基质增厚、尿蛋白排泄增加等[20-21]。为验证在体内环境下ADPN是否通过调控miR-221/Timp3信号对DN小鼠肾脏产生保护作用,本研究通过构建DN小鼠模型并转染ADPN过表达质粒,观察体内高ADPN水平对小鼠肾脏生理功能的影响。结果发现,经转染pCMV-ADPN的DN小鼠,24 h UTP显著低于转染对照组,同时转染后的DN小鼠体重增加,肾脏重量减轻,KW/BW降低,表明在ADPN的作用下,DN小鼠的肾脏生理功能得到明显改善。进一步给予DN小鼠转染miR-221抑制剂后,在24 h UTP水平、小鼠体重、肾脏重量及KW/BW等方面获得了与ADPN作用一致的结果。以上实验结果提示,ADPN对DN小鼠肾脏生理功能的改善作用与miR-221的介导密切相关。
此外,本研究应用RT-qPCR检测小鼠肾组织发现,转染pCMV-ADPN后,miR-221在DN小鼠肾组织中表达下调,而Timp3表达增强。Western blot实验结果显示在DN小鼠肾组织中Timp3蛋白表达水平与mi-221水平呈负相关,结合前期的萤光素酶报告基因实验[6],表明Timp3表达是受mi-221靶向负调控。给予miR-221抑制剂后,Timp3的表达改变与ADPN作用一致。由此可以证实ADPN对DN小鼠的肾脏保护作用是通过调控miR-221/Timp3信号来实现的。
基于肾系膜细胞增殖肥大、基底膜增厚及肾小球硬化是DN的基本病理特征[22]。在本研究中,DN小鼠造模成功后,DN小鼠出现明显的肾组织损伤,表现为肾小球体积增大,系膜细胞增生,肾小管水肿,肾小管上皮细胞空泡样变性、萎缩、坏死。在分别给予pCMV-ADPN转染及miR-221抑制剂后,DN小鼠肾组织病理损伤明显减轻,表现为肾小管和肾小球损伤明显减轻,系膜细胞增生减少,提示ADPN可以改善DN小鼠肾脏的病理状态,是ADPN在体内发挥肾脏保护作用的有力证据。
综上所述,本研究从实验动物水平上证实ADPN可以改善DN小鼠的肾脏生理功能和病理状态,miR-221/Timp3信号调控是ADPN发挥作用的重要途径。ADPN调控该信号有望成为DN的治疗新靶点,为DN的防治提供新的思路。

