β-羟丁酸调控叉头框蛋白O1促糖尿病大鼠肝糖原储存的机制*
张伯宁, 李佳临, 刘子敬, 刘 昆, 郑 丽,3, 栗彦宁△, 齐锦生
(1河北医科大学实验动物学部,河北石家庄050017;2河北医科大学中西结合学院,河北石家庄050017;3邢台医学高等专科学校,河北邢台054000)
糖尿病是一种血糖水平慢性增高的代谢综合征,可导致肝脏功能障碍,进而加剧糖尿病代谢紊乱。肝脏作为营养物质的代谢中心,而肝糖原作为血糖的直接来源,在维持血糖稳态中发挥至关重要的作用[1-2]。肝糖原的合成与分解,处于严密而动态的调控中,而糖尿病时,肝糖代谢紊乱,致肝糖原储存减少,促使血糖升高[3]。叉头框蛋白O1(forkhead box protein O1,FoxO1)是参与代谢调控的、高度保守的转录因子,可在胞质和胞核之间穿梭,从而发挥不同的作用[4]。糖尿病时,胰岛素抵抗等因素致FoxO1功能紊乱,定位于核内,加剧高血糖等代谢紊乱[4]。
酮体由β-羟丁酸(70%)、乙酰乙酸(30%)和丙酮(微量)组成,且前两者之间可以相互转变。目前研究显示,酮体的主要组分,β-羟丁酸除提供能量外,还可作为生物活性小分子,发挥重要的保护作用[5]。虽然糖尿病酮症时,过高浓度的酮体会造成昏迷等损伤作用,但10 mmol/L以下的生理浓度则发挥重要的抗氧化、抗炎等保护作用[6]。研究表明,β-羟丁酸可缓解糖尿病患者胰岛素抵抗状态[7]。同时,β-羟丁酸可促进老年大鼠FoxO1与PGC-1α的结合,起到缓解炎症损伤的作用[8]。那么,β-羟丁酸是否能够促使糖尿病大鼠肝FoxO1转位出核,增加肝糖原的储存呢?本项工作拟用糖尿病大鼠模型,研究β-羟丁酸调控FoxO1并影响肝糖原储存的可能机制。
材料和方法
1 动物
清洁级雄性Sprague-Dawley(SD)大鼠48只,8周龄,体重(249.95±24.11)g,由河北医科大学实验动物中心提供(合格证号为No.1604165)。
2 主要试剂
链脲佐菌素(streptozotocin,STZ)购自Sigma,溶于pH 4.4枸橼酸盐缓冲液,现配现用;β-羟丁酸钠购自Sigma,溶于生理盐水;PAS染色液购自武汉塞维尔生物科技有限公司;细胞核蛋白抽提试剂盒及BCA蛋白浓度测定试剂盒购自江苏碧云天生物技术公司;FoxO1和β-actin抗体均购自博奥森生物科技公司;辣根过氧化物酶标记的Ⅱ抗购自北京中山生物科技公司;四甲基罗丹明异硫氰酸酯(tetramethyl⁃rhodamine isothiocyanate,TRITC)标记的Ⅱ抗和4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylin⁃dole,DAPI)购自上海碧云天生物技术有限公司,其余试剂均为国产分析纯。
3 主要方法
3.1 糖尿病肝损伤模型的建立 大鼠随机分为正常(control,Con)组(n=8)、糖尿病(diabetes mellitus,DM)组(n=10)、β-羟丁酸1(β-hydroxybutyrate 1,B1)组(n=10)、β-羟丁酸2(B2)组(n=10)和β-羟丁酸3(B3)组(n=10)。DM组和β-羟丁酸干预各组大鼠腹腔注射STZ(40 mg·kg−1·d−1)。大鼠STZ注射3 d后,用罗氏血糖仪检测空腹血糖水平,高于11.1 mmol/L即为糖尿病模型建立。B1组、B2组和B3组大鼠分别皮下注射β-羟丁酸钠160、200和240 mg·kg−1·d−1,其它组大鼠注射等体积生理盐水。糖尿病大鼠肝损伤模型制作及β-羟丁酸干预参考前期研究基础[9-10]。β-羟丁酸钠干预12周后,检测大鼠的体重和血糖、肝脏组织病理学变化、肝糖原的含量、总的和胞核FoxO1蛋白含量及FoxO1的分布。
3.2 大鼠肝脏的组织病理学观察 取肝脏组织,4%的多聚甲醛溶液固定6 h,用不同浓度的乙醇和二甲苯逐级脱水,石蜡包埋,作3~5µm冠状切片,HE染色,于显微镜下观察肝脏组织形态学变化。
3.3 大鼠肝脏的糖原染色 石蜡切片脱蜡至水,切片入PAS染色液B中染色10~15 min,自来水洗,蒸馏水洗两遍;切片入PAS染色液A浸染25~30 min,避光,流水冲洗5 min;切片入PAS染色液C染30 s,自来水洗,盐酸水溶液分化,自来水洗,氨水返蓝,流水冲洗。脱水封片后,于显微镜下观察肝脏糖原的染色情况。
3.4 Western blot检测FoxO1蛋白含量 肝脏组织液氮冷冻后匀浆,用RIPA裂解液提取总蛋白,同时试剂盒抽提细胞核蛋白,用BCA蛋白浓度检测试剂盒检测蛋白浓度。取100µg蛋白进行SDS-PAGE,转移至PVDF膜上,5%BSA封闭后,加入Ⅰ抗[anti-FoxO1(1∶200)或anti-β-actin(1∶2 000)],4℃摇床过夜,加入辣根过氧化物酶标记的Ⅱ抗(1∶2 000)。显色后,测量条带的灰度值:计算总FoxO1与actin含量的比值,以反映总FoxO1的相对蛋白含量;计算胞核与总FoxO1蛋白含量的比值,以反映胞核FoxO1的相对蛋白含量。
3.5 免疫荧光染色显示大鼠肝脏FoxO1分布 取肝脏组织冰冻切片后,4%多聚甲醛固定15 min,1%的TritonX-100室温下处理30 min,10%山羊血清37℃封闭1 h。弃除封闭液,加入FoxO1抗体(1∶50),4℃孵育过夜。加入TRITC标记Ⅱ抗(1∶50),避光37℃孵育1 h。加入细胞核染色液DAPI,避光室温作用15 min。滴加适量的抗荧光衰减封片液(50%甘油),盖玻片封片后,荧光倒置显微镜下观察、拍照。FoxO1的染色为红色,细胞核的染色为蓝色。
4 统计学处理
采用SPSS21.0进行统计学分析。数据用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 β-羟丁酸对糖尿病大鼠体重和血糖的影响
各组间大鼠初始体重无显著性差异;12周后,与Con组相比,DM组及β-羟丁酸干预各组大鼠体重均显著降低(P<0.01),而DM组和β-羟丁酸干预各组之间大鼠体重无显著差异。与Con组相比,DM组和β-羟丁酸干预各组初始血糖均显著升高(P<0.01),提示糖尿病大鼠模型成功建立;12周后,与Con组相比,DM组及β-羟丁酸干预各组大鼠血糖仍显著增高(P<0.01),而β-羟丁酸干预各组血糖比糖尿病组稍有降低,但差异无统计学意义。见表1。
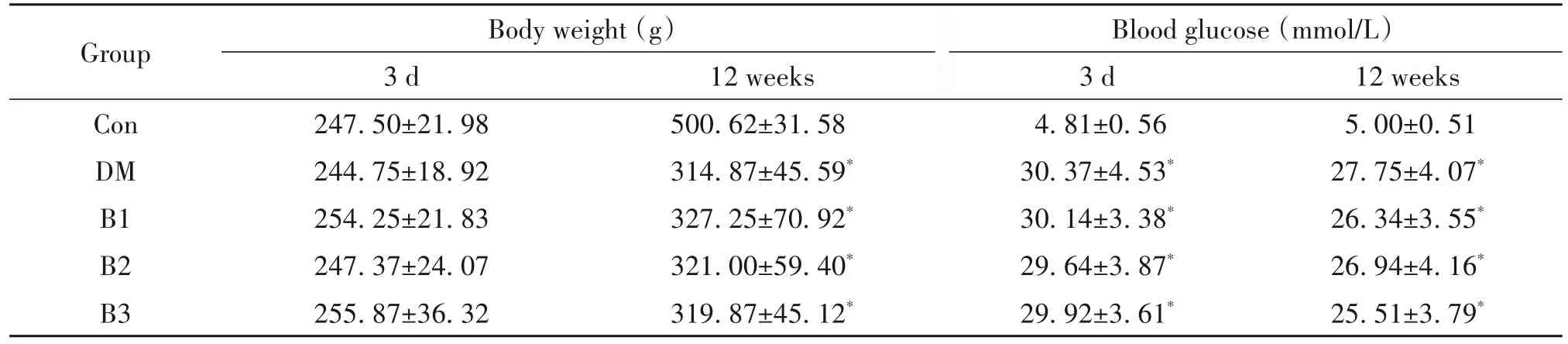
表1 大鼠体重和血糖的变化Table 1.Changes in body weight and blood glucose of rats(Mean±SD.n=8)
2 β-羟丁酸对糖尿病大鼠肝脏形态学及糖原含量的影响
HE染色观察可见,Con组肝小叶结构完好,肝细胞索排列整齐,未见病理损伤;而DM组肝细胞排列紊乱,细胞内有大量脂肪空泡和脂滴;B1组肝小叶结构损伤与糖尿病组相似,而B2组和B3组肝小叶结构相对完好,细胞内有少量脂肪空泡及脂滴,见图1。同时,大鼠肝脏组织的糖原染色显示,Con组肝糖原深染成紫色;而DM组糖原染色极浅;β-羟丁酸干预各组糖原染色强度依次增加,以B2组和B3组染色加深更为明显,见图2。
3 β-羟丁酸减少糖尿病大鼠肝细胞核内FoxO1蛋白含量
12周后,与Con组相比,DM组总的及胞核FoxO1相对蛋白含量显著增多(P<0.05);而与DM组相比,β-羟丁酸干预各组总的FoxO1相对蛋白含量差异无统计学意义,但胞核FoxO1相对蛋白含量在B2组和B3组显著降低(P<0.05),见图3。
4 β-羟丁酸抑制糖尿病大鼠肝FoxO1核转位
免疫荧光染色结果显示,Con组FoxO1荧光(红色)几乎均分布于胞浆,与胞核的染色(蓝色)无重叠;而DM组可见FoxO1荧光增强,并明显积聚在核内,与胞核的染色叠加呈明显的粉紫色;β-羟丁酸干预各组胞核内FoxO1荧光减弱,以B2组和B3组最为明显,见图4。
讨 论
糖尿病是以一种高血糖为主的代谢紊乱综合征。糖尿病时,代谢紊乱可引起肝细胞的损伤,导致肝脏功能障碍[3,11]。而肝脏作为糖、脂等代谢的中心,其功能障碍又会加剧糖尿病代谢紊乱[3]。肝糖原作为糖的直接来源,其合成和分解受到严格的调控,以参与维持血糖稳态。糖尿病时,肝糖原合成与分解的不平衡是促使血糖升高的因素[3]。
我们前期的研究证实,STZ制作糖尿病大鼠模型10周以上,可造成明显的肝脏损伤[9]。本实验显示,糖尿病大鼠12周时,血糖显著升高,体重显著降低,提示糖尿病大鼠模型的稳定建立。肝脏组织形态学检查显示,糖尿病大鼠肝细胞索排列紊乱,肝细胞内含有大量脂滴和脂肪空泡,提示糖尿病肝脏损伤。进而,肝脏组织糖原染色显示,糖尿病大鼠肝糖原含量极度减少,提示其肝糖原代谢紊乱,致肝糖原储存耗竭。
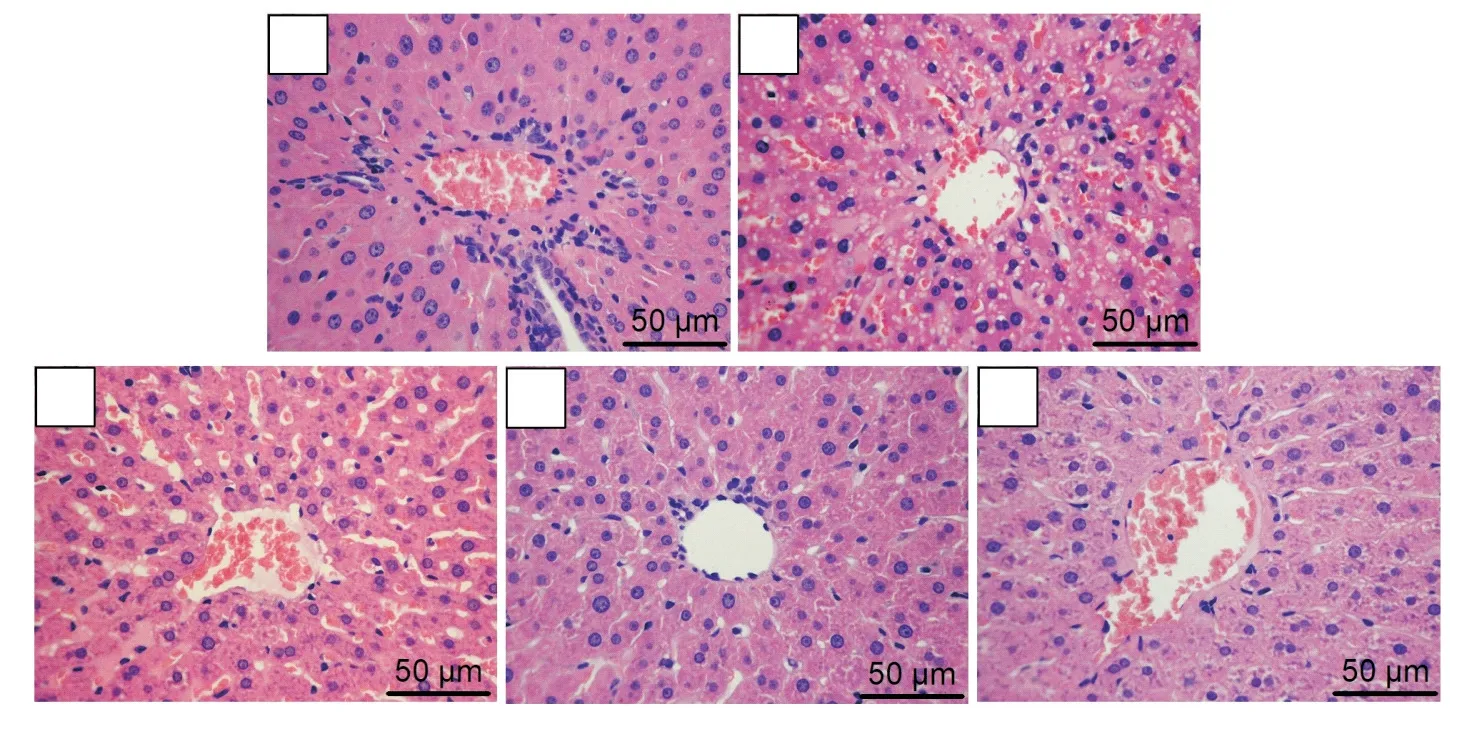
Figure 1.HE staining of rat liver(scale bar=50µm).A:Con group;B:DM group;C:B1 group;D:B2 group;E:B3 group.In⁃tact liver structure was seen in Con group,but liver structure was disordered with lipid droplets in DM group.The injured liver structure was attenuated obviously in B2 and B3 groups.图1 大鼠肝脏的HE染色
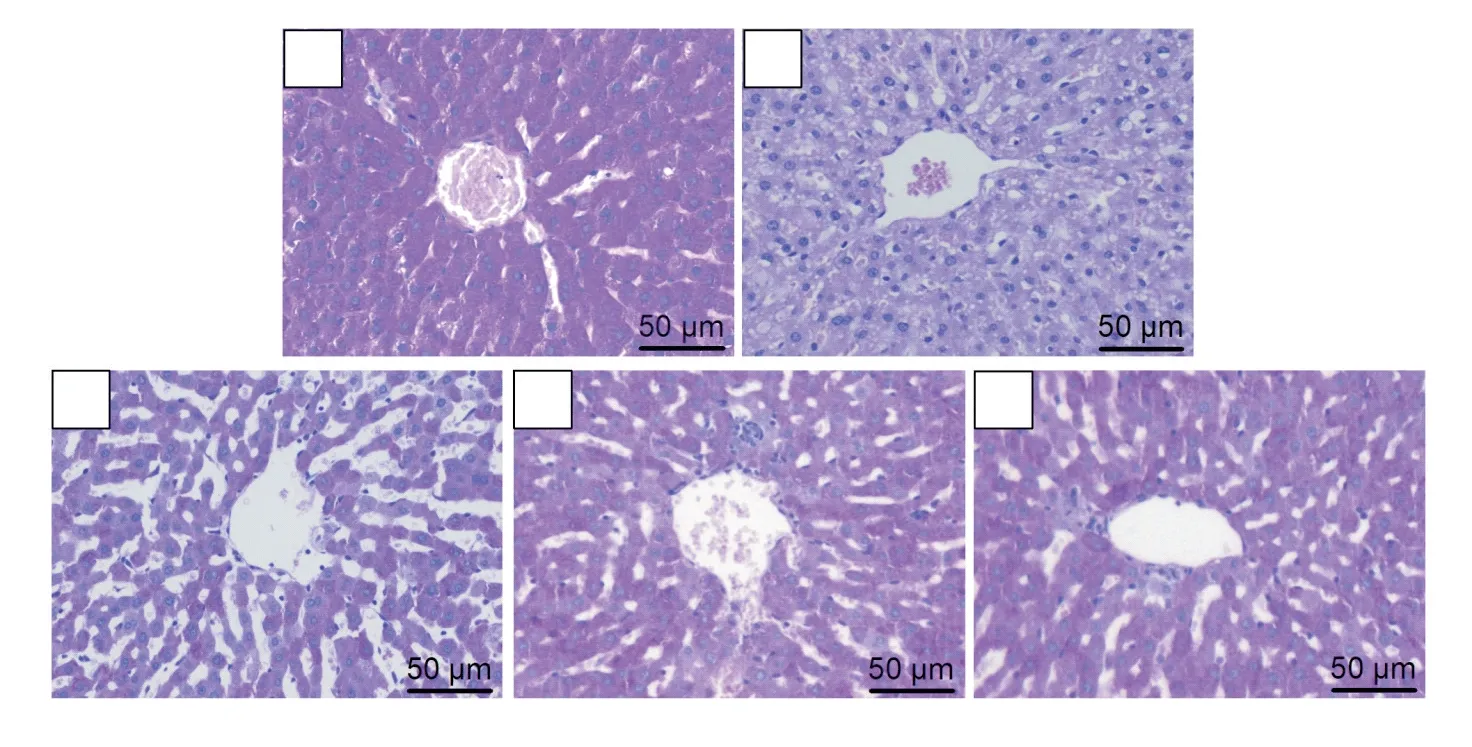
Figure 2.Glycogen staining of rat liver(scale bar=50µm).A:Con group;B:DM group;C:B1 group;D:B2 group;E:B3 group.Although deep glycogen staining was seen in Con group,it was hardly seen in DM group.The intensity of glycogen staining increased afterβ-hydroxybutyrate intervention,especially in B2 and B3 groups.图2 大鼠肝脏的糖原染色
糖供应不足时产生的酮体小分子β-羟丁酸,在其生理剂量,除供能外,还对糖尿病及其并发症发挥重要的保护作用[6,12]。有报道,β-羟丁酸可缓解糖尿病患者胰岛素抵抗状态[7]。我们前期的研究表明,β-羟丁酸通过抗氧化应激、抗纤维化等,对糖尿病大鼠的心血管损伤,发挥重要的保护作用[10,13]。本研究显示,中剂量和高剂量的β-羟丁酸干预可明显改善糖尿病大鼠肝组织细胞损伤,促进肝糖原储存,提示了其对糖尿病大鼠肝损伤和糖原耗竭的抵抗作用。然而,前期及本实验均未显示,β-羟丁酸对糖尿病大鼠血糖的显著降低作用,这可能也和STZ造成大鼠胰岛的损伤有关。
转录因子FoxO1作为胰岛素信号通路的关键下游分子,调控糖代谢的不同途径,如糖酵解、糖异生等,维持肝内代谢稳态[14-15]。当胰岛素与其受体结合后,可引起FoxO1的磷酸化,使其定位于胞浆,促进糖酵解、糖原合成等,使肝糖生成减少。而糖尿病胰岛素抵抗等病理情况下,FoxO1不能被磷酸化,从而激活入核,作为转录因子启动糖异生等相关基因的表达,使肝糖生成增多[4]。有报道,糖尿病小鼠FoxO1存在定位功能紊乱,致糖原储存减少、高血糖等病理状态[14,16]。本实验结果也提示,糖尿病大鼠肝总的及核内FoxO1蛋白含量显著增多,FoxO1明显转位入核,与研究报道相一致。而如何促使FoxO1出核,增加肝糖原储存,缓解糖尿病高血糖,也成为了研究焦点[17]。
Figure 3.Total and nuclear protein levels of FoxO1 in rat liver tissues detected by Western blot.Compared with Con group,total and nuclear FoxO1 protein levels increased in DM group,and the increased nuclear FoxO1 protein level was significantly re⁃duced in B2 and B3 groups.Mean±SD.n=3.*P<0.05 vs Con group;#P<0.05 vs DMgroup.图3 大鼠肝组织总的和胞核FoxO1蛋白水平
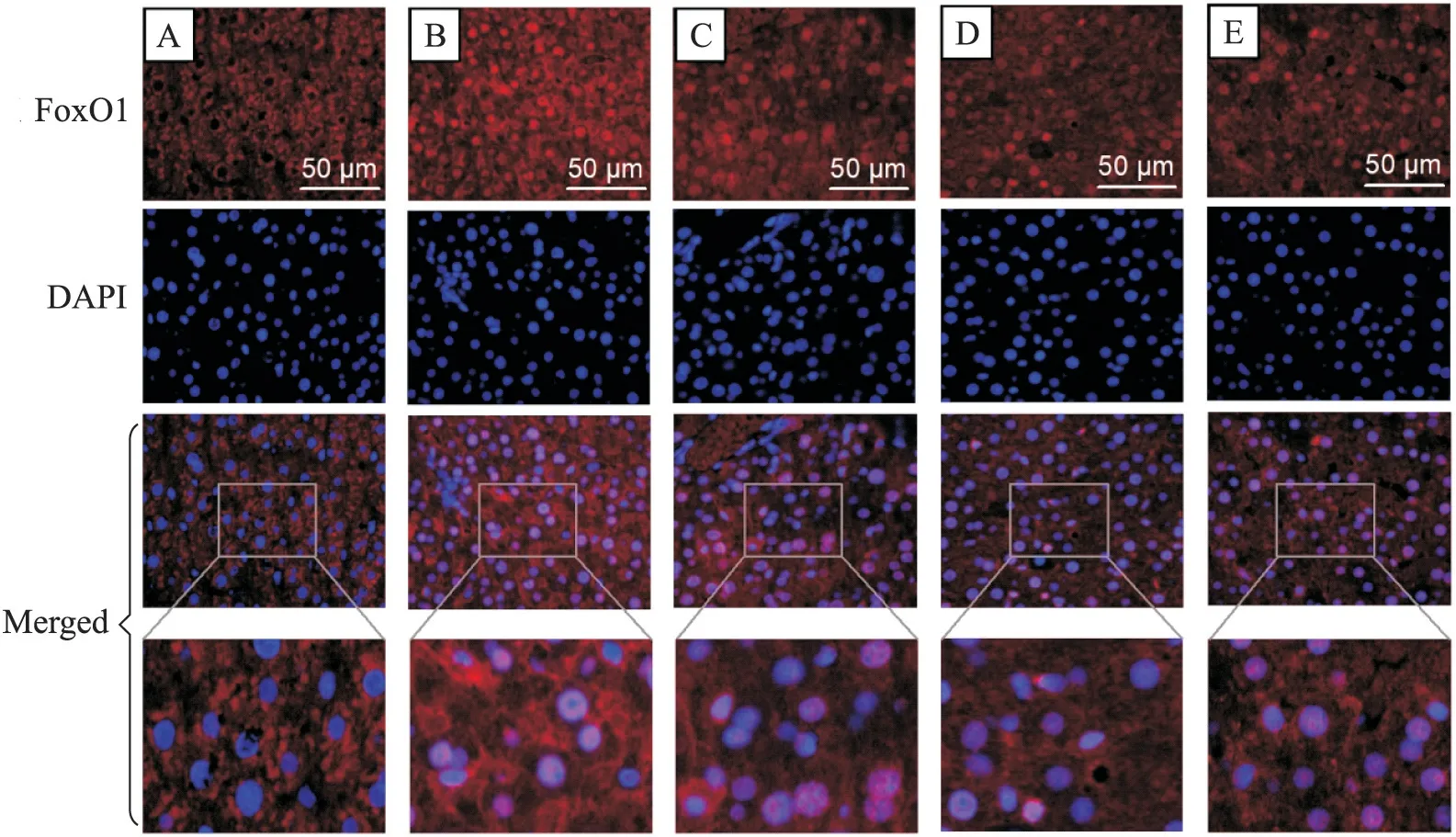
Figure 4.Distribution of FoxO1 in rat liver(scale bar=50µm).A:Con group;B:DM group;C:B1 group;D:B2 group;E:B3 group.Although FoxO1 was located in the cytoplasm in Con group,it increased and concentrated in the nucleus in DM group.The nuclear FoxO1 fluorescence weakened afterβ-hydroxybutyrate intervention,especially in B2 and B3 groups.图4 大鼠肝FoxO1的分布
代谢核心调控因子FoxO1与β-羟丁酸之间存在紧 密 联 系[8,18]。 已 知 β-羟 丁 酸 可 促 进 老 年 大 鼠FoxO1与PGC-1α的结合,起到缓解肾脏炎症损伤的作用[8]。Miyauchi等[18]报道,β-羟丁酸可上调FoxO1的表达,缓解小鼠缺血再灌注损伤导致的肝脏炎症。本研究结果提示,中剂量和高剂量的β-羟丁酸干预可显著减少糖尿病大鼠肝细胞核FoxO1的蛋白含量,抑制其核转位,增加肝糖原储存。然而,β-羟丁酸是否及如何影响糖尿病大鼠肝FoxO1的磷酸化等修饰,促使其转位出核,从而发挥保护作用的机制,尚需进一步深入探讨。
综上所述,本研究的结果提示,β-羟丁酸干预能减轻糖尿病大鼠肝脏病理损伤,增加肝糖原储存,其机制可能与β-羟丁酸抑制高糖刺激的FoxO1核转位有关。而除了FoxO1相关因素,β-羟丁酸的肝脏保护作用是否还有其它机制参与,仍需研究。

