n-3多不饱和脂肪酸对糖尿病心肌病小鼠心脏的保护作用*
陈显桐, 左盛佳, 李可欣, 刘已斌, 王超群, 肖佩仪, 赵泽新, 余细勇, 江雪燕
(广州医科大学药学院,广东省分子靶标与临床药理学重点实验室,呼吸疾病国家重点实验室药理学组,广州医科大学附属第五医院,广东广州511436)
糖尿病(diabetes mellitus)是指由胰岛素分泌障碍或其生物功能受损而引起的一种以慢性高血糖为主要特征的代谢性疾病,其主要病因是胰岛β细胞被破坏或胰岛素敏感性下降产生胰岛素抵抗导致机体血糖持续升高,临床表现为多饮、多食、多尿和体重减轻等[1]。1型糖尿病是由于胰岛β细胞功能受损而导致胰岛素分泌绝对不足,多发生于青少年和儿童;2型糖尿病是由于机体内胰岛β细胞分泌胰岛素相对不足或靶细胞对胰岛素敏感性下降使胰岛素的生物功能下降从而产生胰岛素抵抗,多发生于老年人和肥胖者[2]。糖尿病发病率高,患者基数大,现已成为严重威胁人类生命健康的主要慢性非传染性疾病[3]。由于机体长期处于高血糖状态,糖尿病可以引起全身大血管及微小血管病变,引发多种严重的并发症,如肾脏疾病、神经性疾病、视网膜疾病和心血管疾病等[4-5],其中糖尿病心肌病(diabetic cardio⁃myopathy,DCM)是最严重的心血管并发症之一。
DCM是指由糖尿病引起且与高血压、心脏瓣膜疾病和冠状动脉疾病无关的心脏结构和功能异常的心肌疾病,以心肌肥大、心脏收缩和舒张功能受损等为主要病理特征[6]。DCM的概念由Rubber等[7]于1972年首次提出,临床上DCM患者主要表现为在长期高血糖状态下所导致的心肌结构改变及心脏功能下降,包括心肌细胞炎症、凋亡和纤维化等,随着病情发展最后会出现心力衰竭,从而危及患者生命。因此,研究DCM的发病机制并寻找一种新的治疗途径对DCM的预防及治疗具有重要意义。
近年来,大量研究发现,多种炎症介质在DCM患者和动物模型中表达升高,表明炎症反应是机体早期应对高血糖环境的一种保护性反应,持续的炎症反应引发心肌纤维化和重构,最终导致心肌功能受损[8]。已有研究报道,核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization do⁃main-like receptor protein 3,NLRP3)炎 症 小 体 是DCM炎症发展中的关键环节,当NLRP3炎症小体激活后,心肌组织中促炎细胞因子白细胞介素1β(in⁃terleukin-1β,IL-1β)和IL-18分泌显著增加,导致心肌组织的炎症、纤维化和凋亡加重[9]。NLRP3炎症小体通路及其相关炎症因子的激活与DCM的发生密切相关并且在其发展中起重要作用。
n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs)是指含有2个或2个以上双键且第1个双键出现在碳链甲基端第3个碳位的多聚多不饱和脂肪酸。n-3 PUFAs广泛存在于自然界的动植物中,其中α-亚麻酸是合成DHA和EPA的前体,但人体内不能合成α-亚麻酸,必须通过食物摄取,因而一种必需脂肪酸,目前人们摄取n-3 PUFAs的主要途径是食用海洋生物[10]。研究表明,n-3 PUFAs具有改善血脂、免疫调节、抗肿瘤、抗氧化、抗炎等多种生理功能,并且对风湿性疾病、代谢性疾病、帕金森病等具有显著功效[11]。此外,大量研究显示Fat-1转基因(Fat-1+/+)小鼠是研究n-3 PUFAs的理想动物模型[12]。Fat-1基因来源于秀丽隐杆线虫,编码n-3脂肪酸脱饱和酶,后者以n-6 PUFAs为底物进行脱氢反应合成n-3 PUFAs。与野生型C57BL/6小鼠相比,Fat-1+/+小鼠能在体内将n-6 PUFAs转化为n-3 PUFAs,从而降低n-6/n-3 PUFAs比值。与饮食补充n-3 PUFAs相比,转入Fat-1基因不仅可以增加n-3 PUFAs的含量,还可以降低n-6 PUFAs的水平。因此,在不改变总脂肪酸含量的情况下,Fat-1+/+小鼠可用于n-3 PUFAs防治神经系统疾病、心血管系统疾病、癌症、骨质疏松等的动物研究[13]。目前,转入Fat-1基因已被证实具有预防肥胖、葡萄糖耐受不足和肝脂肪变性等的作用[14]。此外,已有研究表明,使用链脲佐菌素(strep⁃tozotocin,STZ)诱导1型糖尿病后,Fat-1+/+小鼠胰岛β细胞得到n-3 PUFAs的保护,血糖降低,进而糖尿病症状减轻[15]。为进一步研究n-3 PUFAs对DCM的作用及其调控机制,我们采用Fat-1+/+小鼠作为动物模型,观察n-3 PUFAs对DCM小鼠心肌炎症、凋亡和纤维化的影响,以期为DCM的预防和治疗提供新思路和新途径。
材料和方法
1 动物
6~8 周龄、体重约18~20 g的SPF级雄性C57BL/6野生型(wild-type,WT)小鼠购自广州中医药大学实验动物中心,生产许可证号为SCXK(粤)2018-0034。Fat-1+/+小鼠由广东省人民医院、广东省心血管病研究所马欢博士课题组惠赠并由本实验室进行繁殖与基因型鉴定;基因型鉴定后选取6~8周龄、体重约18~20 g的雄性Fat-1+/+小鼠用于DCM造模实验。各组小鼠分笼饲养于实验动物中心并保持温度(22±2)℃和湿度(50±10)%的饲养条件;实验前至少适应环境1周。实验方案均通过广州医科大学实验动物伦理委员会的审查和批准。实验操作符合实验动物伦理要求的相关规定并遵循实验动物的操作规范。
2 主要试剂
45%高脂饲料(D12451)购自Research Diets;STZ和D-(+)-葡萄糖购自Sigma;RIPA裂解液、蛋白酶与磷酸酶抑制剂、Trizol、BCA蛋白试剂盒和ECL化学发光试剂购自Thermo;逆转录试剂盒和预混型qPCR试剂盒购自艾科瑞生物工程有限公司;异氟烷购自于瑞沃德公司;抗cleaved caspase-3抗体、抗转化生长因子 β(transforming growth factor-β,TGF-β)抗体、抗NLRP3抗体、抗含caspase募集结构域的凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a caspase recruitment domain,ASC)抗体、抗caspase-1抗体、抗IL-1β抗体、抗IL-18抗体和抗肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)抗体均购自Affinity Biosciences;抗GAPDH抗体及辣根过氧化物酶标记的山羊抗兔和抗鼠Ⅱ抗购自北京中杉金桥公司。所用引物均由Thermo根据引物序列合成,其中用于RT-PCR的引物序列见表1。

表1 RT-qPCR引物序列Table 1.The primer sequences for RT-qPCR
3 主要方法
3.1Fat-1+/+小鼠的基因型鉴定Fat-1+/+小鼠出生后3~4周,剪小鼠尾尖2~3 mm,加入蛋白酶K于56℃水浴中消化过夜,按照DNA提取试剂盒提取基因组DNA。取100 ng基因组DNA为模板及下述PCR引物进行PCR扩增。Fat-1的PCR上游引物序列为5'-CGGCTTGATGCTCGTCATTG-3',下游引物序列为5'-TACTCTAGAACGGCACGGGA-3'。扩增条件为:94℃5 min;94℃20 s,60℃30 s,35个循环;72℃5 min。取扩增后的PCR产物10µL在含有溴乙啶核酸染料的2%琼脂糖凝胶上上样并于120 V电压电泳30 min,使用超灵敏多功能凝胶成像仪于紫外光下观察扩增条带。根据琼脂糖凝胶电泳条带结果鉴定小鼠基因型。
3.2 小鼠DCM模型的构建 6~8周龄雄性WT和Fat-1+/+小鼠分别随机分成正常对照组和DCM模型组,共4组:WT组、Fat-1+/+组、WT+DCM组和Fat-1+/++DCM组,每组8~15只小鼠。DCM模型组连续5 d腹腔注射50 mg/kg柠檬酸缓冲液稀释的STZ,对照组腹腔注射等体积的柠檬酸缓冲液,注射结束第3天测定小鼠空腹血糖,血糖浓度高于11.6 mmol/L则选取用于DCM造模并使用45%高脂饲料(high-fat diet,HFD)喂养20周,对照组给予普通饲料,期间正常饮食,自由饮水。
3.3 超声心动图测定心功能 DCM造模10周后,每隔2周应用Vevo 3100小动物超声仪(VisualSonics)对小鼠进行超声心动图检测,观察和记录左心室结构及心脏收缩和舒张功能的变化。采用异氟烷吸入法麻醉小鼠并将其固定于恒温板上,前胸脱毛后涂抹超声耦合剂,使用30 MHz超声探头在左心室乳头肌水平切面位置选取短轴方向并在M-Mode下检测心脏收缩功能,在心脏四腔心切面使用彩色多普勒和组织多普勒模式检测心脏舒张功能。超声心动图连续记录5个完整心动周期图像并使用软件测量心功能各项参数,5个心动周期的平均数值为每只小鼠的检测值。心脏收缩功能检测指标包括:左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴缩短率(left ventricular fraction shortening,LVFS)、左心室收缩末期前壁厚度(left ventricular an⁃terior wall thickness at end-systole,LVAWs)、左心室舒张末期前壁厚度(left ventricular anterior wall thick⁃ness at end-diastole,LVAWd)、左心室收缩末期后壁厚度(left ventricular posterior wall thickness at endsystole,LVPWs)、左心室舒张末期后壁厚度(left ven⁃tricular posterior wall thicknessatend-diastole,LVPWd)、左心室收缩末期内径(left ventricular internal dimeter at end-systole,LVIDs)和左心室舒张末期内径(left ventricular internal dimeter at end-diastole,LVIDd)。心脏舒张功能检测指标包括:舒张早期与心房收缩期二尖瓣峰值速度比值(mitral peak velocity ratio of early-diastolic filling to atrial contraction,E/A)和舒张早期与心房收缩期二尖瓣环峰值速度比值(mitral annular peak velocity ratio of early-diastolic filling to atrial contraction,E'/A')。
3.4 口服葡萄糖耐量实验(oral glucose tolerance test,OGTT) DCM造模实验结束后进行小鼠OGTT:小鼠禁食禁水5 h后尾静脉采血检测空腹血糖浓度,随后按照2 g/kg剂量经口灌胃葡萄糖溶液并于灌胃后15、30、60、90和120 min后尾静脉采血检测血糖浓度,计算血糖-时间曲线下面积(area under curve,AUC)。计算公式:AUC0-120=[15×(glucose0+glucose15)+15×(glucose15+glucose30)+30×(glucose30+glucose60)+30×(glucose60+glucose90)+30×(glucose90+glucose120)]/2。
3.5 RT-qPCR检测心肌组织的mRNA表达 取50 mg液氮冻存心脏组织,通过组织研磨仪粉碎后,按照试剂盒说明书提取总RNA,使用紫外分光光度计在260 nm波长下定量检测RNA的A值。按照Evo M-MLV逆转录试剂盒步骤将RNA逆转录为cDNA,逆转录条件为:42℃2 min、37℃15 min、85℃5 s。取100 ng cDNA为模板,使用SYBRGreen Pro Taq HS试剂盒,用qPCR仪扩增密,条件为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,72℃延伸5 s,40个循环。扩增后收集荧光信号并获得Ct值。内参照为GAPDH。采用2−ΔΔCt法(ΔCt=Ct目的基因−CtGAPDH;ΔΔCt=ΔCt实验组−ΔCt对照组)计算目的基因的mRNA相对表达水平。
3.6 Western blot检测心肌组织的蛋白水平 取适量液氮冻存的心脏组织,每10 mg组织加入100µL含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液后使用组织研磨仪匀浆,冰上裂解30 min后于4℃、12 000 r/min离心20 min并取其上清液。采用BCA蛋白浓度测定法定量检测蛋白浓度后加入5×SDS上样缓冲液于95℃变性15 min制备蛋白样品。使用12%SDS-PAGE分离蛋白,取30~60µg总蛋白上样后在恒压100 V下电泳2 h,恒流250 mA湿法转膜2 h后用5%脱脂牛奶封闭1 h。洗膜后与所需I抗4℃孵育过夜,1×TBST洗涤3次后加入对应II抗室温孵育2 h,洗膜后使用ECL化学发光液显影并于凝胶呈像系统中曝光成像。采用ImageJ软件对蛋白条带进行灰度值定量分析,以GAPDH作为内参照计算目的蛋白的相对水平。
4 统计学处理
所有计量资料均采用均数±标准误(mean±SEM)表示并使用GraphPad Prism 7.0统计软件进行分析。多组间均数比较采用单因素方差分析(one-way ANOVA),组间两两比较选择Tukey检验。以P<0.05为差异有统计学意义。
结 果
1 n-3 PUFAs对DCM小鼠血糖和体重的影响
根据PCR和琼脂糖凝胶电泳条带结果鉴定小鼠基因型,其中在427 bp处有单一特异的电泳条带为Fat-1+/+小鼠,WT小鼠则无此明显条带,见图1A。选取雄性Fat-1+/+小鼠用于DCM造模。DCM造模2周后,Fat-1+/+和WT两组小鼠空腹血糖浓度较造模前均显著升高,于造模后第4周达到峰值,且伴随体重逐渐减轻(P<0.05),见图1B、C。造模后小鼠血糖和体重的变化符合糖尿病特点。DCM造模20周Fat-1+/+组血糖显著低于WT组且体重显著升高(P<0.01),见图1D、E,表明Fat-1+/+小鼠经DCM造模后的血糖和体重较WT小鼠有所改善。此外,DCM造模结束后,进行OGTT并计算AUC。OGTT结果显示,DCM造模后WT和Fat-1+/+小鼠糖耐量曲线均异常升高,在15、30、60、90和120 min时点的血糖水平和血糖AUC均高于造模前(P<0.01),见图1F,表明造模后两组小鼠糖耐量受损;DCM组Fat-1+/+小鼠血糖AUC显著小于WT小鼠(P<0.01),见图1G,说明Fat-1+/+小鼠葡萄糖耐量较WT组得到有效改善,即n-3 PUFAs具有显著改善DCM小鼠糖耐量的作用。

Figure 1.Effect of n-3 PUFAs on blood glucose and body weight in DCM mice.A:identification of Fat-1 gene by agarose gel electro⁃phoresis;B:blood glucose;C:body weight;D:blood glucose at 20 weeks;E:body weight at 20 weeks;F:oral glucose tolerance test(OGTT);G:analysis of the areas under OGTTcurves.Mean±SEM.n=8.*P<0.05,**P<0.01 vs WTgroup;#P<0.05,##P<0.01 vs Fat-1+/+group;&P<0.05,&&P<0.01 vs WT+DCM group.图1 n-3 PUFAs对DCM小鼠血糖和体重的影响
2 n-3 PUFAs改善DCM小鼠左心室收缩功能
M-Mode超声结果显示,在造模第10周,DCM组小鼠的LVEF和LVFS较造模前显著降低(P<0.01)并且两者在造模后第10~20周呈时间依赖性下降,见图2A、B。此外,在造模后第20周LVAWs、LVAWd、LVPWs和LVPWd较造模前均显著减低,但LVIDs和LVIDd显著升高(P<0.05),见图2C~H,初步表明DCM造模后小鼠左心室腔增大且室壁变薄,并伴有心脏收缩功能受损。DCM造模20周后Fat-1+/+小鼠LVEF、LVFS、LVAWs、LVPWs和LVPWd均显著高于WT小鼠(P<0.05),见图2A~F,并且LVIDs和LVIDd显著低于WT小鼠(P<0.05),见图2G~I,表明DCM造模后Fat-1+/+小鼠的左心室收缩功能较WT小鼠得到有效改善,即n-3 PUFAs能显著改善DCM小鼠的左心室收缩功能。
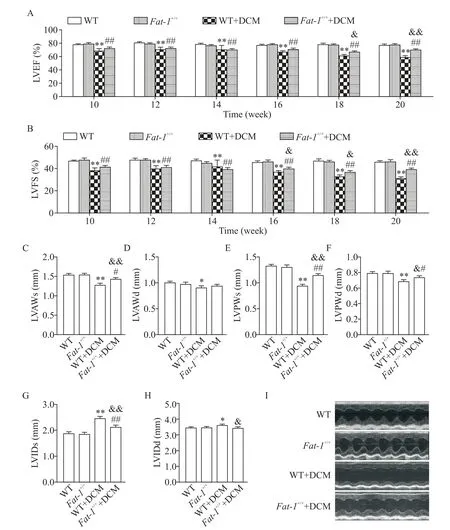
Figure 2.n-3 PUFAs improved left ventricular systolic function in DCM mice.A:left ventricular ejection fraction(LVEF);B:left ventricular fraction shortening(LVFS);C and D:left ventricular anterior wall thickness at end-systole and end-diastole(LVAWs and LVAWd);E and F:left ventricular posterior wall thickness at end-systole and end-diastole(LVPWs and LVPWd);Gand H:left ventricular internal diameter at end-systole and end-diastole(LVIDs and LVIDd);I:representa⁃tive M-mode images.Mean±SEM.n=8.*P<0.05,**P<0.01 vs WT group;#P<0.05,##P<0.01 vs Fat-1+/+group;&P<0.05,&&P<0.01 vs WT+DCMgroup.图2 n-3 PUFAs改善DCM小鼠左心室收缩功能
3 n-3 PUFAs改善DCM小鼠左心室舒张功能
彩色多普勒和组织多普勒检测结果表明,在造模第14周,DCM组小鼠的E/A和E'/A'较造模前显著下降(P<0.05);DCM组中Fat-1+/+小鼠在造模14、16、18和20周的E/A和E'/A'均显著高于WT小鼠(P<0.05),见图3。这一结果表明经DCM造模后小鼠左心室舒张功能受损,但DCM造模后Fat-1+/+小鼠的左心室舒张功能较WT小鼠得到有效改善,即说明n-3 PUFAs能显著改善DCM小鼠左心舒张功能。
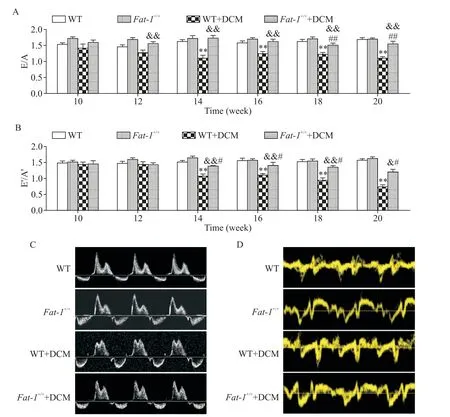
Figure 3.n-3 PUFAs improved left ventricular diastolic function in DCM mice.A:mitral peak velocity ratio of early-diastolic filling to atrial contraction(E/A);B:mitral annular peak velocity ratio of early-diastolic filling to atrial contraction(E'/A');C and D:representative pulsed-wave and tissue Doppler mode waveform images.Mean±SEM.n=8.*P<0.05,**P<0.01 vs WTgroup;#P<0.05,##P<0.01 vs Fat-1+/+group;&P<0.05,&&P<0.01 vs WT+DCMgroup.图3 n-3 PUFAs改善DCM小鼠左心室舒张功能
4 n-3 PUFAs抑制DCM小鼠心肌凋亡和纤维化相关分子的表达
DCM造模结束后使用Western blot和RT-qPCR分别检测心肌组织中凋亡凋亡执行蛋白caspase-3和促纤维化蛋白TGF-β的蛋白和mRNA表达水平。结果显示,DCM造模组小鼠心肌组织中cleaved cas⁃pase-3和TGF-β蛋白水平较造模前均显著上升(P<0.01);此外,经DCM造模后Fat-1+/+组与WT组相比,cleaved caspase-3和TGF-β蛋白水平均显著下降(P<0.01),见图4A。RT-qPCR结果趋势与Western blot结果一致,caspase-3和TGF-β的mRNA水平在DCM造模后的Fat-1+/+组中较WT组显著下降(P<0.01),见图4D。以上结果表明DCM造模后Fat-1+/+小鼠心肌组织凋亡和纤维化程度较WT组显著减轻,即n-3PUFAs能有效抑制DCM小鼠心肌凋亡和纤维化相 关分子的表达。
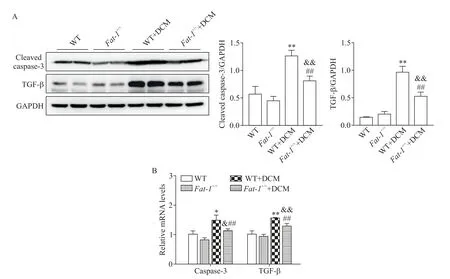
Figure 4.n-3 PUFAs attenuated the expression of cardiac apoptosis-and fibrosis-related molecules in DCM mice.A:Western blot for determining the protein levels of cleaved caspase-3 and TGF-βin heart tissues;B:RT-qPCR analysis of the mRNA levels of caspase-3 and TGF-βin heart tissues.Mean±SEM.n=8.*P<0.05,**P<0.01 vs WT group;#P<0.05,##P<0.01 vs Fat-1+/+group;&P<0.05,&&P<0.01 vs WT+DCM group.图4 n-3 PUFAs抑制DCM小鼠心肌细胞凋亡与纤维化相关分子的表达
5 n-3 PUFAs抑制DCM小鼠心肌组织中NLRP3炎症小体的活化
Western blot结果显示,DCM造模组的心肌组织中炎症小体相关分子NLRP3、ASC、caspase-1、IL-1β和IL-18的蛋白水平较造模前均显著上升(P<0.01);但以上蛋白水平在DCM造模后的Fat-1+/+组中较WT组均显著下降(P<0.05),见图5A。RT-qPCR结果显示,DCM组中炎症小体相关分子NLRP3、ASC、cas⁃pase-1、IL-1β、IL-18、TNF-α、MCP-1和IL-6的mRNA表达水平较造模前均显著上升(P<0.05);但上述mRNA表达水平在DCM造模后的Fat-1+/+组中较WT组均显著下降(P<0.05),见图5B。以上结果表明DCM造模后Fat-1+/+小鼠心肌组织中NLRP3炎症小体及其相关炎症因子水平较WT小鼠显著下降,即n-3 PUFAs能有效抑制DCM小鼠心肌组织中NLRP3炎症小体及炎症因子的转录激活。
讨 论
DCM主要表现为在长期高血糖状态下所引发的心肌细胞凋亡与纤维化等心肌结构和功能发生的特异性改变,最终导致心脏收缩和舒张功能障碍[16]。研究表明,多种危险因素引起DCM的发生和发展,其中糖尿病后出现的糖代谢紊乱是DCM的主要致病因素,机体的持续高血糖状态会诱发心肌凋亡、纤维化和炎症等心肌损伤和心脏重构,最终导致左心室功能受损[17-18]。研究表明,n-3 PUFAs具有改善血糖和血脂、抗氧化和抗炎等多种作用并能显著改善代谢性疾病[19];而Fat-1基因产物能将内源性的n-6 PUFAs转化为n-3 PUFAs,在Fat-1+/+小鼠的1型糖尿病模型中,n-3 PUFAs能够通过保护胰岛β细胞而降低血糖,从而改善糖尿病症状[20]。本实验表明在Fat-1+/+小鼠的DCM模型中,n-3 PUFAs对DCM小鼠心脏具有保护作用;主要表现为显著抑制DCM造模所致的血糖升高和口服糖耐量受损,改善左心室收缩及舒张功能,抑制心肌细胞凋亡、纤维化及NLRP3炎症小体激活,从而减轻心肌损伤。
研究报道,STZ诱导的糖尿病小鼠心肌病变以心肌纤维化为主,由于持续的高血糖导致心肌间质胶原蛋白逐渐堆积,纤维化程度不断加深,心室壁僵硬度增加,舒张期顺应性下降,导致心肌舒张功能受损。此外,持续的高血糖导致心肌细胞代谢紊乱,随着疾病的进展会逐渐出现心肌细胞损伤、凋亡和坏死及心脏重构并最终导致左心室收缩功能障碍[21-22]。本实验采用腹腔注射STZ配合45%HFD喂养进行DCM造模,在造模20周后,DCM组小鼠E/A和E'/A'均显著下降,提示左心室弛张性和顺应性受损导致舒张功能降低。此外,DCM组小鼠LVEF和LVFS显著下降,LVAWs、LVAWd、LVPWs和LVPWd显著下降但LVIDd显著上升,提示DCM造模后左心室室壁变薄而且室腔变大引起左心收缩功能下降与心脏重构,表明DCM造模20周后小鼠符合DCM特征。DCM造模后,与WT小鼠相比,Fat-1+/+小鼠血糖升高和口服糖耐量受损显著减轻,E/A、E'/A'、LVEF和LVFS增加,表明n-3 PUFAs显著改善糖代谢水平和左心舒张及收缩功能并抑制心脏重构。

Figure 5.n-3 PUFAs inhibited activation of NLRP3 inflammasome and related cytokines in DCM mice.A:Western blot for deter⁃mining the protein levels of NLRP3,ASC,procaspase-1,caspase-1,pro-IL-1β,IL-1βand IL-18 in heart tissues;B:RT-qPCR analysis of the mRNA levels of NLRP3,ASC,caspase-1,IL-1β,IL-18,TNF-α,MCP-1 and IL-6 in heart tissues.Mean±SEM.n=8.*P<0.05,**P<0.01 vs WT group;#P<0.05,##P<0.01 vs Fat-1+/+group;&P<0.05,&&P<0.01 vs WT+DCM group.图5 n-3 PUFAs抑制DCM小鼠心肌细胞炎症小体及炎症因子活化
DCM在长期高血糖状态下早期产生适应性心肌重构主要表现为心肌肥大、纤维组织增生、心肌细胞炎症和心肌凋亡等,随着病情发展心脏逐渐进入失代偿期,心脏重构加剧,最终发展为心力衰竭[23]。因此,心肌细胞凋亡和纤维化是心肌损伤和心脏重构的重要标志,也是衡量DCM进程的一个重要指标[24]。本实验检测了DCM造模后心肌组织中cas⁃pase-3和TGF-β的mRNA和蛋白水平,结果表明DCM造模后caspase-3和TGF-β的mRNA水平,以及cleaved caspase-3和TGF-β的蛋白水平均显著上升,说明通过DCM造模后心脏出现凋亡和纤维化等心肌重构的特征,提示本实验中DCM造模成功且采用的造模方法有效可行。此外,经DCM造模后Fat-1+/+小鼠心肌组织中cleaved caspase-3和TGF-β的蛋白水平显著下降,说明n-3 PUFAs可显著抑制DCM所引起的心肌细胞凋亡与纤维化;RT-qPCR结果与Western blot检测结果一致,也进一步证实n-3 PUFAs有效改善心肌凋亡和纤维化的心脏保护作用。
炎症小体是一种分布于细胞浆中的多蛋白复合物,在机体的免疫炎症反应中具有重要作用。已有研究报道,NLRP3炎症小体在DCM的炎症发展和心肌重构中起着关键的作用[25]。NLRP3炎症小体由NLRP3、ASC和procaspase-1组成,当受到外界信号刺激时,NLRP3与接头蛋白ASC结合,招募并激活procaspase-1,激活后生成的caspase-1介导IL-1β前体和IL-18前体切割活化为IL-1β和IL-18,从而引起下游的炎症反应[26-28]。在DCM小鼠中,心肌组织受损并通过氧化应激产生过量的活性氧(reactive oxy⁃gen species,ROS),随着ROS不断积累激活NLRP3炎症小体及下游的炎症因子从而加速心肌纤维化和心脏重构[29]。为探究n-3 PUFAs改善DCM的机制是否与NLRP3炎症小体及其相关炎症因子有关,本课题通过RT-qPCR和Western blot检测DCM造模前后各组小鼠心肌组织中NLRP3及其炎症因子的mRNA和蛋白水平。在DCM造模20周后,炎症相关基因NLRP3、ASC、caspase-1、IL-1β和IL-18的mRNA和蛋白水平较造模前均显著上升,提示DCM造模后NL⁃RP3通路被激活并参与调控DCM的炎症发展和心肌重构。但是,DCM造模后的Fat-1+/+组与WT组相比,NLRP3相关分子及炎症因子的表达水平均显著下降,提示Fat-1+/+小鼠心肌组织中NLRP3相关炎症因子通路被显著抑制,即说明n-3 PUFAs能有效抑制DCM所致的NLRP3炎症小体及炎症因子的转录激活,从而改善DCM。
综上所述,本研究表明在小鼠DCM体内动物实验中,n-3 PUFAs可显著抑制DCM造模所致的血糖升高、体重减轻和口服糖耐量受损,并改善左心收缩及舒张功能,抑制心脏重构和心肌损伤,其作用可能通过减轻心肌细胞凋亡和纤维化,并抑制NLRP3炎症小体及相关炎症因子激活,从而减轻心肌损伤。虽然n-3 PUFAs对DCM的具体机制及临床应用的可行性还有待进一步探究,但本课题为DCM的科学研究和临床防治提供实验基础与新的思路。

