氯胺酮相关性膀胱炎小鼠膀胱平滑肌病理生理改变及其胆碱、嘌呤和ITGB1信号通路表达的变化*
谢 翔, 梁嘉钰, 唐又山, 罗 闯, 杨佳丽, 黄 闰, 刘 星, 丁 瑜, 陈 环
(西南医科大学基础医学院,四川泸州646000)
氯胺酮(ketarnine)是我国最常被滥用的毒品之一。临床研究显示,在氯胺酮滥用的人群中,20%~30%出现严重的下尿路症状,临床表现为尿困难、尿频(严重者每15 min排尿1次)、尿急、尿痛,严重者膀胱黏膜出现红斑及溃疡并伴有黏膜出血,被称为氯胺酮相关性膀胱炎(ketamine cystitis,KC)[1]。自KC在2007年被Shahani等[2]首次报道以来,世界各地出现越来越多的相关病例报道,其发病机制也因此受到了研究人员的关注和重视,并取得了一些重要进展。
基于临床观察和对动物模型的研究,研究人员们提出了KC发生的若干理论,包括:(1)氯胺酮及其代谢产物可对膀胱上皮及间质细胞造成直接损害,破坏膀胱黏膜表面上皮通透性屏障,使尿液及其中有毒物质渗入,导致慢性炎症反应和纤维化[3-4];(2)氯胺酮及其代谢产物损伤泌尿系统微血管内皮细胞,使黏膜下毛细血管渗透性和脆性增加,进而导致黏膜缺血坏死、损伤,毒性物质渗透致膀胱组织损伤[5-6];(3)氯胺酮可引起自身免疫反应,导致自身免疫调节失衡,造成正常膀胱组织损伤,产生慢性炎症反应[7-8];(4)氯胺酮及其代谢产物促进膀胱中神经纤维增生和炎症,导致神经兴奋性增强,增加了对疼痛和压力的敏感性[9]。在以上理论中,膀胱黏膜和上表皮屏障功能受损是目前广为认可的理论。
最近多篇文章报道氯胺酮能够改变平滑肌细胞病理生理特性,包括促进平滑肌的凋亡、抑制平滑肌的增殖、改变平滑肌的收缩等[10-12]。尿动力学检查显示KC患者逼尿肌过度活跃,尿道外括约肌舒张不良,膀胱顺应性降低[13-14]。我们最近也研究报道了氯胺酮能够显著影响膀胱平滑肌的增殖和收缩,通过向健康小鼠膀胱中灌注氯胺酮能够引起膀胱逼尿肌的过度活跃甚至痉挛,表现出KC症状[10]。Huang等[12]研究发现氯胺酮不仅影响平滑肌细胞的增殖,同时会促进平滑肌细胞胶原蛋白的表达和沉积。以上研究提示我们KC的发生与膀胱平滑肌的病理生理改变可能有密切的联系。
本研究拟通过KC小鼠模型,采用尿动力学实验、排尿行为模式研究、离体肌条张力实验及病理学实验等明确KC小鼠膀胱平滑肌的病理生理改变,通过Western blot及免疫荧光实验研究KC小鼠膀胱平滑肌所涉及的相关分子信号通路改变,进而进一步扩展和完善KC的发生机制,为临床治疗提供参考。
材料和方法
1 动物
本实验采用10周龄、体重为(20.66±1.81)g的清洁级雌性C57BL/6J小鼠,均购自斯贝福(北京)生物技术有限公司,许可证号为SCXK(京)2019-0010。所有小鼠均饲养在标准动物房和入夏饲养环境:饲养温度(23±2)℃,湿度50%±10%,光照/黑暗12 h交替,自由饮水进食。所有实验均根据实验室动物护理指南进行。本研究获得了西南医科大学动物伦理委员会的批准,批准号为No.20180307002。
2 主要试剂
抗III型胶原 α1链(collagen type III alpha 1 chain,COL3A1)抗体(#PA5-27828)、Donkey anti-rab⁃bit IgG Alexa Fluor 488(A32790)和Donkey anti-rat IgG Alexa Fluor 546(A11081)购自Invitrogen;抗M3受体抗体(#PA5-77485)购自Thermo Fisher Scientif⁃ic;抗M2受体抗体(#APR-002)和抗P2X1受体抗体(#APR-001)购自Alomone Lab;抗整合素β1(integrin β1,ITGB1)抗 体(#9699)、抗 踝 蛋 白1(talin-1,TLN1)抗体(#4021)、抗黏着斑激酶(focal adhesion kinase,FAK)抗体(#3285)、抗黏着斑蛋白(vinculin,VCL)抗体(#13901)、抗桩蛋白(paxillin,PXN)抗体(#2542)、抗整合素连接激酶(integrin-linked kinase,ILK)抗体(#3856)、抗I型胶原α1链(collagen type I alpha 1 chain,COL1A1)抗体(#72026)和抗actin抗体(#4967)购自Cell Signaling Technology;抗CD39抗体(MAB4398)和 α,β-亚甲基ATP(α,β-methylene ATP,α,β-meATP;#3209)购自R&D System;氯胺酮(#78036637)购 自Patterson Veterinary;卡 巴 胆 碱(carbachol,CCh;#1092009)购自Sigma。
3 方法
3.1 KC小鼠模型的建立 参考Shen等[15]实验方法,由于小鼠代谢快,按照此方法长期注射氯胺酮不能导致明显的小鼠膀胱病理损伤,因此我们在前期研究的基础上对此方法进行了改进,增加了注射氯胺酮的剂量和频率。实验组与对照组分别腹腔注射盐酸氯胺酮注射液(每12 h注射100 mg/kg)与等体积生理盐水,诱导20周。所有研究内容都是以氯胺酮或生理盐水处理20周的小鼠为实验对象进行。
3.2 病理染色 断颈处死模型和对照小鼠,剪开下腹部取出膀胱,生理盐水洗净,多聚甲醛浸泡固定过夜。梯度脱水和透明化处理,石蜡包埋并制作切片,石蜡切片脱蜡,蒸馏水清洗后分别进行HE染色、Masson染色及甲苯胺蓝染色。随后染色切片均在光学显微镜下观察。
3.3 排尿行为模式的研究 参考Chen等[10]的实验方法,将单只小鼠轻轻放置在铺有中性滤纸的饲养笼中,将实验笼放置在安静区域4 h记录小鼠排尿行为模式,期间向小鼠提供充分的食物,但限制饮水(水滴侵入滤纸会改变尿斑面积)。每只小鼠每天1次,重复两次。实验结束后,将小鼠放回饲养笼,取出滤纸,使用紫外灯对滤纸上的尿斑进行成像,用软件ImageJ进行图像分析,统计出主要尿斑(主要尿斑≥80 mm2)个数,主要尿斑面积和尿斑总面积,从而对小鼠排尿行为模式进行分析研究。
3.4 尿动力学的检测 参考Chen等[10]的实验方法,使用腹腔注射麻醉小鼠,仰卧固定小鼠后将自制的膀胱测压管经膀胱顶端插入膀胱。丝线结扎膀胱及测压管,缝合小鼠腹部。测压管尾端连接三通管,一侧端与尿动力学检测仪的压力传感器相连,另一端与微量灌注泵相连。生理盐水(恒温,37℃)以0.025 mL/min的速度灌注膀胱。使用数据采集系统和计算机记录系统检测小鼠膀胱压力容积曲线,检测膀胱最大排尿压、排尿阈值压、排尿基础压、排尿间隔及膀胱顺应性的变化情况。
3.5 离体肌条张力实验 参考Chen等[10]的实验方法,断颈处死小鼠,剪开下腹部取出膀胱,即刻放入37℃生理液(NaCl 117 mmol/L、KCl 4.7 mmol/L、KH2PO4 1.2 mmol/L、MgCl21.2 mmol/L、NaHCO325 mmol/L、CaCl22.5 mmol/L和D-glucose 11 mmol/L)中,小心剔除黏膜层,沿纵轴将组织切成2 mm×8 mm的肌条,每个膀胱可制作肌条4根。取肌条两端以丝线结扎,一端固定于盛有37℃生理液浴槽中,且持续往恒温水浴槽底部通入95%O2、5%CO2的混合气体,另一端与拉力传感器感应头相连。由二维定位支架调节肌条长度,拉力传感器与四通道多功能生理信号放大器相连,用多媒体生物信号记录分析系统检测并记录信号。将肌条静息张力平衡至3.00 mN,60 min。检测膀胱平滑肌在胆碱信号(10µmol/L CCh)、嘌呤信号(10µmol/Lα,β-meATP)及去极化(50 mmol/L KCl)刺激下的收缩力大小。以不同频率电场刺激(electric field stimulation,EFS;1、2、5、10、20和50 Hz,脉宽0.5 ms,串长3 000 ms,电压50 V)诱发肌条收缩,检测肌条在EFS下的收缩力大小。
3.6 Western blot实验 处死小鼠后,取出膀胱,除去膀胱黏膜层,然后在液氮中匀浆并重悬。将裂解物在4℃下以12 000×g离心15 min。BCA法测定蛋白浓度。使用4%~20%Tris-glycine预制胶分离样品(20µg总蛋白质),并转移到PVDF膜。用5%脱脂奶粉封闭1.5 h后,将膜与I抗在4℃冰箱孵育过夜。TBST缓冲液洗涤3次,每次5 min,II抗室温孵育1 h,洗涤3次后ECL发光试剂盒暗室内曝光,检测免疫印迹条带的信号强度。
3.7 免疫荧光染色 处死小鼠后,取出膀胱进行包埋,液氮冻存,放入−80℃冰箱保存,将组织切成4µm薄片,用预冷丙酮固定20 min,PBS漂洗5 min×3次。将上述薄片放入含0.3%Triton的PBS 30 min,然后用1%BSA封闭10~15 min。然后加入兔抗小鼠P2X1受体抗体和大鼠抗小鼠CD39抗体,或大鼠抗小鼠ITG1B抗体和兔抗小鼠COL1A1抗体,4℃过夜,PBS漂洗5 min×3次。然后加入Donkey anti-rab⁃bit IgG Alexa Fluor 488和Donkey anti-rat IgG Alexa Fluor 546,37℃孵育1 h,PBS漂洗5 min×3次。然后用抗荧光淬灭剂封片,最后用荧光显微镜拍片。
4 统计学处理
使用GraphPrism 8.0软件进行统计学分析。计量资料以箱型图表示,中心线表示中位数,方框代表75%的数据,上边缘和下边缘分别代表数据集的最大值和最小值。采用t检验或Mann-Whitney检验进行统计推断。以P<0.05为差异有统计学意义。
结 果
1 KC小鼠膀胱平滑肌的病理改变
如图1A所示,对照组小鼠体重增长正常,氯胺酮实验组小鼠体重增加缓慢,自第4周开始,二者体重有显著差异(P<0.05),分别为(22.43±1.85)g和(20.75±1.37)g;之后差异更为显著(P<0.01),至第20周时,对照组和氯胺酮实验组小鼠体重分别为(26.26±1.80)g和(22.18±0.88)g。改进之后的KC诱导方法降低了小鼠的存活率,在氯胺酮诱导后的第4周开始出现小鼠死亡,至20周时,氯胺酮实验组小鼠的存活率为35.17%±9.24%,对照组小鼠存活率为84.62%±7.08%,两者间差异有统计学显著性(P<0.01),见图1B。在第20周时,对照组和氯胺酮实验组小鼠膀胱重量和尺寸的差异均有统计学显著性,对照组和氯胺酮实验组小鼠膀胱重量分别为(25.85±0.46)mg和(19.65±0.67)mg,见图1C、E。由于氯胺酮实验组小鼠膀胱重量和体重均显著降低,致其膀胱重量(mg)与体重(g)的比值(0.89±0.03)略接近于对照组(0.99±0.02),但差异仍有统计学显著性(P<0.05),见图1D。为了明确KC小鼠膀胱平滑肌的病理变化,我们对小鼠膀胱组织进行了HE染色、Masson染色和甲苯胺蓝染色。如图1F所示,对照组小鼠膀胱表现为正常的组织学形态,膀胱壁完整,膀胱黏膜完整,没有发生尿路上皮脱离,肌肉层无间隙,肌肉细胞连接紧密,少量胶原蛋白分布其中,肌肉层没有发现炎症细胞浸润;而在氯胺酮实验组中,小鼠膀胱壁出现明显损伤,上皮细胞脱落,膀胱黏膜屏障变薄,肌肉层间隙增大,细胞间质显著增加,并有明显的炎症细胞和肥大细胞浸润,肌肉层表现出明显的病理变化。
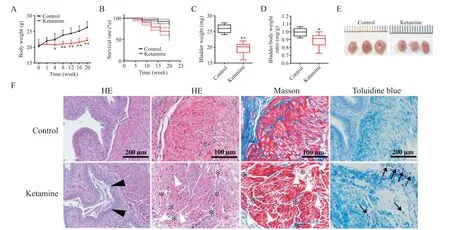
Figure 1.Establishment of mouse ketamine cystitis model and observation of the pathological changes of the bladder.A:alterations of the body weight of the mice;B:the survival rate of the mice;C:summarized data of the bladder weight at 20 weeks;D:summarized data of the bladder-to-body weight ratio at 20 weeks;E:the bladder size observation;F:representative images of HE staining,Masson staining and toluidine blue staining of the bladder cross-sections.The black triangles indicated the thin and disrupted urothelium.The white triangles indicated the infiltrating inflammatory cells.The black stars indicated enlarged space within muscle bundles.The black arrows indicated mast cells.Data were shown as box and whiskers:the centerline was the median of the data set,the box represented 75%of the data,and the whiskers indicated the minimum and maximum.Data were analyzed by the Student's t test.*P<0.05,**P<0.01 vs control group.图1 氯胺酮相关性膀胱炎小鼠模型的建立及其膀胱病理改变的观察
2 KC小鼠膀胱功能受损
为了评估KC小鼠排尿行为模式的变化,我们对对照组和氯胺酮实验组小鼠进行了尿斑实验。如图2A~E所示,对照组小鼠4 h主要尿斑数为3.31±0.36,面积为(447.7±28.16)mm2,所有尿斑总面积为(1 607±106.7)mm2;氯胺酮实验组小鼠4 h主要尿斑数为4.38±0.36,面积为(364.3±18.64)mm2,所有尿斑总面积为(1 727±120.7)mm2。氯胺酮实验组小鼠在主要尿斑数上要显著多于对照组小鼠,而在主要尿斑面积上要显著低于对照组小鼠,在尿斑总面积上没有明显变化。为了进一步分析KC小鼠的排尿行为模式,我们将所有主要尿斑按照面积区间进行了聚类并计算了分布频率。如图2F所示,对照组和氯胺酮实验组小鼠的主要尿斑面积均主要分布在200~300 mm2区间,但氯胺酮实验组小鼠主要尿斑分布在此区间的频率要明显高于对照组小鼠(33.7%vs22.03%)。而在>600 mm2区间的主要尿斑频率,氯胺酮实验组小鼠要低于对照小鼠(7.61%vs26.28%)。以上实验说明氯胺酮实验组小鼠排尿行为模式发生明显改变,排尿频率增加,而单泡尿量显著减少。为进一步分析KC小鼠膀胱功能,我们对2组小鼠进行了尿动力学实验。如图2G~M所示,氯胺酮实验组小鼠的排尿间隔[(2.22±0.44)min]、最大排尿压[(25.80±0.67)cmH2O]及膀胱顺应性[(10.42±2.70)µL/cmH2O]均显著低于对照组[排尿间隔(4.99±0.66)min,最大排尿压(35.13±2.85)cmH2O),膀胱顺应性(25.94±3.75)µL/cmH2O]。氯胺酮实验组小鼠的排尿阈压[(24.68±0.45)cmH2O]也显著高于对照组[(11.43±0.93)cmH2O],而基础压无显著变化[(8.17±0.89)cmH2Ovs(5.44±1.23)cmH2O]。以上实验结果说明KC小鼠膀胱功能受损,表现出明显的KC下尿路症状。
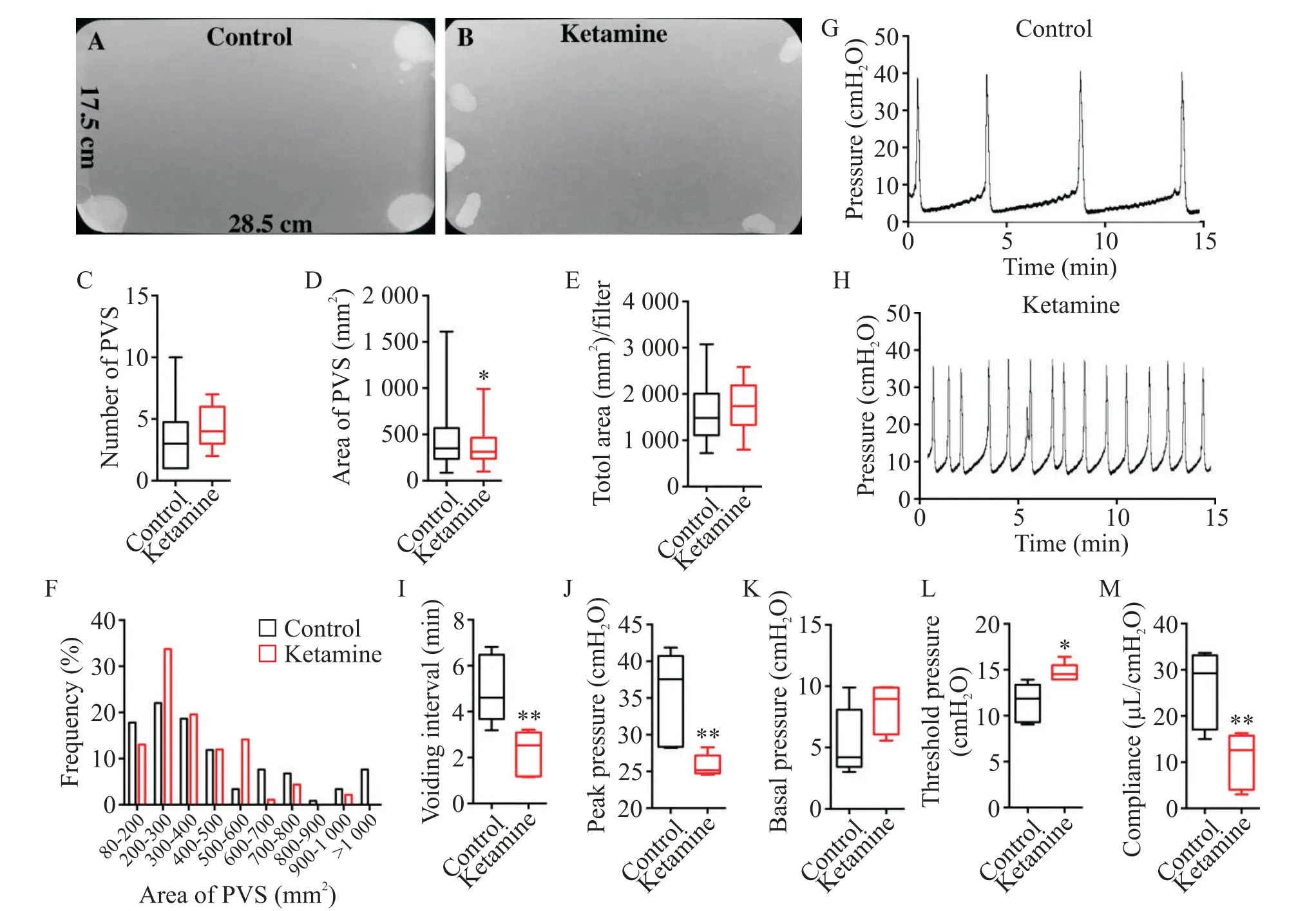
Figure 2.Ketamine cystitis mice exhibited bladder dysfunction.A and B:representative filters showed UV light-illuminated urine spots from a control mouse and a ketamine cystitis mouse;C,Dand E:summarized data of the numbers of primary voiding spots(PVS:voiding spot area≥80 mm2),area of PVS,and the total area of voiding spots per filter;F:summarized frequen⁃cy distribution histogram of spot size;Gand H:representative cystometrogram traces from a control mouse and a ketamine cystitis mouse;I to M:summarized data of cystometrogram.Data were shown as box and whiskers:the centerline was the median of the data set,the box represented 75%of the data,and the whiskers indicated the minimum and maximum.Data in Figures Cand D were analyzed by the Mann-Whitney test,while other data were analyzed by the Student's t test.*P<0.05,**P<0.01 vs control group.图2 氯胺酮相关性膀胱炎模型小鼠膀胱功能受损
3 KC小鼠膀胱平滑肌收缩受损
以上病理学检测及膀胱功能实验表明KC小鼠膀胱平滑肌具有明显的病理生理改变,为进一步分析膀胱平滑肌的收缩能力,我们进行了离体肌条张力实验。如图3A~C所示,对照组和氯胺酮实验组小鼠膀胱平滑肌在EFS下收缩,收缩力随着EFS频率的增加而增加,但氯胺酮实验组小鼠膀胱平滑肌在各频率EFS下的收缩力均要显著低于对照组。统计对照组和氯胺酮实验组小鼠在各频率EFS下的收缩力:1 Hz时为(4.42±1.03)mNvs(2.98±1.11)mN;2 Hz时为(5.31±1.26)mNvs(3.41±1.45)mN;5 Hz时为(9.19±3.02)mNvs(5.36±2.44)mN;10 Hz时为(16.14±6.83)mNvs(9.89±4.99)mN;20 Hz时为(26.22±8.87)mNvs(15.35±7.83)mN;50 Hz时为(31.96±8.00)mNvs(21.68±8.93)mN。我们接着检测了对照组和氯胺酮实验组小鼠膀胱平滑肌在胆碱信号、嘌呤信号及去极化刺激下的收缩力。如图3D~F所示,对照组小鼠在10µmol/L CCh刺激下收缩力为(31.93±1.96)mN,在10µmol/Lα,β-meATP刺激下收缩力为(9.46±1.47)mN,在50 mmol/L KCl刺激下收缩力为(30.72±3.07)mN;氯胺酮实验组小鼠在10µmol/L CCh刺激下收缩力为(24.64±2.78)mN,在10µmol/Lα,β-meATP刺激下收缩力为(5.17±0.84)mN,在50 mmol/L KCl刺激下收缩力为(18.60±3.13)mN。氯胺酮实验组小鼠膀胱平滑肌在各信号刺激下的收缩力均显著小于对照组。以上实验结果说明KC小鼠膀胱平滑肌收缩受损。

Figure 3.Ketamine cystitis mice had impaired bladder smooth muscle(BSM)contractility.A and B:representative traces of BSM contraction from a control mouse and a ketamine cystitis mouse in response to electric field stimulation(1,2,5,10,20,and 50 Hz);C:summarized data of electric field-stimulated contraction;D:summarized data of carbachol-induced con⁃traction;E:summarized data ofα,β-meATP-induced contraction;F:summarized data of KCl-induced contraction.Data were shown as box and whiskers:the centerline was the median of the data set,the box represented 75%of the data,and the whiskers indicated the minimum and maximum.Data were analyzed by the Student's t test.*P<0.05,**P<0.01 vs con⁃trol group.图3 氯胺酮相关性膀胱炎模型小鼠膀胱平滑肌收缩受损
4 KC小鼠膀胱平滑肌相关信号通路的变化
由于KC膀胱平滑肌收缩受损,我们检测了涉及膀胱平滑肌收缩相关的蛋白表达量,包括胆碱受体M2、M3及嘌呤受体P2X1。如图4A所示,与对照组相比,氯胺酮实验组小鼠膀胱平滑肌中M3受体表达无明显变化,M2和P2X1受体蛋白水平显著降低(P<0.01)。本课题组Xiang等[16]最近发现ITGB1信号通路在膀胱平滑肌的损伤修复中具有重要作用,我们接着检测了其相关信号通路蛋白在对照组和氯胺酮实验组膀胱平滑肌中的表达量。如图4B所示,与对照组相比,氯胺酮实验组小鼠膀胱平滑肌中ITGB1、TLN1、FAK、COL1A1和COL3A1蛋白水平均显著升高(P<0.01),VCL、PXN和ILK表达无明显变化。通过进一步免疫荧光实验发现,ITGB1表达在膀胱固有层和平滑肌上,COL1A1主要表达在固有层,在肌肉细胞间隙中也有分布;与对照组相比,氯胺酮实验组ITGB1在肌细胞上荧光显著增强,COL1A1浸润面积增多表达增强,见图4C。
讨 论
临床病理研究显示,KC患者膀胱具有明显的病理生理变化,黏膜层损伤显著伴有炎症细胞浸润和纤维化。Shen等[15]和本课题组Rajandram等[17]报道了KC小鼠模型及其建立方法。Rajandram等[17]采用氯胺酮剂量为30 mg·kg−1·d−1、腹腔注射持续12周的方式建立了KC小鼠模型。该模型在排尿行为模式及尿动力学上表现出明显的下尿路症状,但黏膜屏障功能实验和病理学实验显示膀胱黏膜屏障功能完整,无明显的病理变化[17]。Shen等[15]采用氯胺酮剂量为100 mg·kg−1·d−1、腹腔注射持续20周的方式建立了该模型,该模型也表现出明显的膀胱功能受损,但黏膜层相对完整。通过上述方法建立的KC小鼠模型和临床患者的膀胱病理特征上具有一定差异,这可能和小鼠的快速代谢有关。据报道,小鼠每克体重的基础代谢率比人高7倍[18],加之小鼠比人类具有更丰富的细胞色素P450功能基因,使氯胺酮在小鼠体内很快被代谢并清除。而氯胺酮可在人体内残留长达11 d,在给儿童单次静脉注射氯胺酮后14 d,尿液中依然存在去甲氯胺酮[19]。本研究在前人研究的基础上,通过提高氯胺酮注射频率和剂量(每12 h给予100 mg/kg剂量)以抵消小鼠对氯胺酮快速代谢的影响,建立了KC小鼠模型。该模型小鼠体重增长缓慢,没有小鼠出现体重负增长情况,但有部分小鼠死亡。氯胺酮滥用者也普遍存在体重过轻的现象,过量吸食氯胺酮也具有致死风险。更重要的是该方法建立的KC小鼠模型表现出与临床患者相似的病理生理特征,包括排尿频率增加、膀胱容量显著降低、膀胱黏膜损伤明显、上皮细胞脱落、有明显的炎症细胞浸润等。
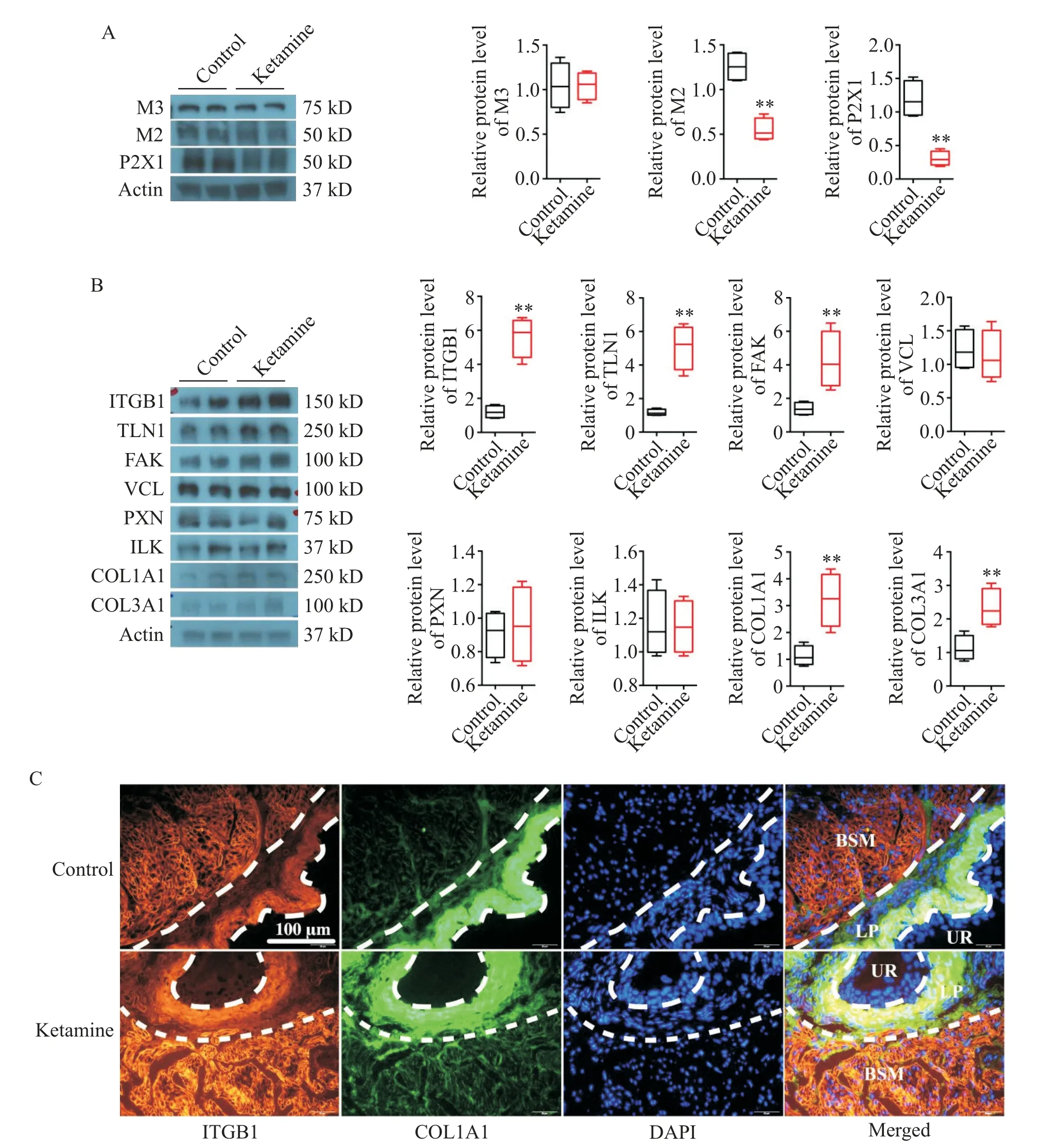
Figure 4.Altered bladder smooth muscle(BSM)-related signaling pathways in the ketamine cystitis mice.A:Western blot for deter⁃mining the protein levels of M2,M3 and P2X1 receptors in mouse bladder tissues;B:Western blot for determining the pro⁃tein levels of ITGB1,TLN1,FAK,VCL,PXN,ILK,COL1A1 and COL3A1 in mouse bladder tissues;C:immunofluores⁃cence was used to detect the localization and expression of COL1A1(green fluorescence)and ITGB1(yellow fluorescence)in mouse bladder tissues.The urothelium(UR),lamina propria(LP)and BSM layers were indicated.White dashed lines distinguished among the distinct the bladder wall layers.Data were shown as box and whiskers:the centerline was the me⁃dian of the data set,the box represented 75%of the data,and the whiskers indicated the minimum and maximum.Data were analyzed by the Student's t test.*P<0.05,**P<0.01 vs control group.图4 氯胺酮相关性膀胱炎模型小鼠膀胱平滑肌相关信号通路的变化
本研究发现KC小鼠的膀胱平滑肌出现明显病理改变,包括平滑肌层间隙增加、细胞间质增多和胶原蛋白沉积,并伴有炎症细胞和肥大细胞浸润。KC小鼠膀胱肌肉层的病理改变,在临床病例的病理标本上也有体现。肌肉细胞间隙改变会影响肌肉细胞之间的信号传递,改变肌肉的收缩能力[20]。胶原蛋白沉积和结缔组织增加会影响膀胱壁的弹性使膀胱顺应性降低[21]。浸润的炎症细胞和肥大细胞会释放各种趋化因子和炎症因子,促进炎症发展,增加神经敏感性[22]。因此,KC膀胱肌肉层的病理变化会对膀胱功能具有重要的影响。通过对KC小鼠排尿行为模式的研究,我们发现小鼠模型排尿行为模式出现明显改变:排尿频率显著增加,单泡尿量明显降低。进一步的尿动力学实验发现模型小鼠膀胱功能受损。模型小鼠排尿间隔、膀胱容量、排尿最大值压力值及膀胱顺应性均显著降低,与之前其他动物模型和临床患者的尿动力学特征一致[13-14,17]。
膀胱平滑肌的收缩和舒张能力决定了膀胱功能。通过离体肌条张力实验,我们发现模型小鼠膀胱平滑肌在各种信号刺激下的收缩能力显著降低,提示KC小鼠膀胱平滑肌收缩受损。我们最近报道了氯胺酮和去甲氯胺酮作为Cav1.2的抑制剂,不仅可以抑制膀胱平滑肌的增殖,而且会抑制膀胱平滑肌的收缩[10]。Cav1.2在KC膀胱平滑肌中的活性改变可能是平滑肌收缩受损的一个重要原因。Shen等[15]也报道了KC小鼠模型L型钙离子电压门控通道的亚基表达降低,从而影响了膀胱平滑肌的收缩。通过蛙卵实验,氯胺酮还被证明可以抑制胆碱受体信号传递[23]。我们通过Western blot发现胆碱M3受体在KC小鼠膀胱平滑肌中无显著变化,但M2受体表达显著降低。M2受体被证实是膀胱中的主要胆碱受体,其蛋白表达量要显著高于M3受体[24]。P2X1受体通常会在膀胱病理条件下上调表达,从而导致嘌呤信号介导的膀胱平滑肌收缩增强[25]。但是,我们发现P2X1受体在KC小鼠膀胱平滑肌中的表达量是显著降低的,嘌呤信号介导的膀胱平滑肌收缩力也显著下降,这和之前Meng等[26]的研究不一致,可能是因为建立KC模型的方法差异而导致的,具体机制还需要深入研究。
有研究报道ITGB1是一种重要的跨膜机械压力感受蛋白,在膀胱上表皮表达,敲除小鼠膀胱上表皮ITGB1会导致膀胱的过度活跃和尿失禁[27]。本课题组前期研究发现,ITGB1同时大量表达在膀胱平滑肌细胞膜上,其信号通路在膀胱平滑肌损伤修复中具有重要作用[16]。先前也有研究报道了ITGB及其下游信号通路在血管发育过程中对血管壁的构建发挥了至关重要的作用[28-29]。本研究发现ITGB1及其下游多个信号蛋白在KC模型小鼠膀胱平滑肌中均显著上调表达。另外,胶原蛋白在模型小鼠膀胱平滑肌中的蛋白表达量也显著升高,它们能与ITGB1受体相互作用,促进膀胱平滑肌的修复损伤[16]。
随着对KC的深入研究,学者们发现氯胺酮及其代谢产物可对膀胱上皮及间质细胞造成直接损害,破坏膀胱黏膜表面上皮屏障功能[3-4]。氯胺酮及其代谢产物还可以损伤泌尿系统微血管内皮细胞,引起局部血运障碍[5-6]。氯胺酮也能引起自身免疫反应,导致自身免疫调节失衡,造成膀胱组织损伤[7-8]。另外,氯胺酮及其代谢产物能促进膀胱神经纤维增生和炎症,导致神经兴奋性增强[2,4]。我们之前也报道了氯胺酮及其代谢产物对膀胱平滑肌的损伤和收缩抑制[10]。通过戒断氯胺酮的吸食停止氯胺酮对膀胱各组织的持续损伤是KC治疗的关键。修复受损组织,包括损伤的膀胱黏膜等对KC的治疗具有重要作用。

