Rab18通过PPARγ下调PLIN2以减少巨噬细胞脂质蓄积*
张 荣, 李晓歌▲, 陈雁斌, 蒋思怦, 杨 丽, 袁中华△
(1南华大学心血管疾病研究所,动脉硬化学湖南省重点实验室,湖南省动脉硬化性疾病国际科技创新合作基地,湖南衡阳421001;2湘南学院附属医院,湖南郴州423000)
动脉粥样硬化(atherosclerosis,AS)是以脂质代谢紊乱和炎症为主要病理基础的疾病,其发病机制尚未阐明[1]。动脉粥样硬化的主要细胞学改变是泡沫细胞的形成,泡沫细胞是由巨噬细胞或血管壁平滑肌细胞摄入大量脂质转化而来。大量摄入的脂质以脂滴(lipid droplets,LDs)的形式贮存在细胞内[2]。减少脂滴数量,抑制脂质蓄积有助于防治动脉粥样硬化。小GTP结合蛋白Rab18是位于脂滴表面的脂滴包被蛋白[3],参与调节脂质代谢和脂滴形成[4]。此外,有研究表明过表达Rab18时细胞内脂质蓄积减少,能减缓动脉粥样硬化的发生,但尚未阐明其具体机制[5-6]。
脂肪分化相关蛋白——脂滴包被蛋白2(perilip⁃in 2,PLIN2)是PAT家族中的一员,包裹在脂滴周围[7]。参与脂滴形成和脂质蓄积[8-9]。本课题组前期研究发现沉默表达PLIN2后,细胞内脂质蓄积减少,过表达PLIN2时脂质蓄积增加[10]。过表达高活型Rab18明显降低PLIN2表达,减少脂质蓄积[11]。过氧化物酶体增殖物激活受体γ(peroxisome proliferatoractivated receptorγ,PPARγ)是核受体超家族PPARs中的重要成员,主要分布在脂肪组织及巨噬细胞中,是脂质合成的重要调节因子[12]。在PPARγ−/−小鼠中,脂质蓄积明显减少。PPARγ过表达可上调PLIN2表达,且促进细胞内脂质蓄积[13-14]。
Li等[15]发现,Rab21可通过PPARγ影响脂质蓄积。Rab18与Rab21均为Rab家族成员,推测Rab18或许也可通过PPARγ来影响脂质蓄积。此外,本课题组前期实验已证实PLIN2升高可促进巨噬细胞内脂质蓄积[16]。因此,本研究在此基础上进一步探讨Rab18是否通过影响PPARγ表达而调控PLIN2水平,进而影响巨噬细胞内脂质蓄积。
材料和方法
1 主要试剂
THP-1细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。RPMI-1640培养液(HyClone);胎牛血清(杭州四季青公司);氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)购自奕源生物科技公司;Lipo-6000TM转染试剂(上海碧云天生物科技公司);表达高活型(high-ac⁃tivity,HA)Rab18[Rab18(Q67L)]、野生型(wildtype,WT)Rab18[Rab18(WT)]和低活型(low-activi⁃ty,LA)Rab18[Rab18(S22N)]的慢病毒载体质粒及DH5α甘油菌购自佳和生物科技有限公司;PPARγ激动剂GW1929和抑制剂T0070907购自MCE;抗PLIN2、PPARγ、Rab18和GAPDH抗体及山羊抗兔/抗鼠IgGⅡ抗均购自Proteintech;其它试剂均为进口或国产分析纯。
2 主要方法
2.1 细胞培养 在5%CO2、37℃的培养箱中培养THP-1巨噬细胞,视细胞生长状态换液,细胞贴壁率约75%时传代。
2.2 质粒扩增与检测 根据Ozeki等[17]的报道,我们在巨噬细胞中,分别用Rab18(WT)、Rab18(Q67L)和Rab18(S22N)质粒制备表达WT、HA和LA Rab18的细胞。将含Rab18(WT)、Rab18(Q67L)和Rab18(S22N)质粒的菌液解冻混匀,用接种环蘸取菌液划板,倒置放于37℃细菌培养箱中培养12~16 h。将不同活性的Rab18大肠杆菌视菌落生长情况,分别加入含有3 mL氨苄西林液体的培养液中,37℃摇床上扩增12 h(220 r/min)。分别取1 mL扩增后的培养液转移至100 mL液体培养液中,37℃摇床上(220 r/min)继续扩增大肠杆菌,12 h后收菌。将各菌液分别用无内毒素大提质粒盒提取Rab18(WT)和Rab18(Q67L)、Rab18(S22N)质粒,用紫外分光光度法测量A260/A280比值,检测提取各质粒的浓度及纯度。
2.3 细胞转染 将THP-1巨噬细胞在转染前一天接种到不含抗生素的6孔板中,待细胞密度达到75%左右后进行转染。分别用250µL DMEM培养液稀释5µg Rab18(WT)、Rab18(Q67L)和Rab18(S22N)质粒静置5 min,取10µL Lipo-6000TM转染试剂用移液枪加入250µL DMEM培养液中静置5 min。然后将上述试剂分别混匀静置20 min后分别加入6孔板中,并置于37℃细胞培养箱中培养4~6 h。然后将6孔板中的培养基更换为只含血清的培养基,继续培养1~2 d后用Western blot或荧光显微镜检测转染效果。
2.4 油红O染色 将THP-1细胞种于6孔板中,用50 mg/L ox-LDL孵育0、6、12和24 h,然后使用50 mg/L ox-LDL孵育24 h;PBS冲洗细胞(3次,每次10 min),在室温下用4%甲醛溶液固定30 min,再次用PBS冲洗细胞(3次,每次10 min)后与新鲜的过滤油红色O溶液一起孵育30 min;最后用苏木素复染,在光学显微镜下记录细胞的图像并根据油红O染色后的细胞内脂滴的面积进行半定量分析。
2.5 细胞免疫荧光染色 室温下,用−20℃保存的100%乙醇固定细胞,10 min后用PBS清洗。室温下,将固定好的细胞加入0.2%Triton X-100,5 min后用PBS清洗3 min×3次。然后,加入用PBS稀释的5%的血清,室温下封闭1 h。吸出封闭液,并加入稀释好的Ⅰ抗,室温下孵育1.5 h后用PBS清洗3 min×3次。加入棕色EP管中稀释好的荧光Ⅱ抗,室温、避光、潮湿条件下孵育1 h后,用PBS清洗3 min×3次。然后用DAPI染细胞核,10 min后避光拍照,存档。
2.6 Western blot分析 将待提取的未处理THP-1细胞或经转染后的THP-1细胞中加入细胞裂解液置冰上裂解,提取总蛋白。使用BCA法对蛋白定量。制备10%SDS-PAGE分离蛋白,蛋白经SDS-PAGE凝胶分离后转移至聚偏二氟乙烯膜上;转膜结束后经脱脂牛奶4℃摇床封闭4 h,后分别加入相应Ⅰ抗,4℃摇床上摇动孵育过夜;用TBST以10 min每次清洗3次;接着加入对应的Ⅱ抗,4℃摇床震荡孵育2 h,TBST洗膜,使用ECL法进行显影。
3 统计学处理
使用GraphPad Prism 8.0、SPSS和Image-Pro Plus软件统计分析结果,并作图。重复上述实验3次以上,实验结果用均数±标准差(mean±SD)表示。多组间均数比较用单因素方差分析,两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 ox-LDL处理THP-1巨噬细胞不同时间后对Rab18、PPARγ和PLIN2表达及细胞内脂质蓄积的影响
用50 mg/L ox-LDL孵育THP-1巨噬细胞0、6、12和24 h。Western blot检测结果显示,在巨噬细胞中Rab18、PPARγ及PLIN2的蛋白表达水平在24 h内随ox-LDL处理时间的延长而增加(P<0.05),见图1。
油红O染色后脂质半定量分析结果显示,巨噬细胞中脂质蓄积随着ox-LDL孵育时间的延长而不断增多(P<0.05),见图2。
2 不同活性Rab18对荷脂巨噬细胞内PPARγ和PLIN2表达及脂质蓄积的影响
不同活性Rab18质粒转染细胞的免疫荧光染色图见图3。
Western blot检测结果显示,50 mg/L ox-LDL孵育各组细胞24 h后,WT组、HA组和LA组中Rab18表达较control组明显升高,但各转染组间Rab18表达的差异无统计学显著性,见图4A;与control组相比,WT组和HA组细胞中PPARγ和PLIN2的表达量均显著下降(P<0.05),LA组细胞中PPARγ和PLIN2表达无明显变化,见图4B。
油红O染色结果显示,与control相比,WT组与HA组细胞内脂质蓄积均明显减少(P<0.05),而LA组细胞内脂质蓄积无明显变化,见图5。
3 Rab18对荷脂巨噬细胞内PPARγ核转位的影响
首先我们用免疫荧光法观察荷脂巨噬细胞中Rab18与PPARγ的共定位情况,发现Rab18(红色荧光)与PPARγ(绿色荧光)在荷脂巨噬细胞中确实存在免疫荧光共定位(图6A)。然后,我们将细胞分为control组和HA组,用50 mg/L ox-LDL孵育24 h后,免疫荧光观察PPARγ核转位情况,结果显示,与control组相比,HA组细胞核内绿色荧光明显减弱(图6B)。
4 PPARγ激动剂GW1929和抑制剂T0070907对表达HA Rab18的荷脂巨噬细胞中PLIN2表达及脂质蓄积的影响
将细胞分为4组:control组、HA组、HA+GW1929(600 nmol/L孵育24 h)组和HA+T0070907(100 nmol/L孵育24 h)组,各组分别加入ox-LDL共孵育24 h。
Western blot检测结果显示,在荷脂巨噬细胞中,与control组相比,HA组PLIN2表达显著降低(P<0.05);HA组加入PPARγ激动剂GW1929后,PLIN2表达明显增多(P<0.05);与HA组比,HA+T0070907组PLIN2表达进一步降低(P<0.05),见图7。

Figure 2.Lipid accumulation was increased in THP-1 macrophages with the extension of ox-LDL incubation time(oil red O staining,sclae bar=20µm).Mean±SD.n=3.*P<0.05 vs0 h group.图2 随着ox-LDL孵育时间的延长巨噬细胞中脂质蓄积增加
免疫荧光染色结果显示,与control组相比,HA组中PLIN2荧光强度明显减弱;与HA组相比,HA+GW1929组细胞中PLIN2荧光强度明显增强;另外,HA+T0070907组细胞中PLIN2荧光强度较HA组进一步减弱(P<0.05),见图8。
油红O染色结果显示,与对照组相比,HA细胞组脂质蓄积减少,加入PPARγ抑制剂后脂质蓄积进一步减少;与HA组相比,加入PPARγ激动剂组细胞内脂质蓄积明显增加(P<0.05),见图9。
讨 论
AS性心脑血管疾病严重损害人体健康,是当前病死率较高的一类疾病[18],其发病机制尚不明确,脂质代谢异常是公认的主要发病因素之一[19-20]。Rab18与以AS为病理基础的心血管疾病密切相关[21]。Rab18存在于真核细胞几乎全部的细胞器膜上,有活化和失活两种形式[22]。Rab18中的G结构域与GTP结合时Rab18活化并可以被募集在细胞器膜如脂滴膜上,进而与其效应蛋白相互作用,发挥膜运输、囊泡转运和信号转导等作用[17];当GTP转换为GDP时,Rab18失活并失去生物学功能[23]。脂滴分解时高活型Rab18分布在脂滴的表面加速基础脂肪的分解进而减少脂质蓄积[24],这提示Rab18可通过减少泡沫细胞形成进而抑制AS发生发展,但Rab18减少脂质蓄积的具体机制尚不明了。本研究则表明,Rab18是通过PPARγ调控PLIN2的表达从而抑制了巨噬细胞内脂质蓄积。
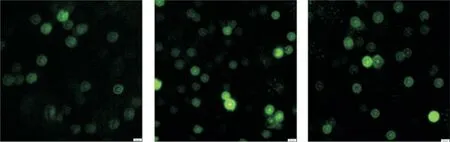
Figure 3.Immunofluorescence experiments showed wild-type(WT),high-activity(HA)and low-activity(LA)Rab18 plasmid trans⁃fection situation.Rab18 visualized by FITC-conjugated AffiniPure(green).The scale bar=20µm.图3 野生型、高活型和低活型Rab18质粒的转染情况
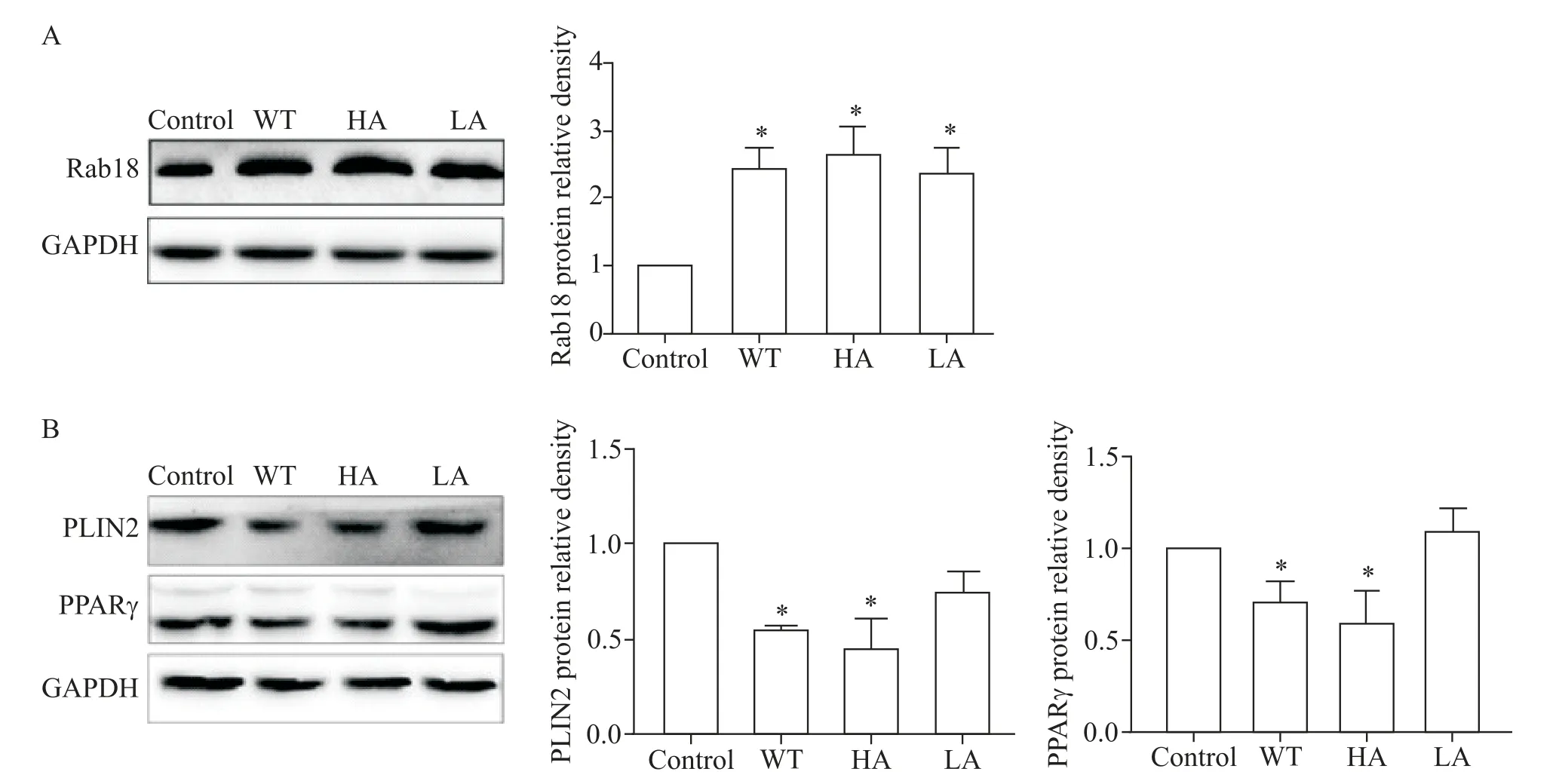
Figure 4.The changes of the expression of Rab18(A),PLIN2 and PPARγ(B)in the cells expressing wild-type(WT),high-activity(HA)and low-activity(LA)Rab18.Mean±SD.n=3.*P<0.05 vs control group.图4 各转染组细胞中Rab18、PPARγ和PLIN2表达的变化
既往研究表明,PLIN2是脂滴膜上的重要围脂滴蛋白[25]。PLIN2 N端的PAT结构域维持脂滴的稳定;其亲脂性C端,促进脂质合成[9,25]。此外PLIN2能通过调节脂滴周围脂肪合成与分解相关的酶,促进脂滴中脂质核心胆固醇酯和甘油三酯的合成,进而增加细胞内脂质蓄积[8,26]。细胞受脂肪分解刺激时,泛素-蛋白酶体溶解PLIN2的N端,脂滴的动态平衡被破坏,细胞脂质蓄积减少[25,27]。Makino等[28]研究显示,Rab18与PLIN2均参与调节以AS为病理基础的心血管疾病,且过表达高活型Rab18时PLIN2下调,但两者之间的具体机制尚不清楚。细胞核转录因子PPARγ是巨噬细胞内脂质代谢的重要调节因子[29],其C端有配体结合区域,与配体结合后被激活,然后其N端的DNA结合结构域与视黄醇类X受体(reti⁃noicacid retinoid X receptor,RXR)结合形成异二聚体,进而与下游基因启动区域中的DNA序列即过氧化物酶体增殖物反应元件(peroxisome proliferator re⁃sponse element,PPRE)序列相结合,从而调节目的基因的转录。PLIN2是PPARγ的靶基因之一,PPARγ可与PLIN2启动子上的PPRE序列相结合,促进PLIN2的表达及LDs形成[30]。Rab21可通过PPARγ/肝X受体(liver X receptors,LXR)信号通路,促进脂质蓄积。Rab18与Rab21均为Rab家族中成员。由此我们猜想Rab18是否也可通过PPARγ调节脂质蓄积。PPARγ 过表达时PLIN2的表达升高[29],提示Rab18与PPARγ和PLIN2之间可能存在相互作用,但其具体机制尚不明确。
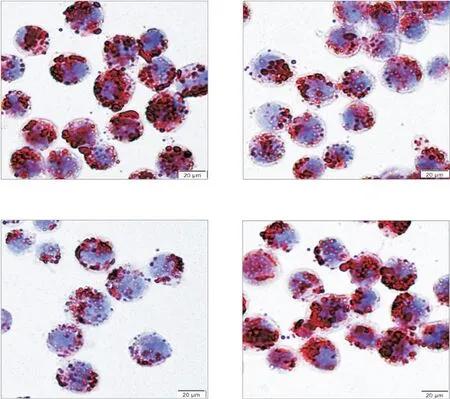
Figure 5.Changes in intracellular lipid accumulation in each transfection group(oil red O staining,sclae bar=20µm).Mean±SD.n=3.*P<0.05 vs control group.图5 各转染组细胞内脂质蓄积变化情况
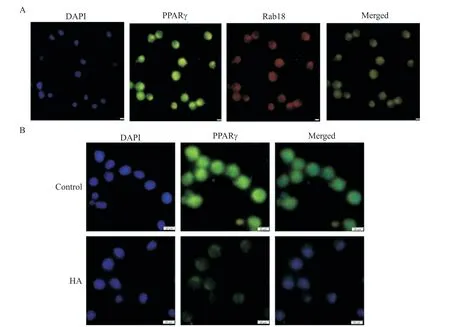
Figure 6.Co-localization of Rab18(red)and PPARγ(green)in lipid-laden macrophages(A),and the effect of Rab18 on PPARγ(green)protein and its nuclear(blue)translocation in lipid-laden macrophages(B).The scale bar=20µm.图6 荷脂巨噬细胞中Rab18与PPARγ共定位情况及Rab18对PPARγ蛋白及其核转位的影响

Figure 7.Effects of GW1929 and T0070907 on the expression of PLIN2 in the lipid-laden macrophages expressing high-activity(HA)Rab18 were detected by Western blot.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs HA group.图7 Western blot检测GW1929和T0070907对表达高活型Rab18的荷脂巨噬细胞中PLIN2表达的影响
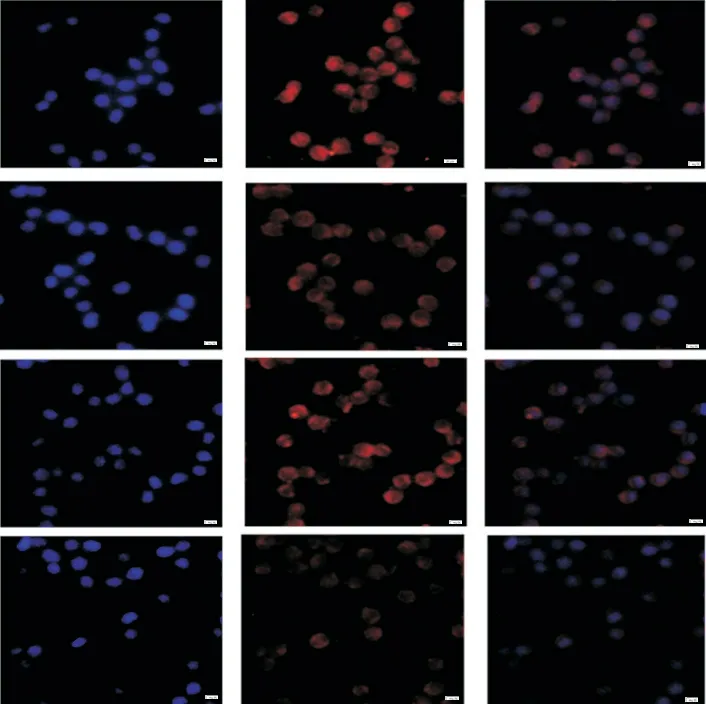
Figure 8.Effects of GW1929 and T0070907 on the expression of PLIN2 in the lipid-laden macrophages expressing high-activity(HA)Rab18 were detected by immunofluorescence staining(scale bar=20µm).Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs HA group.图8 免疫荧光染色检测GW1929和T0070907对表达高活型Rab18的荷脂巨噬细胞中PLIN2表达的影响
我们的研究结果显示Rab18各活性转染组间Rab18表达水平的差异无统计学显著性,但表达野生型Rab18和高活型Rab18的细胞中PPARγ和PLIN2表达量均显著下降,脂质蓄积减少;表达低活型Rab18的细胞中PPARγ和PLIN2表达及脂质蓄积均无明显变化。不同活性Rab18在巨噬细胞中表达无差异但对PPARγ和PLIN2表达及脂质蓄积影响不同,是因为实验中不同活性Rab18发挥生物学作用的差异与其蛋白表达量无关,而与其自身生物学功能有关[31]。这进一步说明Rab18与PPARγ可能存在相互作用。同时,我们观察到Rab18与PPARγ存在共定位,表达高活型Rab18的细胞中转入细胞核内的PPARγ明显减少,且细胞内PPARγ含量明显降低。以上实验结果说明,Rab18能下调PPARγ表达,且抑制PPARγ转入细胞核内。转入细胞核的PPARγ减少,是否会影响其下游基因PLIN2表达尚待进一步研究。Kim等[13]发现PPARγ激动时PLIN2表达明显上调。本实验发现,表达高活型Rab18的细胞中PPARγ激动时,PLIN2表达与对照组相比差异无统计学显著性。这说明活化的Rab18能抑制PPARγ激动时对PLIN2表达的促进作用。另外,我们的检测结果显示表达高活型Rab18的细胞中PPARγ被抑制时,Rab18抑制PLIN2的作用进一步增强,说明Rab18可通过PPARγ影响PLIN2的表达,从而调控巨噬细胞脂质蓄积。

Figure 9.Effects of GW1929 and T0070907 on lipid accumulation in the lipid-laden macrophages expressing high-activity(HA)Rab18(oil red Ostaining,sclae bar=20µm).Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs HA group.图9 GW1929和T0070907对过表达Rab18的荷脂巨噬细胞脂质蓄积的影响
综上所述,我们的实验表明,Rab18可减少巨噬细胞脂质蓄积,其发生机制是通过PPARγ下调PLIN2的表达,从而减少细胞脂质蓄积。这一机制的发现可能为AS的防治提供新的实验依据。

