镉胁迫对香椿幼苗生理特性的影响
偶 春,王泽璐,沈钟媛,张 敏,姚侠妹
(1.阜阳师范大学 生物与食品工程学院 抗衰老中草药安徽省工程技术研究中心,安徽 阜阳 236037;2.安徽建筑大学 建筑与规划学院,安徽 合肥 230022)
近年来,重金属污染土壤已经引起全世界的广泛关注,使得生态环境和人类身体健康都存在潜在风险[1]。镉(Cd)是一种剧毒金属,会对植物和哺乳动物等消费者造成严重的有害影响,它在土壤—植物系统中的循环具有高度的全球相关性[2]。土壤中的Cd主要来源是各种工业过程的排放物,以各种化学形式存在,其不稳定性和对植物的有效性具有很大差异。与其它金属相比,Cd具有较低的吸附系数,较高的土壤植物迁移率和较高的植物积累指数,很容易被植物富集并积聚在能够食用的部分[3]。植物对Cd吸收主要是通过根吸收必要养分的特异性和非特异性转运体[4,5],减少养分吸收、抑制光合作用、植物生长和呼吸作用、改变抗氧化系统和膜功能等途径,从而引发植物毒性,以及植物的氧化应激和遗传毒性。植物对Cd毒性的反应随品种、生长条件和暴露时间而变化。在Cd胁迫下,抗氧化防御系统的刺激、渗透调节、离子稳态和信号分子的过量产生是植物对Cd耐受性的重要机制[6,7]。研究发现,Cd胁迫会降低植物幼苗光合色素含量,并对植物的PSI和PSⅡ产生影响,尤其对PSⅡ的抑制作用更为显著[8,9];一定程度的Cd胁迫可以增强抗氧化酶活性,清除活性氧,但在较高浓度Cd胁迫下,抗氧化防御酶系统性能下降,活性氧过量引起氧化损伤[10-11]。
香椿(Toona sinensis)是楝科多年生落叶乔木,又名椿花、香椿头等。香椿原产于我国,主要分布在山东、安徽、河南、河南,河北等诸多省,是一种具有很高的营养、食用、药用及材用价值的多用途树种[12]。目前,有关香椿研究在重金属和植物激素调控等生态适应性方面的研究较少。因此,本研究从重金属胁迫响应机制方面着手,分析在不同浓度CdCl2处理下香椿幼苗生长变化和叶片光合生理特性。
1 材料与方法
1.1 材料培养与处理
本实验采用香椿实生幼苗。种子浸泡消毒24 h后,于阜阳师范大学西湖校区温室大棚内进行播种栽植,待生长4个月后,选取生长状态基本一致的香椿幼苗,连同根部整株自土中取出,放入清水中缓慢清洗后,移入容器中进行水培缓苗,待幼苗恢复正常生长后,进行不同浓度镉胁迫处理,其中以CdCl2·H2O2形式提供镉源,设置五个 CdCl2浓度梯度:0 (CK)、100、200、300 和400μmol/L。每浓度处理20株苗,3个重复,处理8 d后,进行相关形态和光合生理指标测定。
1.2 指标测定与方法
叶绿素含量测定采用乙醇提取法;H2O2含量测定使用H2O2试剂盒 (生工生物工程上海股份有限公司);丙二醛(MDA)含量的测定采用硫代巴比妥酸法[13];采用LI-6400XT便携式光合作用测量系统测定光合生理指标,如净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)。
1.3 数据处理
采用Excel 2010和SPSS 19进行数据处理与分析。各项生理指标测定重复3次后取平均值。
2 结果与分析
2.1 镉胁迫对香椿叶绿素含量的影响
植物在幼苗受到镉胁迫威胁时,形态上出现黄化萎蔫现象,这是由于植物体内叶绿素受阻所导致。如图1所示,在100 μmol/L CdCl2胁迫处理下,香椿幼苗叶片的叶绿素a含量较CK增加了8.96%,叶绿素b含量和叶绿素总量较CK分别下降了6.83%和0.15%;在200μmol/L CdCl2胁迫下,叶绿素a、b和叶绿素总量对比CK都显著下降了22.51%、20.58%和23.11%;而在300μmol/L CdCl2胁迫时,叶绿素b含量较CK有所增加12.55%,叶绿素a含量和叶绿素总量较CK有所减缓11.57%和2.47%。
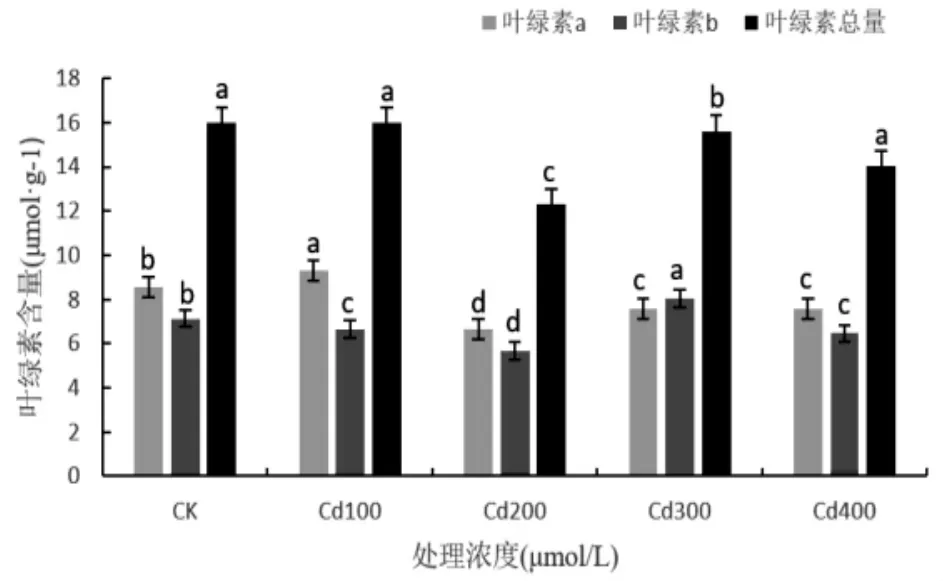
图1 CdCl2胁迫下对香椿叶片叶绿素的含量的影响
2.2 镉胁迫对香椿H2O2含量的影响
图2所示,施加不同浓度CdCl2对香椿叶片H2O2积累产生不同的效应。正常条件下香椿外施100、200、300 和 400 μmol/L 浓度的 CdCl2,叶片H2O2含量分别较 CK提高 15.96%、67.72%、42.52%和45.54%;其中,在200 μmol/L浓度处理时H2O2含量增幅最大。
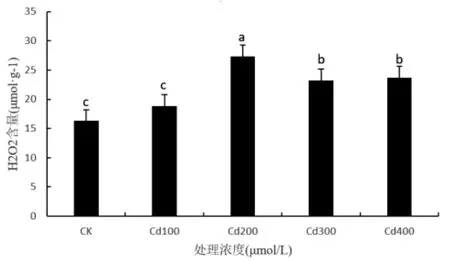
图2 CdCl2胁迫对香椿叶片H2O2含量的影响
2.3 镉胁迫对MDA含量的影响
如图3所示,在不同浓度CdCl2胁迫处理条件下(0~400 μmol/L),香椿叶片 MDA 含量整体比CK高。香椿的MDA含量随着CdCl2胁迫浓度的增加而增加,在100和200 μmol/L CdCl2胁迫下,较CK提高了34.20%和61.75%;而在中高浓度300和400 μmol/L CdCl2胁迫香椿MDA含量时,较CK增加了27.57%和36.72%,与施加100 μmol/L CdCl2浓度时差异不显著。
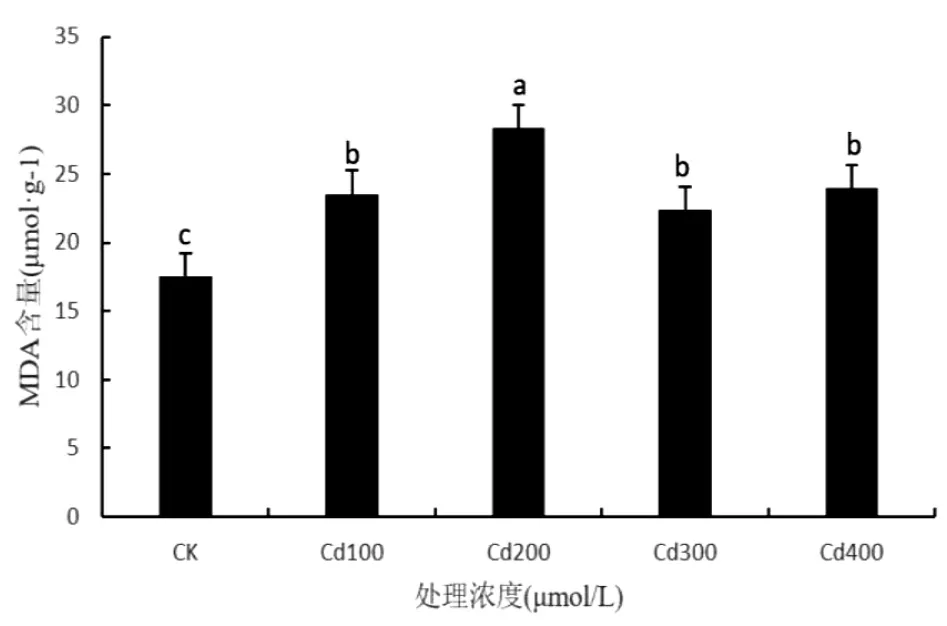
图3 镉胁迫对香椿叶片MDA含量的影响
2.4 镉胁迫对香椿叶片光合特性的影响
2.4.1 净光合速率
香椿叶片的净光合速率随着CdCl2浓度的增加而降低(图4),在 100 μmol/L CdCl2胁迫下,与CK对照下降了16.17%,在200 μmol/L处理下要比在100 μmol/L处理时下降趋势显著,对比CK下降了54.61%,但在中高浓度300和400 μmol/L时下降趋势相对平缓,对比CK分别下降了52.98%和63.71%。
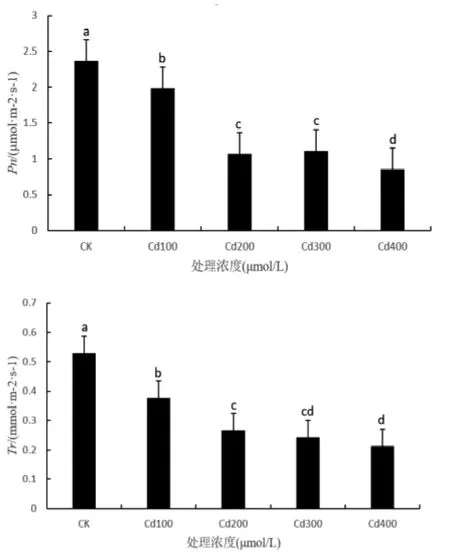
图4 镉胁迫对香椿叶片净光合速率和蒸腾速率的影响
2.4.2 蒸腾速率
图4所示,不同浓度Cd胁迫期间,香椿幼苗叶片的蒸腾速率与净光合速率的变化趋势基本一致。香椿叶片的蒸腾速率随着CdCl2浓度的增加而降低,在 100 μmol/L CdCl2胁迫时,蒸腾速率降幅显著,比CK下降了28.92%;在200、300和400μmol/L CdCl2胁迫时,降幅有所减缓,比CK分别下降49.63%、54.14%和59.80%,均与CK差异显著。
2.4.3 气孔导度
如图5所示在不同浓度CdCl2胁迫处理的香椿幼苗叶片的气孔导度,均低于对照CK,且随着CdCl2浓度的增加,气孔导度降幅减缓,在CdCl2浓度为100 μmol/L处理时下降显著,比CK下降了42.71%; 而在 200、300和400 μmol/L浓度时下降趋势相对平缓,与CK对比分别下降了和59.93%、64.17%、70.48%。
3 结论与讨论
光合作用可以为植物生存提供有机物、能量和氧气,是植物体内重要的代谢过程,是植物赖以生长和生物量递增所需的生理过程[14]。有研究证明,镉是有效的光合抑制剂,镉胁迫能抑制植物的光合作用,可以增强植物体内叶绿素酶的活性,导致分解叶绿素捕获光能的速度加快,从而使叶绿素含量低于正常值[15]。镉胁迫可通过影响与光合有关的元素吸收或同化、改变色素含量、干扰叶片气孔开闭行为等方面,进而影响植物的光合速率,使植物失绿、黄叶、生长减缓[16]。本试验发现镉胁迫能够抑制植物光合作用,首先表现在叶绿素的降低和MAD含量的增加,以及光合气体交换参数(Pn、Tr和Gs)随着胁迫浓度的增加表现出下降趋势。不同浓度的镉处理到一定浓度时均会抑制香椿幼苗植株的生长,浓度增加,抑制作用变强[17]。本试验发现,随着CdCl2浓度的增加,H2O2和MDA的含量成上升的趋势,可能是因为镉胁迫导致香椿叶片产生和积累大量ROS无法及时清除,引发膜脂过氧化作用增强。镉胁迫对受镉毒害的植物体内不仅会出现大量活性氧自由基,还会造成膜质过氧化,MDA含量显著升高,而POD、SOD和CAT等抗氧化酶能够及时消除氧自由基,解除细胞遭受氧化胁迫的危险[18]。结合试验对H2O2和MDA含量的分析结果可以推断出镉处理对香椿幼苗有严重毒害作用,在长期的镉胁迫下,会对香椿幼苗的抗胁迫能力减弱,且随着Cd2+浓度的增加会对香椿生长的抑制逐步加重,其观赏品质也在下降。镉胁迫还会导致植物叶片萎黄、生长发育迟缓、根系生长受阻、养分代谢异常、产量和品质下降以及其他的生理异常等[19,20]。
植物光合作用能力与蒸腾速率、净光合速率和气孔导度有着密切的关系,植物叶片是通过气孔与外界进行气体交换[21]。蒸腾速率是一定时间内单位面积叶片上因蒸腾作用而损失掉的水分含量,蒸腾速率和净光合速率与气孔导度有直接相关关系,植物通过气孔的开关来控制叶片的蒸腾速率,进而影响叶片的净光合速率。本试验发现在不同浓度Cd胁迫下香椿叶片的蒸腾速率和净光合速率呈显著下降趋势,蒸腾速率降低是植物自我保护反应,它减少对水分吸收的同时也减少了对重金属离子的吸收[22]。不同浓度Cd胁迫对香椿的气孔导度的变化程度来看,随着Cd胁迫的增加气孔导度变小,进入香椿叶片细胞之间的CO2越多,说明光合作用所消耗的C变少,因此蒸腾速率与净光合速率还有气孔导度呈正相关关系,都随着Cd胁迫的增加而呈下降趋势。
综上所述,镉处理致使香椿幼苗叶片叶绿素含量降低,同时光合作用受损;MDA含量增加导致香椿细胞过氧化;净光合速率、蒸腾速率以及气孔导度随着Cd2+浓度增加而降低。可知香椿在重金属镉胁迫下,香椿幼苗的生长会受到一定程度的破坏,但仍表现出较好的抗逆性,具有广泛的应用前景。

