D-缬氨酸抑制巨噬细胞M1极化的体外研究
倪宇昕,王 勇,邓艳芳
(1.华中科技大学协和深圳医院 口腔科,广东 深圳518052;2.吉林大学中日联谊医院)
菌斑生物膜是细菌与细胞外基质的共同聚合体,其对常规抗菌药的抵抗力要高于浮游细菌[1-3]。多种疾病的发生都与难以根除的特定细菌生物膜的形成有关[2,4]。枯草芽孢杆菌、金黄色葡萄球菌和铜绿假单胞菌形成的生物膜能导致发病率和死亡率增加[5-9]。针对这一难题,学者已经研发了多种破除细菌生物膜的新方法[10]。其中,D-氨基酸因为抑制生物膜形成而被认为是对抗细菌生物膜的有效方法[1,5-8]。除了直接的抗菌作用外,D-氨基酸还会影响宿主免疫系统。D-苯丙氨酸通过G偶联蛋白受体调节嗜中性粒细胞的趋化性,D-苯丙氨酸和D-亮氨酸通过甜味受体抑制先天免疫,D-色氨酸调节呼吸道的免疫耐受性[11]。巨噬细胞在防御病原体以及组织修复重塑中起着不可或缺的作用。根据微环境的差异,巨噬细胞表现出不同的功能表型,即促炎的M1极化或抗炎的M2极化[12]。IFN-γ能诱导巨噬细胞的M1表型,其特征是TNF-α,IL-6和诱导型一氧化氮合酶(iNOS)等炎性细胞因子升高[13]。而IL-4或IL-13会促进巨噬细胞M2极化的发生,随后于IL-10和TGF-β升高而IL-12降低。基于巨噬细胞的治疗策略在慢性炎性疾病[14-15]、自身免疫性疾病[16-17]和肿瘤[18-19]的治疗中已展示较好前景。然而D-氨基酸是否直接影响巨噬细胞极化还不明确。因此,本研究通过体外实验明确了D-缬氨酸对RAW264.7巨噬细胞M1极化的作用。
1 材料和方法
1.1 实验材料和主要试剂D-缬氨酸购自Sigma-Aldrich公司(上海,中国)。LPS、IFN-γ、Elisa试剂盒和iNOS检测试剂盒购自碧云天公司(北京,中国)。CCK-8试剂盒和引物购自生工生物(上海,中国)。荧光显微镜购自奥林巴斯(日本)。RAW264.7细胞购自中国医学科学院基础医学研究所细胞资源中心(北京,中国)。
1.2 细胞培养和分组液氮中取出冻存细胞,迅速放入37℃水浴融化,吸至培养瓶中,加入DMEM培养液(含10% 胎牛血清),置于培养箱(37℃、5% CO2、100%湿度)中培养。每2-3天更换一次细胞培养基,当细胞融合到70%到80%时传代。按着培养液中D-缬氨酸的浓度分组:不含D-缬氨酸的是对照组,含有D-缬氨酸的是实验组,每组均重复进行3次。
1.3 细胞毒性测定将RAW264.7细胞与D-缬氨酸共同孵育24 h后,向各组细胞中加入CCK-8试剂,4 h后利用酶标仪进行吸光度的测定,以对照组吸光度为1,对实验组的吸光度进行相对定量计算。
1.4 诱导RAW264.7细胞M1极化向细胞培养液中分别加入LPS (1 μg/ml)和IFN-γ(20 ng/ml)制成M1诱导培养液,用于后续M1诱导实验。
1.5 实时定量 PCR法检测利用M1诱导液培养RAW264.7细胞,实验组中D-缬氨酸浓度为80 mM。培养24 h后利用Trizol提取细胞总RNA,测定浓度后进行逆转录得到cDNA,随后使用进行real time PCR实验。使用的引物正反序列如下:
IL-6:5′-CTCCGACTTGTGAAGTGGTATAG-3′,5′-CCACCTCAATGGACAGAATATCA-3′;
IL-1β:5′-AGTTGACGGACCCCAAAAG-3′,5′-TTTGAAGCTGGATGCTCTCAT-3′;
TNF-α:5′-GCTCTTCTGTCTACTGAACTTCGG-3′,5′-ATGATCTGAGTGTGAGGGTCTGG-3′;
iNOS:5′-CAGCTGGGCTGTACAAACCTT-3′,5′-CATTGGAAGTGAAGCGTTTCG-3′;
β-肌动蛋白:5′-CCACCATGTACCCAGGCATT-3′,5′-AGGGTGTAAAACGCAGCTCA-3′。
结果使用2-ΔΔCT方法计算基因相对差异。
1.6 iNOS检测实验开始前将将检测试剂加入M1诱导液中,4 h后更换培养液为普通培养液,用荧光显微镜观察细胞并在同参数下拍照,对比不同组中细胞表达iNOS的差异。
1.7 Elisa检测利用M1诱导液培养细胞48 h,吸取培养液上清,离心后用于Elisa检测IL-1β、IL-6和TNFα。
1.8 统计学分析结果以平均值±标准偏差(M±SD)方式呈现。使用GraphPad Prism 6.0软件进行单因素方差分析,并定义P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度D-缬氨酸对Raw264.7细胞毒性本研究评估了浓度为0 mM至400 mM的D-缬氨酸对RAW264.7细胞的细胞毒性。如表1所示,结果显示最佳生存力为50 mM,随着浓度增加,呈现一定的细胞毒性。因此,将50 mM D-缬氨酸用于实验。

表1 不同浓度D-缬氨酸对Raw264.7细胞24 h毒性分析
2.2 D-缬氨酸减少炎性因子的表达使用实时定量PCR方法分析D-缬氨酸是否影响炎细胞因子的转录,在LPS /IFN-γ刺激RAW264.7细胞后,IL-6,IL-1β,TNF-α和iNOS的mRNA水平高于未刺激的RAW264.7细胞。在LPS /IFN-γ诱导的RAW264.7细胞M1极化过程中添加50 mM D-缬氨酸则会严重抑制这些基因的转录(表2)。使用ELISA来确定D-缬氨酸是否在蛋白质水平上影响IL-6,IL-1β和TNF-α的表达,与未刺激的细胞相比,LPS刺激的RAW264.7细胞呈现IL-6,IL-1β和TNF-α的水平升高。此外,在LPS /IFN-γ诱导的巨噬细胞M1极化过程中添加50 mM D-缬氨酸可部分抑制这一作用(表3)。使用荧光显微镜检测iNOS的表达量。如图1所示,在LPS /IFN-γ的存在下,细胞中的荧光急剧增加,而D-缬氨酸的添加则抑制了这种增强,提示细胞中iNOS表达下降,这与PCR结果一致。
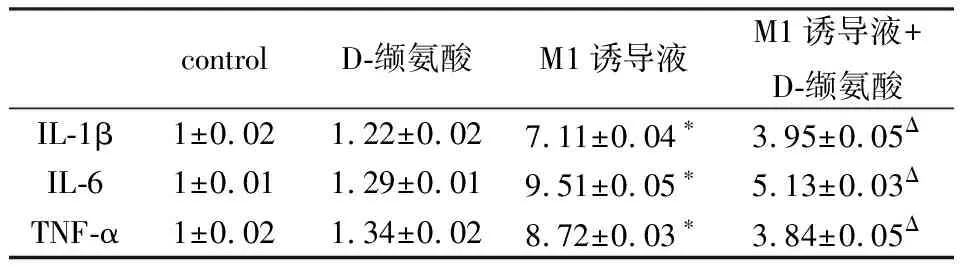
表2 实时定量PCR结果

表3 Elisa结果 (pg/ml)

图1 细胞iNOS荧光检测(40×)
3 讨论
D-氨基酸对于细菌生物膜的破除作用已在多个研究中被证实。D-酪氨酸联合丁胺卡那霉素对铜绿假单胞菌生物膜的影响,补充D-酪氨酸克服了铜绿假单胞菌生物膜对AMK的耐药性[8]。Leiman等人的一项研究也报道了D型氨基酸对枯草芽孢杆菌生物膜形成的破除作用,该抑制作用是由于D型氨基酸对蛋白质合成的抑制而产生的[20]。此外,有学者研究了D型氨基酸对抗菌肽的作用,证实其能够促进抗菌肽的作用[21]。但是关于D型氨基酸对宿主免疫系统的影响还不明确,因此本研究中针对这一问题进行了初步探索。
因为D型氨基酸不存在于人体内,所以首先需要明确D-缬氨酸的细胞毒性,结果表明低浓度时没有明显的细胞毒性,而高浓度时呈现出一定毒性,据此选择了50 mM作为后续实验的浓度,也提示在具体应用时应当考虑潜在的毒性反应。在应用D型氨基酸进行细菌破膜效应时,需要面对相对复杂的体内环境,特别是对细菌清除直接相关的巨噬细胞。巨噬细胞是参与先天性免疫应答的重要调节剂,并且已经被认为是组织炎症进展中的关键因素。巨噬细胞的两种不同表型,由经典活化的巨噬细胞(M1)和交替活化的巨噬细胞(M2)组成,在炎症和组织修复过程中发挥不同作用。M1巨噬细胞可以由单核细胞在LPS和IFN-γ刺激下,通过经典的NF-κB信号通路诱导,而M2巨噬细胞可由单核细胞通过M-CSF和IL-4刺激而来。
本研究采用LPS联合IFN-γ的方法诱导M1巨噬细胞。通过对标志物的荧光定量PCR结果和Elisa结果分析,表明成功的实现了诱导。单纯应用D-缬氨酸不会引起显著的炎性因子升高,但是在诱导液条件下,却能够抑制炎症反应,明显降低IL1β、IL6和TNFα的表达。通过分析细胞中iNOS的表达也证实了D-缬氨酸的抗炎作用,综合这些证据,可以明确适宜浓度的D-缬氨酸具有一定的抗炎效果,从而发挥抗菌和抗炎的协同效果,从而具有较好的应用前景。但是受限于本研究中采用的体外研究方法,仍需要更多的体内实验验证这一作用,此外关于其可能的抗炎机制也需要在今后的研究中进一步发掘。

