三例伴有t(18;22)(q21;q11)慢性淋巴细胞白血病的细胞及分子遗传学研究*
向鑫 刘恒芳 曾招 白淑潇 岑建农 金松 沈宏杰 陈苏宁 潘金兰
位于18q21染色体上的BCL-2是一种癌基因,其蛋白具有抗凋亡功能,在肿瘤中通常发生过表达。在淋巴细胞增殖性疾病中,最常见的导致BCL-2过表达的机制为14和18号染色体易位,即t(14;18)(q32;q21),位于14q32的IGH基因与位于18q21的BCL-2基因并置,导致BCL-2基因过表达。此类染色体易位可见于80%~90%的滤泡淋巴瘤(follicular lymphoma,FL)和慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)。而t(18;22)(q21;q11)核型比较少见,被认为是t(14;18)(q32;q21)的变异易位,分子研究发现,该异常导致BCL-2基因与位于22q11的IGL基因并置,同样导致BCL-2基因过表达。目前为止,本中心发现3例t(18;22)(q21;q11)异常核型病例,并对其进行了FISH和全基因组测序等研究,现将结果汇报如下。
资料和方法
1 实验方法
1.1 研究对象:我们回顾性筛查了2012年1月~2019年1月在苏州大学第一附属医院进行染色体检测的患者,3例为t(18;22)(q21;q11)异常,均为CLL,CLL的诊断符合《血液病诊断及疗效标准》[1]。
1.2 染色体检测:抽取患者骨髓或外周血,进行DSP30+IL-2刺激剂的培养,按常规方法制备染色体,再进行R显带和常规染色体核型分析。根据2016年国际人类细胞基因组命名体制[2]描述克隆性核型异常。
1.3 荧光原位杂交(FISH)检测:例1患者复查时进行了CLL组套(13q14/Rb1,p53,cen12,ATM)和BCL-2重排的FISH检测,例2和例3患者初诊时均进行了BCL-2重排的FISH检测,其中例3患者同时进行了CLL组套FISH。至少分析300个间期核细胞。利用OLYMPUS BX51荧光显微镜(日本OLYMPUS)捕获FISH信号,并用VideoTest-FISH 2.0成像软件(俄罗斯)扫描和捕获图像。
1.4 全基因组测序:例1患者的DNA被送至上海天昊公司进行人全基因组测序,gDNA文库构建使用Illumina公司生产的TruSeq Nano DNA HT Sample prep Kit,按照厂家的标准流程进行。根据断裂位点设计引物,采用PCR方法扩增,然后通过DNA电泳验证断裂位点。
2 临床资料
2.1 例1患者:男性,64岁。2019年1月于本院门诊就诊,行骨穿进行检测,骨髓细胞形态学显示骨髓增生明显活跃,淋巴细胞比例明显增高占91.5%;骨髓淋巴细胞免疫分型显示,可见82.1%的成熟克隆性B淋巴细胞为 CD5+、CD19+、CD20+、κ+、CD23±、FMC7±、CD10–、CD38–、λ–;患者同时检测淋巴结组织免疫表型,结果与骨髓细胞免疫表型一致,具体结果见表1;二代测序显示DNMT3AT突变;诊断为CLL。
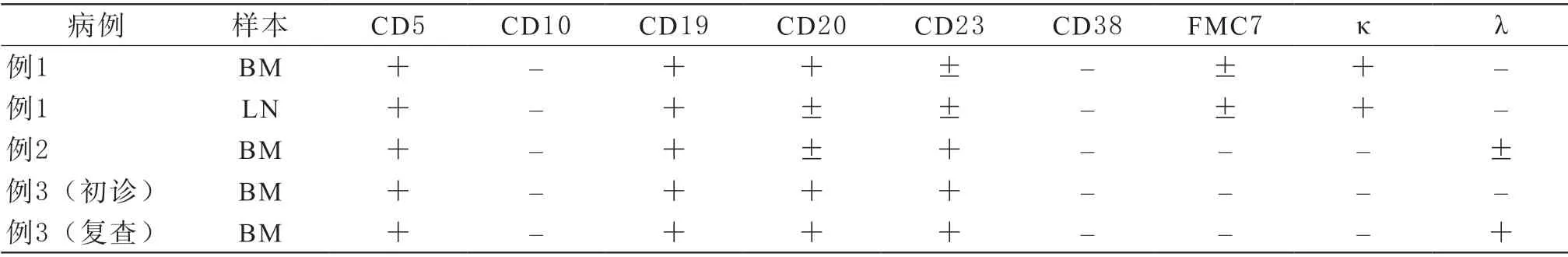
表1 3例患者细胞免疫表型检测结果
2.2 例2患者:外院送检患者,男性,65岁。2018年11月初诊时,骨髓淋巴细胞免疫分型显示,49.2%的成熟克隆性B淋巴细胞为CD5+、CD19+、CD23+、CD10–、CD38–、FMC7–、κ–、CD20±、λ±,结果见表1;多重PCR结果阴性;IG基因重排阳性,TCR基因重排阳性;诊断为CLL。
2.3 例3患者:女性,44岁。2010年9月于本院门诊就诊,骨髓细胞形态学显示淋巴细胞增殖性疾病可能,成熟淋巴细胞84.5%;骨髓淋巴细胞免疫分型显示,94.6%的成熟克隆性B淋巴细胞为CD5+、CD19+、CD20+、CD23+、CD10–、CD38–、FMC7–、κ–、λ–。2015年4月再次对骨髓细胞进行免疫分型检测,发现97.1%的成熟克隆性B淋巴细胞为CD5+、CD19+、CD20+、CD23+、CD10–、CD38–、FMC7–、κ–、λ+,与初诊结果相比,初诊时λ阴性,复查时λ转为阳性,其它结果一致。2018年10月检测IGHV突变率为9.7%。
结 果
1 染色体检测 例1患者在初诊和治疗期间共行2次染色体检测。初诊时5个细胞为t(18;22)(q21;q11)同时伴有+12和体质性inv(9)异常,2个细胞为唯一inv(9)体质性异常;治疗9个月后染色体结果仍旧没有改变,6个细胞为唯一inv(9)异常,4个细胞为t(18;22)(q21;q11)同时伴有+12和inv(9)。例2患者初诊时10个细胞均为t(18;22)(q21;q11)异常,治疗6个月后3个细胞为t(18;22)(q21;q11)异常(图1),17个细胞正常。例3患者初诊时为正常核型,治疗4年6个月后复查染色体,5个细胞为唯一t(18;22)(q21;q11)异常,2个细胞同时伴有13q–,3个细胞为正常核型,至2019年11月复查染色体已进展为伴有t(18;22)的复杂异常。
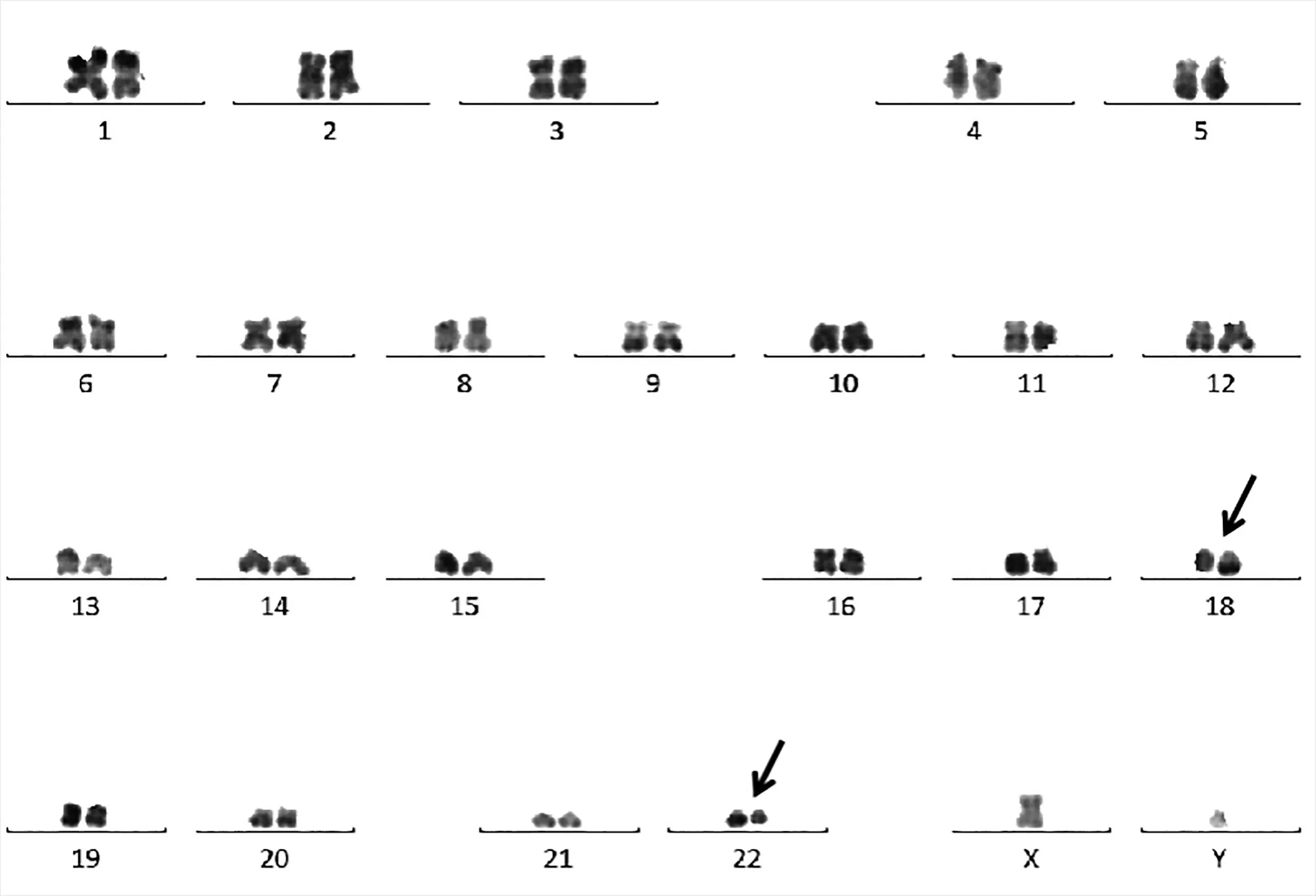
图1 例2患者R显带染色体核型图:46,XY,t(18;22)(q23;q11)
2 FISH 检测 例1患者复查时CLL组套FISH结果为+12阳性75%,其余为阴性;BCL-2重排阳性25%。例2患者初诊时BCL-2重排阳性60%,未行CLL组套FISH检测。例3患者初诊时CLL组套FISH检测结果为13q–阳性51%,Rb1缺失阳性44%,其余为阴性;BCL-2重排阳性73%(图2),治疗后2次CLL组套FISH检测结果仍旧为13q–阳性,比例分别为86%(Rb1 88%)和78%(Rb1 75%)。
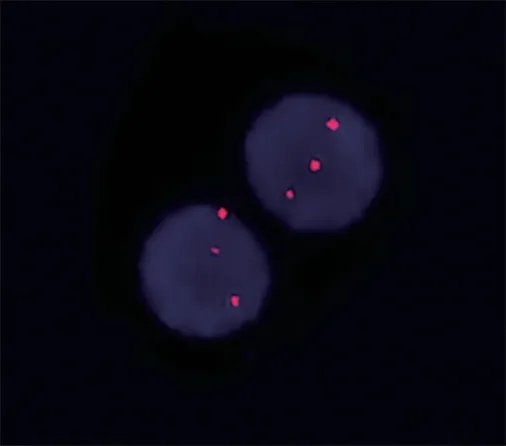
图2 例3患者骨髓细胞FISH结果
3 全基因组测序 例1患者DNA全基因组测序结果显示累及18号和22号染色体(图3)。18号染色体受累基因为BCL-2,22号染色体受累基因均为IGLL5。在DNA水平对基因测序结果进行了验证,确定为BCL-2与IGLL5出现并置,并且RNA水平未发现有RNA转录本。
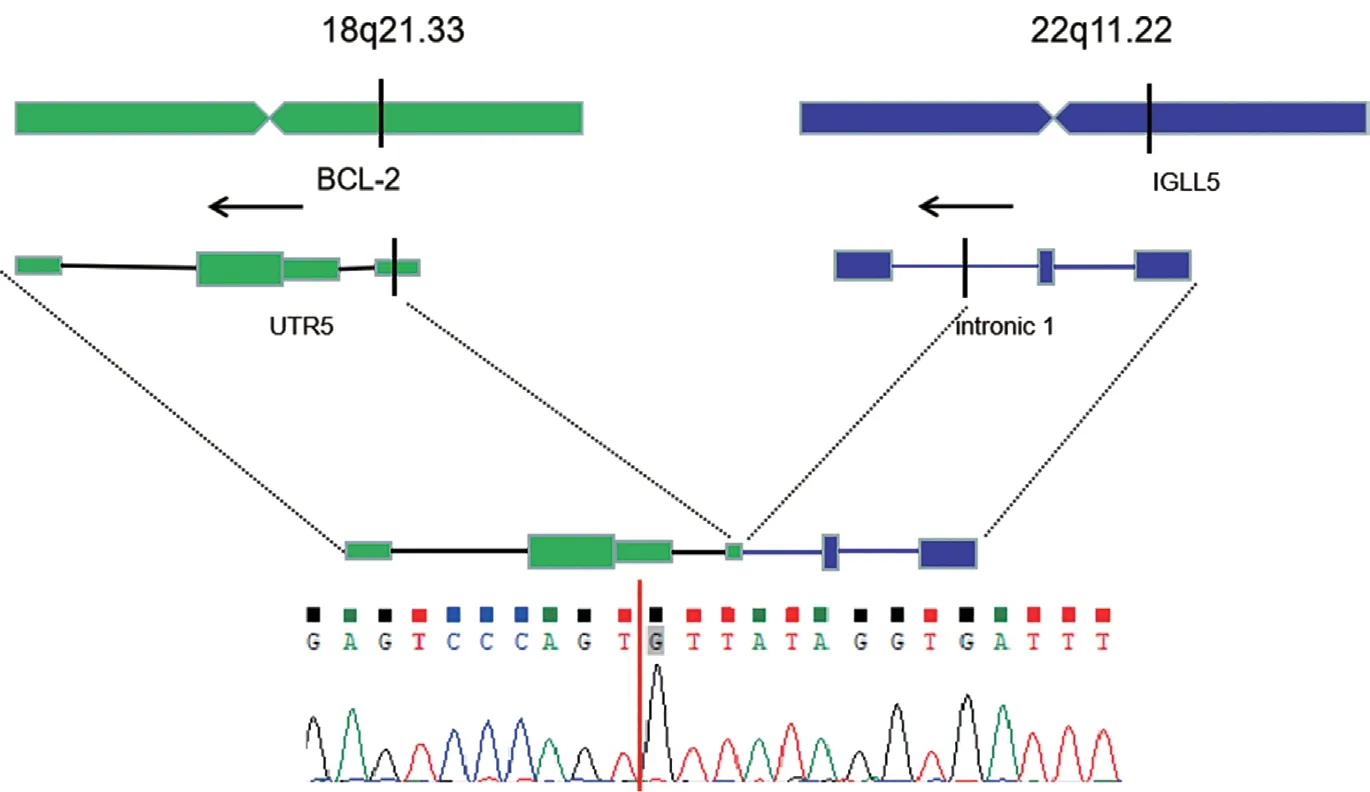
图3 例1患者DNA全基因组测序结果
4 治疗经过 例1患者诊断后予以口服留可燃治疗,效果不佳,改用伊布替尼治疗,口服伊布替尼1个月,因血小板下降,予以停用。定期复查血象,提示白细胞计数升高,随后间断口服伊布替尼治疗。2019年10月因出现发热,予以骨穿复查,形态显示骨髓增生明显活跃,淋巴细胞比例偏高占91%。淋巴细胞免疫分型显示91.0%的CD5+CD10–成熟克隆性B淋巴细胞。后患者因医保问题自行出院,未继续治疗。目前门诊随访,血象控制不佳。例2患者诊断后予以3个疗程FC方案治疗,2019年4月复查,骨髓淋巴细胞免疫分型未见异常;2019年9月复查,骨髓淋巴细胞免疫分型显示2.7%的CD5+成熟克隆性B淋巴细胞;患者未觉特殊不适,目前自觉症状良好。例3患者2010年9月予以4个疗程FC方案化疗后,病程未缓解。随后历经多次化疗及临床试验,仍未缓解。2018年3月开始口服伊布替尼治疗,2018年10月因反复发热,停用伊布替尼。骨穿复查,形态显示骨髓增生活跃,淋巴细胞占99%。淋巴瘤免疫分型显示91.9%的CD5+成熟克隆性B淋巴细胞。骨髓活检(大病理)提示符合小B细胞淋巴瘤/淋巴细胞白血病。淋巴结活检显示符合小B细胞淋巴瘤/淋巴细胞白血病。IGHV突变率为9.7%。之后于2019年4月继续口服伊布替尼至今,目前血象正常。
讨 论
超过80%的CLL患者有染色体异常,大多为13q–、+12、11q–、17p–等,而累及14q32/IGH重排的异常则非常少见,仅见于4%的CLL[3]。t(14;18)(q32;q21)核型是其中一种,在分子水平上位于14q32的IGH基因与位于18q21的BCL-2基因并置,导致BCL-2基因过表达,该异常被认为是FL的特征性异常,可见于90%以上的FL,少数见于CLL[4,5]。t(18;22)(q21;q11)被认为是t(14;18)的变异易位,在分子水平上位于22q11的IGL基因和位于18q21的BCL-2基因并置,同样导致BCL-2基因过表达[7]。t(18;22)(q21;q11)异常最早由ADACHI等[8]于1989年首次报道,迄今为止共有32例报道,其中24例为CLL,3例为FL,3例为非特殊类型成熟B淋巴细胞肿瘤,2例为弥漫大B细胞淋巴瘤。这些资料表明,尽管t(14;18)异常大多见于FL,但其变异易位t(18;22)却多见于CLL。尽管如此,t(18;22)(q21;q11)在CLL中总体发生率非常低。DICKER等[6]报道的132例CLL患者中仅1例为t(18;22)(q21;q11),发生率为0.76%。而本中心从2010年1月至今明确诊断为CLL的患者共1 035例,其中t(18;22)(q21;q11)仅3例,发生率约为0.29%,略低于文献报道。根据文献报道[9],CLL中累及IGH的重排核型常常伴有+12,本组病例中例1所分析异常细胞均为t(18;22)同时伴有+12,例2中3个细胞t(18;22)为唯一异常,例3中5个细胞t(18;22)为唯一异常,2个细胞同时伴有13q–,表明该异常既可以作为唯一异常,又可以和CLL中的其它常见异常伴随出现。
细胞免疫分型是CLL诊断最为重要的指标。一般而言,典型的CLL细胞为CD5+、CD10–,此外还表达其它相关指标,包括CD19、CD20、CD23、CD38、FMC7、κ、λ等。文献报道的23例伴有t(18;22)(q21;q11)的CLL病例中,14例患者具有较为详尽的细胞免疫表型检测结果,均为CD5+、CD10–;7例共表达CD19、CD20、CD23;1例仅表达CD19;2例CD19、CD23共表达;2例仅表达CD20;1例仅表达CD23;1例CD20和CD23共表达。另外,14例病例中,2例表达CD38;4例表达或弱表达FMC7[6,7,10-17]。本文3例CLL患者与文献中报道的伴有t(18;22)(q21;q11)的CLL类似,细胞免疫分型也均为CD5+、CD10–、CD19+、CD20+或±,与其它CLL相比,伴有t(18;22)(q21;q11)的CLL免疫表型无明显改变。
研究发现,与t(14;18)相比,t(18;22)累及2个基因的断裂点也不同。t(14;18)中,BCL-2基因大多为主要(mbr)和次要(mcr)断裂位点,位于BCL-2的3'端(C端)或近端30kb处,而IGH断裂点位于5'端(N端),发生易位后,BCL-2的3'端与IGH的5'端并置;而t(18;22)中,BCL-2的断裂点均位于5'端(N端),又称为变异簇区域(VCR),IGL断裂点位于3'端(C端),易位使得BCL-2的5'端与IGL的3'端并置[18],使得BCL-2基因过表达,导致恶性肿瘤的发生发展。本文3例患者均由FISH证实累及BCL-2基因的断裂,例1患者进行了全基因组测序,证实t(18;22)易位累及18q21的BCL-2基因,且断裂位点位于该基因的5'UTR区域,而22q11累及IGLL5基因,断裂点位于该基因3'端的内含子,两者发生了并置。有文献报道,t(14;18)的变异易位患者,其BCL-2基因表达量甚至高于t(14;18)者,因无t(14;18)易位患者标本,故未能对3例患者进行BCL-2表达量的验证。
根据文献报道,伴有IGH易位的CLL患者其首次治疗间隔时间(Time to first treatment,TFT)较低危组患者缩短,为预后中等或高危[19]。另有文献认为,CLL中IGH与不同的对手基因易位,预后不同,t(14;18)/BCL-2-IGH易位者预后良好,而其它如t(14;19)/BCL-3-IGH易位者则与高危组CLL患者相似,预后不良[20]。t(18;22)/BCL-2-IGL为t(14;18)的变异易位,伴有该异常的病例是否具有与t(14;18)异常的CLL一样的预后尚未可知。本文中例1和例2患者在初诊时染色体结果均为t(18;22)异常,例3患者初诊核型正常,治疗后复查为t(18;22)异常核型,但也不能排除初诊时的漏检,因无标本,故未能进行BCL-2重排FISH检测。3例患者均在初诊时即被诊断为Rai III期和Binet C期,随即进行了治疗,表明该类患者TFT时间非常短。例1和例3在初诊时即进行了CLL组套FISH检测,例1为唯一+12,例3为唯一13q–,且伴有IGHV突变,2例患者FISH结果均未检测到11q–和17p–等高危因子,根据目前的CLL预后评估体系判断,患者分别为中危和低危组。但例1和例3患者治疗过程中始终未能缓解,例2患者经过短暂的缓解(5个月)后复发,目前3例患者均存活,随访时间分别为26、28、126个月。尽管t(18;22)异常的CLL病例数较少,但从本组病例可以看出,伴有t(18;22)异常的CLL可能具有难治性和易复发等特点。由于例1和例2随访时间较短,t(18;22)异常对生存期是否有影响尚不清楚。
综上所述,t(18;22)(q21;q11)作为t(14;18)(q32;q21)的变异易位,与t(14;18)异常具有不同的分子结构。其发生率非常低,多见于CLL,可能具有难治性和易复发等特点。因病例数太少,需要积累更多病例进行更加深入的研究才能完全阐明伴有该异常的CLL的分子生物学特征。另外,本组病例也表明,对CLL患者进行DSP30+IL-2刺激后再检测染色体非常重要,有可能发现FISH检测结果以外的异常信息。
利益冲突所有作者均声明不存在利益冲突

