冰冻保存PRP对IL-1β诱导的软骨细胞炎症反应的影响
杨晓亚 高裕华 刘素蕊 李烛
PRP是自体抗凝血经离心、分离制备的血小板浓缩物,其中高浓度的血小板活化后可释放大量的生长因子,能有效促进组织愈合、细胞再生。自体PRP在临床应用广泛:可用于治疗骨性关节炎、肌腱损伤、韧带损伤;牙种植、牙槽骨重建;还可用于慢性难愈合创面如糖尿病足、烧烫伤的治疗[1-4]。血小板的常规保存时间最长不超过5天,PRP使用指南、制备技术手册都明确指出,PRP的制备需要“使用前床边制备,制备后即刻使用”[5-7]。自体PRP治疗的单次用量不大,如关节腔内PRP注射治疗膝骨关节炎,推荐注射剂量3~8 mL[7,8];自体PRP凝胶治疗糖尿病足溃疡单次用量5~10 mL[3,9]。对于多数疾病,自体PRP治疗需多个疗程。因此,几十毫升新鲜全血制备的PRP只能满足单次治疗,临床进行自体PRP治疗需要频繁采血,对患者及医护人员来说都有一定的负担。而用全自动血液成分分离机单采血小板,单次最多可采250 mL浓缩血小板,能满足多次PRP治疗所需。也有单位应用冷冻保存的PRP用于后续治疗,本研究以体外骨关节炎模型着手,旨在探讨不同冻存方法对PRP发挥生物学效应的影响,为合理利用自体PRP技术,保证临床治疗效果提供实验依据。
材料与方法
1 主要设备及试剂 全自动血液成分分离机(四川南格尔XCF3000)及其配套管路。人血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、人转化生长因子β(Transforming Growth Factor-β,TGF-β)、胰岛素样生长因子1(Insulin like Growth Factor,IGF-1)及人IL-6 ELISA检测试剂盒购自浙江联科生物有限公司,人血小板衍生生长因子AB(Platelet Derived Growth Factor AB,PDGF-AB)ELISA检测试剂盒购自美国Raybiotech公司。人SW1353细胞株(人软骨肉瘤细胞)购自中国科学院上海生命科学研究院细胞资源中心。高糖DMEM培养基及胎牛血清购自Gibco公司,活细胞计数试剂盒(CCK-8试剂盒)购自同仁化学研究所。DMSO购自美国sigma公司。
2 PRP制备和激活 本实验所用的PRP为全自动血液成分分离机采集的健康献血者O型血小板。采集后将5人份血小板混合均匀,调整血小板计数至1 000×109/L,无菌条件下分装至血小板保存袋中,采用不同温度及方式冻存。冻存3个月后取出PRP,37℃水浴化冻,用相当于PRP体积10%的CaCl2注射液激活,待液体成胶冻状以后,12 000 r/min,4℃离心5 min,将收集到的上清液样本储存于–80℃超低温冰箱中。
3 实验分组 PRP采用4种不同方式冻存3个月,分别记为A、B、C、D组。A组:无菌条件下向PRP中加入5% DMSO,混合均匀后–80℃冻存;B组:无菌条件下向PRP中加入5% DMSO,混合均匀后–20℃冻存;C组:–80℃直接冻存;D组:–20℃直接冻存。3个月后招募5名献血者捐献单采血小板,作为新鲜PRP来源,此组标记为E组。
4 PRP中生长因子含量测定 全部样本收集完成后,用ELISA方法检测样品中生长因子含量,包括VEGF、PDGF-AB和IGF-1。操作过程严格按照试剂盒说明书进行。
5 SW1353细胞培养及软骨细胞炎症模型的制备SW1353细胞使用DMEM培养基(10%胎牛血清),在37℃、5% CO2、饱和湿度培养箱中培养。当细胞铺满瓶底80%时进行传代。取对数生长期的SW1353细胞,加入含IL-1β(10 ng/mL)培养基处理24 h,诱导炎症反应制备软骨细胞炎症模型。而后弃去培养基,加入含有10% PRP的DMEM继续培养(对照组用完全培养基培养)。实验分组情况:A~E组为不同冻存方式的PRP处理组;对照组为常规完全培养基培养的SW1353细胞;IL-1β组为含IL-1β(10 ng/mL)的培养基培养的SW1353细胞。
6 CCK-8法检测SW1353细胞增殖活性 将SW1353细胞以1×104/孔的浓度加入96孔培养板中,IL-1β(10 ng/mL)作用24 h诱导炎症反应,之后用含不同储存方式制备的10% PRP的DMEM继续培养,对照组用完全培养基培养。24 h后,利用CCK-8试剂检测细胞活性,酶标仪检测450 nm处的吸光度值(A450nm)。
7 检测软骨细胞炎症指标 收集上述各实验组SW1 353细胞培养上清液,ELISA法检测炎症因子IL-6含量,实验过程按照试剂盒说明书操作。
8 统计学分析 采用Excel 2013软件整理数据,采用SPSS 13.0分析试验数据。计量结果以均值±标准差()表示,多组间比较采用方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 不同保存条件对PRP凝胶中生长因子含量的影响ELISA方法检测PRP凝胶上清液中三种生长因子含量,结果见表1。各冷冻保存组与新鲜PRP组相比,凝胶上清液中PDGF-AB含量无显著差异,但对VEGF和IGF-1含量有一定影响。与新鲜PRP组相比,各冷冻保存组凝胶上清液中VEGF含量均不同程度减少(P值均<0.05);A组PRP凝胶上清液中IGF-1含量比E组略降,但差异不显著(P=0.066)。B、C、D组与E组相比,IGF-1含量均显著减少(三组P值均<0.05)。
表1 PRP凝胶上清液中PDGF-AB、VEGF、IGF-1含量(,pg/mL)
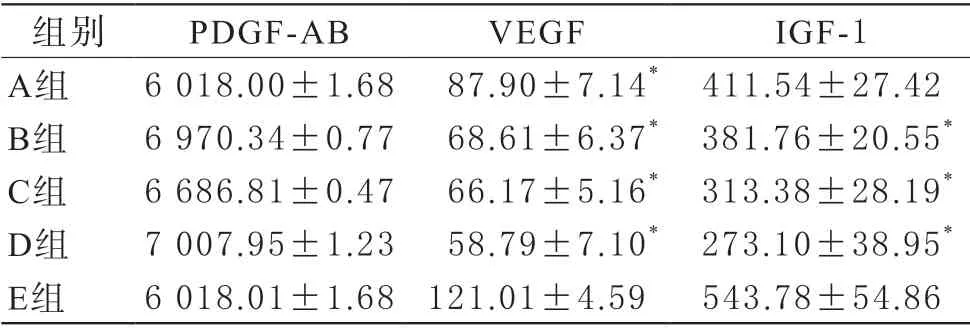
表1 PRP凝胶上清液中PDGF-AB、VEGF、IGF-1含量(,pg/mL)
注:A组:DMSO–80℃冻存组,B组:DMSO–20℃冻存组,C组:–80℃冻存组,D组:–20℃冻存组,E组:新鲜PRP组。*与E组相比较,P<0.05
2 PRP对SW1353软骨炎症模型细胞增殖的影响IL-1β作用24 h后,与未加IL-1β的对照组相比,SW 1353软骨细胞增殖受到抑制,存活率为原来的87%(见表2)。加入新鲜PRP作用24 h后,与未加PRP的IL-1β组相比,SW1353细胞的增殖抑制缓解(P<0.05)。A组PRP与E组相比,对软骨炎症模型细胞增殖促进作用无显著差异(P>0.05)。与未加PRP的IL-1β组相比,加入B、C、D组PRP对IL-1β诱导的软骨细胞增殖抑制均没有缓解作用(P值分别为0.145、0.215、0.280);这三组细胞的增殖显著低于E组PRP(P均<0.05)。见表2。

表2 SW1353细胞增殖活性检测
3 PRP对软骨炎症模型细胞炎症因子IL-6表达的影响正常培养的SW1353细胞不分泌炎症细胞因子IL-6,加入IL-1β(10 ng/mL)24 h后,SW1353细胞大量分泌IL-6。加入E组PRP后,SW1353细胞IL-6的分泌受到显著抑制,与未加PRP的IL-1β组相比差异显著(P<0.05),表明新鲜制备的PRP能够使软骨细胞的炎症反应得到缓解。其余各组冻存PRP在减少软骨细胞炎症因子IL-6分泌方面都能起到与新鲜PRP相当的效果,各组之间无显著性差异(P均>0.05)。见表3。
表3 SW1353细胞培养上清液中炎性细胞因子IL-6浓度(,pg/mL)
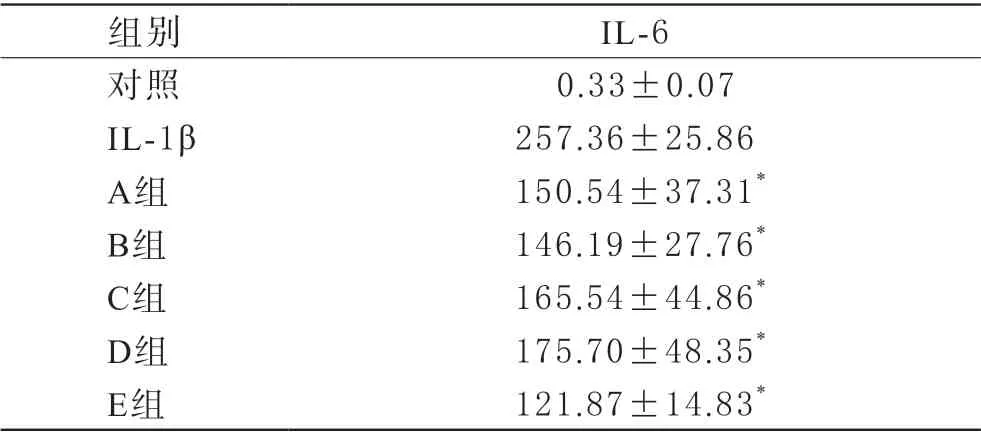
表3 SW1353细胞培养上清液中炎性细胞因子IL-6浓度(,pg/mL)
注:A组:DMSO–80℃冻存组,B组:DMSO–20℃冻存组,C组:–80℃冻存组,D组:–20℃冻存组,E组:新鲜PRP组。*与IL-1β组相比较,P<0.05
讨 论
本文主要探讨PRP冷冻保存后生物活性的变化。实验设置了四种冻存条件,分别是–20℃、–80℃直接冻存以及加入DMSO后–20℃、–80℃冻存。临床上PRP治疗往往持续2~3个月[10],所以我们将冻存持续时间设为3个月。由于不同捐献者的血小板存在个体差异[11],因此,我们选用不同献血者血小板混合物作为PRP来源,避免个体差异对实验结果造成影响。PRP的生物学效应主要依赖于血小板活化后释放的大量细胞因子,包括PDGF、TGF-β、VEGF、IGF-1、FGF等[12]。这些活性蛋白能促进细胞增殖,抑制细胞凋亡,并促进细胞外基质分泌。活化血小板分泌的细胞因子既能发挥各自的生物学效应,各细胞因子间还有协同作用[13]。PRP中生长因子的含量是评估其促受损组织修复的重要指标,选取三种细胞因子PDGF、VEGF和IGF-1进行检测,发现仅PDGF-AB含量不受冻存的影响,VEGF和IGF-1含量都明显减少,而DMSO保护剂–80℃冻存组IGF-1的含量和新鲜PRP组相当。与MUBIN HOSNUTER[14]和ALICE ROFFI[15]等的实验结果相似,即经冷冻之后,PRP激活释放的某些生长因子低于新鲜PRP。血小板活化后释放的细胞因子绝大部分是预先合成的[16],而细胞因子多为多肽类物质,理论上冷冻保存不会对其含量造成显著影响,分析冻存影响PRP释放生长因子的原因可能是冰冻对血小板造成的储存损伤。在血小板储存过程中,聚集功能降低,对多种激活剂的反应能力减弱[17],冰冻保存后的血小板对激活剂CaCl2的反应性降低,导致储存于α颗粒中的细胞因子不能完全释放出来;这也能解释加冷冻保护剂DMSO后,–80℃冻存的PRP上清液中IGF-1的含量未受影响。
我们用SW1353细胞制备软骨细胞炎症模型,验证PRP冰冻保存后的抗炎效应。模型建成后,软骨细胞存活率变低,并开始分泌炎症细胞因子IL-6。新鲜PRP能够缓解软骨炎症细胞增殖抑制,并降低IL-6的分泌水平。冰冻保存之后,只有加DMSO保护剂–80℃冻存的PRP在缓解软骨炎症细胞增殖抑制方面起到和新鲜PRP相似的效果,另外3组PRP对软骨炎症细胞增殖抑制没有缓解作用。但是不管何种条件冻存,是否加冻存保护剂,冻存3个月之后的PRP都能有效抑制软骨细胞IL-6的分泌。以上结果表明,冻存之后PRP的生物学活性受到一定的影响,PRP凝胶上清液中部分效应细胞因子含量减少,影响了其对炎症软骨细胞增殖的促进作用,DMSO作为冻存保护剂,在–80℃冻存过程中能保护血小板活性,因而冻存之后的PRP仍能有效缓解软骨炎症细胞增殖抑制。我们发现,冰冻保存并没有影响PRP对软骨炎症细胞的抗炎效果,四组冻存后的PRP在体外都具有有效对抗软骨细胞炎症的作用。这可能是由于PRP活化后,上清液中活性因子的种类复杂,除细胞因子之外,还有其他生物活性成分如血浆蛋白等,冰冻保存虽然影响了部分细胞因子的浓度,但是PRP对抗软骨炎症的功能并无影响。
本研究检测了四种冻存方式对PRP生物学效应的影响,结果显示,加DMSO保护剂–80℃冻存的PRP活性上最接近新鲜PRP。在实际应用中,–20℃冻存是最容易实现的冻存方法,–80℃深低温需要专用设备才能达到,一般临床科室并不具备。冰冻保护剂是额外添加的物质,虽然DMSO在使用剂量范围内被证明是安全的,但是它毕竟是一种生物毒性物质,可能会增加患者使用后不良副作用的风险[18]。我们的结果显示不加冰冻保护剂–20℃直接冻存,虽然对PRP的细胞因子浓度以及促软骨细胞增殖方面有一定影响,但是其在体外仍具备抑制软骨细胞炎症的作用。考虑到可操作性及最大限度避免副作用,临床可以采用–20℃直接冰冻保存PRP。本研究样本量有限,所采用的实验方法如ELISA有一定的误差,因此本研究的结果尚需要进一步的后续实验来验证。
利益冲突所有作者均声明不存在利益冲突

