建始地区米酒曲细菌和真菌多样性研究
向凡舒,朱媛媛,邓 风,钟小丹,张振东,郭 壮,*
(1.湖北文理学院食品科学技术学院,鄂西北传统发酵食品研究所,湖北襄阳441053;2.湖北米婆婆生物科技股份有限公司,湖北孝感432003)
米酒作为我国独具特色的传统发酵食品,因其口感温润、酒香柔和而深受消费者的青睐,我国湖北、四川和广西等地区的居民均具有食用米酒的习俗[1]。米酒品质的好坏与所用米酒曲中微生物的构成息息相关,因而自古就有“曲,酒之骨”的说法[2]。近年来,我国学者对米酒曲微生物群系开展了系列研究工作。郝莹[3]和蔡海莺等[4]采用纯培养技术,发现霉菌和酵母菌为陕北和苏州等地区米酒曲中的优势真菌;本研究团队采用变性凝胶梯度电泳和纯培养技术对中国地理标识产品——孝感凤窝酒曲微生物多样性进行了解析,发现乳杆菌属和魏斯氏菌属为其优势细菌属[5-6]。
以MiSeq为代表的第二代高通量测序技术,具有检测数据量大和准确快速的特点[7],在环境生物学[8]、食品微生物学[9]和临床分子学[10]等领域均有广泛的应用。宁亚丽采用该技术对朝鲜族传统米酒曲中微生物多样性进行了解析[11],结果发现酿酒酵母和伯顿丝孢毕赤酵母为其优势真菌属,而乳杆菌属和肠杆菌属为其优势细菌属;杨春敏对海南山兰米酒曲微生物多样性进行了解析[12],结果表明根霉属是酒曲中优势真菌属,而片球菌为优势细菌属;本研究团队对孝感凤窝酒曲研究发现淀粉霉属和复膜孢酵母属为其优势真菌属[13],而芽孢杆菌属和乳酸杆菌属为其优势细菌属[14]。由此可见,因制作原料、工艺和地域环境等因素的影响,不同地区制作的米酒曲其蕴含的微生物类群也各不相同。位于鄂西地区的恩施土家族苗族自治州建始县属湿润型山地气候,境内富含硒等元素,当地居民亦有自制米酒曲发酵米酒的习俗,独特的生态环境可能赋予了米酒曲特有的微生物类群,然而目前关于建始县乃至整个鄂西地区米酒曲微生物多样性研究的报道尚少。
本研究以建始地区米酒曲为研究对象,在采用第二代MiSeq高通量测序技术对其细菌和真菌多样性进行解析的基础上,进一步探讨了各微生物类群间的相关性,同时采用纯培养技术对其蕴含的乳酸菌和酵母菌菌株分离鉴定,以期为后续米酒食用品质的提升提供一定的理论参考,同时为具有优良发酵特性米酒生产用菌株的筛选提供菌株支持。
1 材料与方法
1.1 材料与仪器
米酒曲 采自湖北省恩施土家族苗族自治州建始县(E109°32'~110°12',N30°32'~30°54');MRS、PDA培养基 青岛海博生物技术有限公司;Axygen清洁试剂盒 康宁生命科学吴江有限公司;QIAGEN DNeasymericon Food Kit DNA基因组提取试剂盒 德国QIAGEN公司;5×TransStartTM FastPfu Buffer、dNTPs Mix、FastPfu Fly DNA Polymerase 北京全式金生物技术有限公司;引物对338F/806R、27F/1495R、M13F(-47)/M13R(-48)、SSU0817F/SSU1196R、NS1/NL4 天一辉远(武汉)生物科技有限公司;Escherichia coli top10 湖北文理学院鄂西北传统发酵食品研究所自制。
ND-2000C微量紫外分光光度计 美国Nano Drop公司;DG250型厌氧工作站 英国Don Whitley公司;PTC-100型PCR仪 美国ABI公司;Fluor Chem FC3型化学发光凝胶成像系统 美国Protein Simple公司;ECLIPSE CI生物显微镜 日本Nikon公司;Illumina MiSeq高通量测序平台 美国Illumina公司。
1.2 实验方法
1.2.1 米酒曲样品的采集 于2018年12月下旬从湖北省建始县陇里集镇菜市场采集到4份米酒曲样品,编号为JS1、JS2、JS3和JS4,所有酒曲均在建始县当地制作并销售。
1.2.2 米酒曲微生物基因组DNA提取、PCR扩增和高通量测序 基因组DNA提取:将米酒曲样品用灭菌后的研钵磨成粉末状,每份样品各取2 g,按照DNA基因组提取试剂盒使用说明提取样品总DNA。
PCR扩增:将成对的核苷酸标签(barcode)加入引物对338F/806R中用以区分和归并每个样品的序列,参照文献[15]中的方法对细菌16S rRNA V3-V4区PCR进行扩增,用1.0%琼脂糖凝胶电泳检测;参照王玉荣的方法对真菌18SrRNA V4-V5区PCR进行扩增[16],并使用1.5%的琼脂糖凝胶对其进行电泳检测。
高通量测序:将检测合格的扩增产物送至上海美吉生物医药科技有限公司进行高通量测序。
1.2.3 高通量测序数据的质控及生物信息学分析 参照文献[15]中的方法对下机序列进行拼接和质控,使用QIIME(v1.70)平台对质控后的有效序列进行微生物多样性评价。经97%相似性序列划分后构建分类操作单元矩阵(operational taxonomic units,OTU),从每个OTU中选择1条代表性序列与Greengenes和RDP数据库进行同源性比对并标注其分类学地位。
1.2.4 米酒曲中乳酸菌和酵母菌的分离鉴定 乳酸菌的分离与鉴定:采用倍比稀释涂布平板法,将米酒曲粉末稀释至10-3~10-5梯度,各吸取100μL稀释液涂布于含1.0%CaCO3的MRS固体培养基中,37℃厌氧培养48 h后,挑取含有透明圈的单菌落划线3次以达到纯化目的,同时对其进行过氧化氢酶实验和革兰氏染色,将纯化的过氧化氢酶实验为阴性,且革兰氏染色为阳性的菌株使用30%的甘油保藏至-80℃。参照尚雪娇等[17]的方法进行疑似乳酸菌菌株DNA提取、PCR扩增、连接转化和测序,将测序返回的菌株序列在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)进行比对。
酵母菌的分离与鉴定:倍比稀释方法与乳酸菌相同,选择PDA固体培养基,28℃培养3~5 d后,挑取单菌落进行纯化,将纯化后的疑似酵母菌菌株使用30%的甘油保藏至-80℃。参照王玉荣等[16]的方法对疑似酵母菌菌株进行后续鉴定测序,菌株序列同源性比对方法同乳酸菌。
1.3 数据处理
利用R软件(v3.6.2)将测序得到的数据进行作图分析,利用MEGA 7.0软件构建系统发育树,同时采用SAS 9.0软件计算米酒曲中细菌属与真菌属间的相关性系数及显著值。

图1 基于门(A)和属(B)水平相对含量>1.0%细菌的构成Fig.1 The diversity of bacteria with relative abundance more than 1.0%at phylum(A)and genus levers(B)
2 结果与分析
2.1 基于高通量测序技术建始米酒曲中细菌多样性分析
通过MiSeq高通量测序技术,4个米酒曲样品共产生155213条16SrDNA序列,平均每个样品38803条,其中JS1、JS2、JS3和JS4的序列数分别为40509条、51134条、29956条和33614条;经OTU划分后产生4125个OTU,其中JS1、JS2、JS3和JS4的OTU数分别为1389、1478、1387和753,平均每个样品含有个1252个OTU。从每个OTU中挑选1个代表性序列进行比对,进而解析细菌多样性,基于门和属水平相对含量>1.0%细菌的构成如图1所示。
由图1(A)可知,米酒曲中有2个平均相对含量>1.0%的细菌门,分别是Proteobacteria(变形菌门,59.64%)和Firmicutes(厚 壁 菌 门,34.98%),其 中Proteobacteria在样品JS2、JS3和JS4中相对含量最高,分别为84.03%、74.88%和75.54%,而Firmicutes在样品JS1中含量最高,为86.17%。由图1(B)可知,米酒曲中平均相对含量>1.0%的细菌属共有8个,其中隶属于Proteobacteria的有Pseudomonas(假单 胞 菌 属,40.10%)、Enterobacter(肠 杆 菌 属,3.50%)、Pantoea(泛菌属,2.86%)和Klebsiella(克雷伯菌属,2.29%);隶属于Firmicutes的有Pediococcus(片 球 菌 属,14.41%)、Weissella(魏 斯 氏 菌 属,9.62%)、Bacillus(芽孢杆菌属,5.44%)和Lactococcus(乳球菌属,2.18%)。作为食品工业中最常使用的菌株,乳酸菌具有提升产品品质和赋予产品特殊功效的作用[18],本研究中隶属于乳酸菌的Pediococcus、Weissella和Lactococcus等3个属的累计相对含量达到26.21%,由此可见,建始地区米酒曲中蕴含了丰富的乳酸菌菌种资源,本研究团队前期对孝感凤窝酒曲的研究亦发现了同样的结论[14],因而后续研究中积极开展米酒曲源乳酸菌菌株的收集保藏工作具有积极的意义。值得一提的是,Pseudomonas在所有米酒曲中均存在且相对含量最高,有报道指出隶属于该属的某些种具有一定的条件致病性,例如,P.aeruginosa(绿脓杆菌)可导致甲沟炎的发生[19]。虽然Enterobacter、Pantoea和Klebsiella在米酒曲中的相对含量远低于Pseudomonas,但亦有报道指出E.aerogenes(产气肠杆菌)[20]、P.agglomerans(成团泛菌)[21]和K.pneumoniae(肺炎克雷伯菌)[22]对抗生素均具有一定的抗性并可导致炎症的发生。米酒曲中条件致病菌相对较多的原因可能与其制作环境相对开放有关,因而后续着力改善生产环境进而提升产品的食用安全品质是极为必要的。
本研究进一步在OTU水平上对米酒曲的细菌多样性进行了解析,共发现4118个OTU,且76个为核心OTU在所有样品中均存在,其中平均相对含量大于1.0%的核心OTU如图2所示。
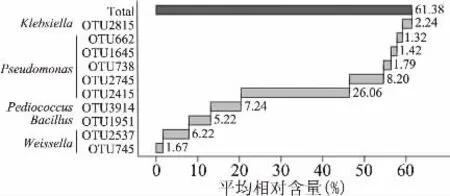
图2 相对含量大于1.0%核心细菌类群Fig.2 The core bacterial groups with relative abundance more than 1.0%
由图2可知,共有10个平均相对含量>1.0%的核心OTU,其中各有5个隶属于Pseudomonas、1个隶属于Klebsiella,累计相对含量分别达到38.79%和2.24%;各有2个隶属于Weissella、1个隶属于Pediococcus,累计相对含量分别达到7.89%和7.24%;亦有1个隶属于Bacillus,平均相对含量为5.22%。值得一提的是,10个OTU的累计含量高达61.38%,因而建始地区米酒曲中共有大量的细菌核心菌群。
2.2 基于高通量测序技术建始米酒曲中真菌多样性分析
除细菌外,米酒曲中部分真菌具有较高的乙醇耐受性[23]和产香特性[24],对后续米酒品质的形成具有决定性的作用,例如从米酒曲中分离出的M.indicus(印度毛霉)能使米酒主体香气中的异戊醇、乙酸苯乙酯和棕榈酸乙酯等含量显著提高[24],因而本研究进一步对米酒曲中真菌多样性进行了解析。MiSeq测序结果显示4个米酒曲样品共产生了142018条18S rDNA序列,平均每个样品35504条,其中JS1、JS2、JS3和JS4的序列数分别为35201条、35320条、38870条和32627条;经97%相似度划分后产生4125个OTU,其中JS1、JS2、JS3和JS4的OTU数分别为282、361、371和221,平均每个样品含有个309个OTU。经序列比对后,基于门和属水平相对含量>1.0%的真菌构成如图3所示。
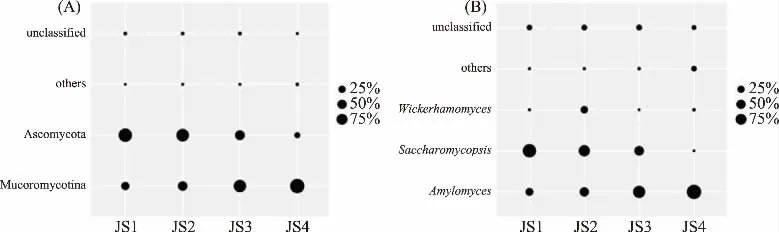
图3 基于门(A)和属(B)水平相对含量>1.0%真菌的构成Fig.3 The diversity of fungus with relative abundance more than 1.0%at phylum(A)and genus levers(B)
由图3(A)可知,米酒曲中Mucoromycotina(毛霉亚门)和Ascomycota(子囊菌门)2个真菌门平均相对含量大于>1.0%,分别为59.64%和34.98%。从图3(B)可知,平均相对含量>1.0%的真菌属共有3个,其中隶属于Mucoromycotina的为Amylomyces(淀粉霉属)和Saccharomycopsis(复膜孢酵母属),隶属于Ascomycota的为Wickerhamomyces(威克汉姆酵母属),平均相对含量为49.97%、39.47%和3.95%。
四个米酒曲样品共划分了1083个OTU,其中包含18个核心OTU,平均相对含量>1.0%的核心OTU仅有4个,如图4所示。
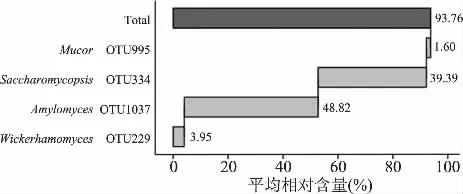
图4 相对含量大于1.0%核心真菌类群Fig.4 The core fungal groups with relative abundance more than 1.0%
由 图4可 知,OTU995、OTU334、OTU1037和OTU229,分别隶属于Mucor(毛霉属)、Saccharomycopsis、Amylomyces和Wickerhamomyces,平均相对含量分别为1.60%、39.39%、48.82%和3.95%。虽然仅有4个平均相对含量>1.0%的核心OTU存在所有样品中,但其累计含量高达93.76%,因而建始地区米酒曲中亦共有大量的真菌核心菌群。
2.3 建始米酒曲中乳酸菌的分离鉴定
高通量测序结果表明,建始地区米酒曲中蕴含了丰富的乳酸菌菌种资源,本研究进一步对乳酸菌菌株进行了分离、纯化和鉴定,从4个米酒曲中共分离出10株乳酸菌,其系统发育树如图5所示。
由图5可知,在10株乳酸菌中4株被鉴定为P.pentosaceus(戊糖片球菌),1株被鉴定为P.acidilactici(乳酸片球菌),2株被鉴定为L.brevis(短乳杆菌),3株被鉴定为E.faecium(屎肠球菌)。由此可见,P.pentosaceus占分离株的40%,为建始地区米酒曲中的优势乳酸菌。然而张振东等[5]却从采集自孝感、随州、玉林和苏州等地区的米酒曲中分离出了较多的E.faecium分离株,可见地域差异使得米酒曲中蕴含的细菌类群也存在着较大的不同。

图5 乳酸菌分离株系统发育树Fig.5 Phylogenetic tree oflactic acid bacteria isolates
2.4 建始米酒曲中酵母菌的分离鉴定
本研究亦采用传统微生物学的方法对米酒曲中酵母菌进行了分离,并对分离株18S rDNA序列进行扩增和鉴定,其结果如图6所示。

图6 酵母菌分离株系统发育树Fig.6 Phylogenetic tree of yeast isolates
由图6可知,从4个建始米酒曲中共分离出10株酵母菌,其中菌株YJS4-1和YJS4-4被鉴定为S.cerevisiae(酿酒酵母),菌株YJS1-1被鉴定为Wanomalus(海洋嗜杀酵母),而其余7株酵母菌都被鉴定为S.fibuligera(扣囊复膜酵母)。由此可见,S.fibuligera占分离株的70%,为建始地区米酒曲中的优势酵母。近年来,越来越多的研究表明S.fibuligera存在于各种酒曲中,具有产β-葡萄糖苷酶、酸性蛋白酶和产淀粉酶的特性[25],此外亦具有产香产酯的功效[26],因而在后续研究中进行具有高产酶活性和优良发酵特性S.fibuligera菌株的筛选,对米酒产品品质的提升具有积极的意义。
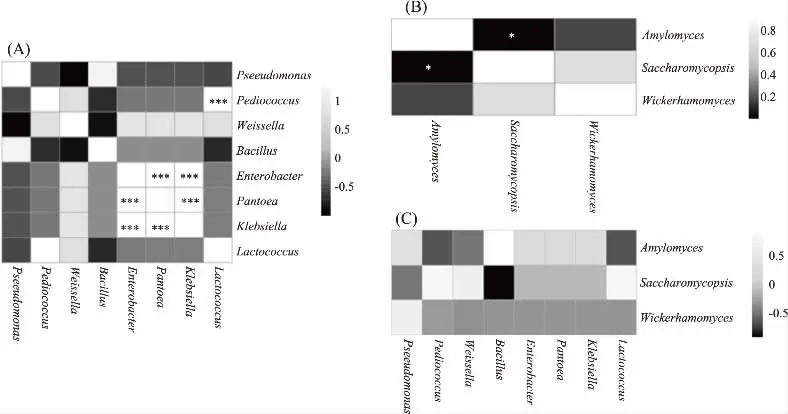
图7 相对含量大于1.0%细菌(A)、真菌(B)及细菌和真菌(C)相关系数的热图Fig.7 The heatmap of correlation coefficient among bacteria(A),fungus(B)and between bacteria and fungus(C)
2.5 细菌和真菌相对含量>1.0%菌属相关性分析
在对米酒曲细菌和真菌多样性进行解析的基础上,本研究对其相对含量>1.0%的菌属相关性进行了分析,结果如图7所示。
由图7(A)可知,Lactococcus和Pediococcus呈现极显著正相关(R=0.999,P<0.001);Klebsiella与Enterobacter和Pantoea均呈现极显著正相关(P<0.001),相关系数均为1.0;Enterobacter与Pantoea亦呈现极显著正相关(P<0.001),相关系数亦为1.0。由此可见,米酒曲中隶属于乳酸菌的菌属之间可能呈现一定的共生关系,而这种现象在Klebsiella、Pantoea和Enterobacter等条件致病菌之间亦可能存在。由图7(B)可知,Saccharomycopsis和Amylomyces呈现显著负相关(R=-0.976,P=0.023),而由图7(C)可知细菌和真菌之间无显著相关性(P>0.05)。
3 结论
本研究以建始地区米酒曲为研究对象,采用MiSeq高通量测序技术对其微生物多样性进行了解析,结果发现隶属于Proteobacteria的Pseudomonas、Enterobacter、Pantoea和Klebsiella及隶属于Firmicutes的Pediococcus、Weissella、Bacillus和Lactococcus为其主要细菌类群,隶属于Mucoromycotina的Amylomyces和 Saccharomycopsis及隶属于 Ascomycota的Wickerhamomyces为主要真菌类群。通过纯培养技术进一步发现,米酒曲中乳酸菌和酵母菌的菌群主要为P.pentosaceus和S.fibuligera。由此可见,建始地区米酒曲含有大量的共生菌群,其在含有丰富乳酸菌和酵母菌资源的同时亦存在一定的条件致病菌,因而后续研究中开展米酒曲源有益菌株的收集保藏对米酒产业的发展具有积极的推动作用。

