玉蜀黍不同部位提取物对α-葡萄糖苷酶和α-淀粉酶抑制作用
杨小倩,孙佳明,吴 楠,高 旭,郅 慧,吴 淇,张 辉,*,李晶峰,*
(1.长春中医药大学吉林省人参科学研究院,吉林长春130117;2.吉林鑫水科技开发有限公司,吉林长春130000)
糖尿病是由多种原因引起的代谢紊乱性疾病,其中Ⅱ型糖尿病患者的占比已达到90%以上[1]。高血糖是Ⅱ型糖尿病的主要症状,长期高血糖会导致多种慢性并发症,是糖尿病患者死亡的主要原因[2]。在Ⅱ型糖尿病患者中,控制餐后血糖水平是治疗糖尿病的有效手段[3]。α-葡萄糖苷酶和α-淀粉酶是碳水化合物消化为葡萄糖的关键酶,在酶作用下释放的葡萄糖经小肠进入血液从而升高血糖,临床上常使用α-葡萄糖苷酶抑制剂和α-淀粉酶的抑制剂对高血糖进行治疗[4-6],但目前常用α-葡萄糖苷酶抑制剂和α-淀粉酶抑制剂多为西药,存在较多不良反应,也不能有效地控制并发症,而天然植物降糖有效成分都具有多途径、多靶点、多向性的药理特点,不仅可降低血糖[7-9],还可避免药物对人体的副作用[10]。据报道玉米须多糖[11]可降低小鼠空腹血糖,促进肝糖元的合成,从而减轻造模药物及高血糖引起的对糖尿病小鼠的肝损害;番石榴叶总黄酮[12]可通过增强肝脏葡萄糖激酶、葡萄糖转运蛋白-2、胰岛素生长因子-1、胰岛素受体底物-1等的表达而降低链脲佐菌素糖尿病小鼠血糖水平。
玉蜀黍(Maize)为禾本科植物,据《本草纲目》记载:玉蜀黍甘,平,无毒。玉蜀黍含有大量维生素E和黄酮,经常食用玉蜀黍产品不仅增强人的体质,延缓人体衰老,还对心血管疾病的治疗有辅助作用[13]。中国是玉蜀黍生产和消费的大国,玉蜀黍采摘后,玉蜀黍须、秸秆等大部分被直接当作废物处理,附加值低,而黄酮类化合物作为玉蜀黍中主要活性成分之一,具有抗糖尿病、抗肥胖和抗氧化作用等多种药理活性[14-16]。李萍等[17]研究发现,玉米须黄酮提取物可抑制炎性细胞因子白细胞介素-1β的表达和降低尿酸,而缓解急性痛风性关节炎。苗明三等[18]发现玉米须总皂苷不仅降低由链脲佐菌素致糖尿病大鼠血糖,还可对抗造模大鼠胰岛细胞中β细胞、胸腺萎缩萎缩,并减轻造模所致的肾脏损伤。目前关于玉蜀黍的研究主要集中于玉蜀黍须对其化学成分、降糖、抗氧化等活性的研究,而玉蜀黍不同部位研究相对较少。本实验以玉蜀黍不同部位即玉蜀黍须、秸秆皮、秸秆芯作为研究对象,以α-葡萄糖苷酶和α-淀粉酶为靶点,筛选出具有降糖作用的活性成分群,为开发新型降糖药提供新思路。
1 材料与方法
1.1 材料与仪器
玉蜀黍 采集于吉林省松原市,经长春中医药大学张辉教授鉴定确认为禾木科、玉蜀黍属植物玉蜀黍,取玉蜀黎须、秸秆皮、秸秆芯三个部位阴干,粉碎后过3号筛,密封备用;牛血清白蛋白、芦丁标准品、齐墩果酸标准品 纯度均≥99.5%,中国生物制品检定所;4-硝基苯基-α-D-吡喃葡萄糖苷(PNPG)(纯度≥98%)、α-葡萄糖苷酶(100 U/mg)、α-淀粉酶(50 U/mg)Sigma公司;3,5-二硝基水杨酸 国药集团化学试剂有限公司;其他试剂 均为国产分析纯。
Alpha1-2LDplus冷冻干燥机 德国christ公司;680型酶标仪 上海伯乐生命医学产品有限公司;UV-2550型紫外可见分光光度计 日本岛津公司;MS204S型分析天平 瑞士梅特勒-托利多公司;JM01-ZH-XSC型恒温游泳箱 河南精迈仪器仪表有限公司;HH-6型数显恒温水浴锅 金坛市佳美仪器有限公司;KQ-205B型超声波清洗器 昆山市超声仪器有限公司;透析袋MD77 截留分子量8000~14000 Da,北京索莱宝科技有限公司等。
1.2 实验方法
1.2.1 玉蜀黍不同部位的总黄酮和总皂苷成分的制备及测定
1.2.1.1 玉蜀黍不同部位的总黄酮和总皂苷成分的制备 分别称取50.00 g玉蜀黍须、秸秆皮、秸秆芯粉末,以不同比例加80%乙醇(1∶15、1∶15、1∶45)进行提取,40℃超声(60 W)提取1 h,将提取液于40℃水浴锅上至乙醇挥尽,用乙酸乙酯连续萃取3次,取上层萃取液,浓缩成干膏,即得玉蜀黍不同部位的总黄酮提取物。并将下层萃取液收集,置于4℃冰箱中过夜,使其充分沉淀,以4000 r/min速度离心30 min,保留沉淀,40℃水浴干燥至恒重,即得到玉蜀黍不同部位的总皂苷[19]。
1.2.1.2 总黄酮的测定 以芦丁为标准品,采用亚硝酸钠-硝酸铝法[20]测定样品中总黄酮含量。总黄酮含量测定标准曲线方程为y=0.9976x-0.0036,R2=0.9998。
1.2.1.3 皂苷含量测定 以齐墩果酸标为标准品,采用香草醛-冰醋酸-高氯酸法[21]测定样品中总皂苷含量。总皂苷含量测定标准曲线方程为y=3.8028x+0.0097,R2=0.9993。
1.2.2 玉蜀黍不同部位总多糖的制备和测定
1.2.2.1 玉蜀黍不同部位总多糖的制备 分别称取50.00 g玉蜀黍须、秸秆皮、秸秆芯粉末,以不同比例加入蒸馏水(1∶15、1∶15、1∶45)进行提取,60℃超声提取1 h,3000 r/min离心5 min后,并将收集的上清液于60℃旋蒸浓缩,收集浓缩液,加入乙醇使其终浓度达到75%,保鲜膜封口,放于4℃冰箱中过夜后,4000 r/min离心30 min,取沉淀,-40℃真空冷冻干燥,制得玉蜀黍不同部位总多糖冻干粉[22]。
1.2.2.2 总多糖的测定 以无水葡萄糖为标准品,采用苯酚-硫酸法[23]测定样品中总多糖含量。总多糖含量测定标准曲线方程为y=9.1386x+0.0057,R2=0.9989。
1.2.3 玉蜀黍不同部位总蛋白质的制备和测定
1.2.3.1 玉蜀黍不同部位总蛋白质的制备 分别称取50.00 g玉蜀黍须、秸秆皮、秸秆芯粉末,以不同比例加Tris-HCl缓冲液(1∶15、1∶15、1∶45)依次进行提取,用磁力搅拌4 h后,4000 r/min离心30 min,取上清液,加入硫酸铵使其终浓度达到50%,过夜,再次4000 r/min离心30 min,取沉淀,加适量蒸馏水溶解,经透析袋透析后,-40℃真空冷冻干燥,制得玉蜀黍不同部位总蛋白质冻干粉[24]。
1.2.3.2 总蛋白质的含量测定 以牛血清蛋白为标准品,采用考马斯亮蓝方法[25]测定样品中总蛋白质含量,总蛋白质含量测定标准曲线方程为y=6.1987x+0.0156,R2=0.9989。
1.2.4 玉蜀黍须总黄酮提取物对α-葡萄糖苷酶活性条件筛选
1.2.4.1 反应pH对α-葡萄糖苷酶抑制作用的影响 精确配制1 mg/mL的玉蜀黍须总黄酮提取物溶液测定对α-葡萄糖苷酶抑制作用,在37℃、反应时间20 min、反应pH(6.0、6.4、6.8、7.2、7.6)的条件下进行抑制作用测定,考察pH与抑制作用的关系。
1.2.4.2 反应温度对α-葡萄糖苷酶抑制作用的影响 精确配制1 mg/mL的玉蜀黍须总黄酮提取物溶液,在1.2.4.1确定的反应pH条件下,在反应时间20 min,温度(27、32、37、42、47℃)的条件测定对α-葡萄糖苷酶抑制作用,考察反应温度与抑制作用的关系。
1.2.4.3 反应时间对α-葡萄糖苷酶抑制作用的影响 精确配制,1 mg/mL的玉蜀黍须总黄酮提取物溶液,在1.2.4.1确定的反应pH条件下,在1.2.4.2确定的反应温度下,在反应时间(10、20、30、40、50 min)的条件下进行α-葡萄糖苷酶抑制作用测定,考察反应时间与抑制作用的关系。
1.2.5 玉蜀黍须总黄酮提取物对α-淀粉酶活性条件筛选
1.2.5.1 反应p H对α-淀粉酶抑制作用的影响 精确配制1 mg/mL的玉蜀黍须总黄酮提取物溶液,在37℃、时间10 min、反应pH(6.0、6.4、6.8、7.2、7.6)的条件下进行α-淀粉酶活性抑制作用测定,考察p H与抑制作用的关系。
1.2.5.2 反应温度对α-淀粉酶抑制作用的影响 精确配制1 mg/mL的玉蜀黍须总黄酮提取物溶液,在
1.2.5.1 确定的反应p H条件下,在反应时间10 min,温度(27、32、37、42、47℃)的条件下进行α-淀粉酶活性抑制作用测定,考察反应温度与抑制作用的关系。
1.2.5.3 反应时间对α-淀粉酶抑制作用的影响 精确配制1 mg/mL的玉蜀黍须总黄酮提取物溶液,在
1.2.5.1 确定的反应pH条件下,在1.2.5.2确定的反应温度下,在反应时间(5、10、15、20、25 min)的条件下进行α-淀粉酶活抑制作用测定,考察反应时间与抑制作用的关系。
1.2.6 玉蜀黍不同部位各成分对α-葡萄糖苷酶、α-淀粉酶的抑制作用 玉蜀黍不同部位对α-葡萄糖苷酶和α-淀粉酶抑制作用的反应时间、温度、p H等为1.2.4和1.2.5中最优条件。
1.2.7 对α-葡萄糖苷酶的抑制作用的测定 参考文献[26]方法略作变动,取80μL的0.1 mol/L磷酸盐缓冲液(pH6.8)于96孔板中,再加入20μL样品溶液,100μL的α-葡萄糖苷酶(0.5 U/mL)溶液,并在37℃摇床中孵育20 min后,加入50μL的PNPG(5 mmol/L)溶液,并用酶标仪分别于0和5 min时,在405 nm处测定吸光度A,利用SPSS 21.0软件查找相应的半数抑制浓度(IC50),式中对照为不加样品只加溶剂。
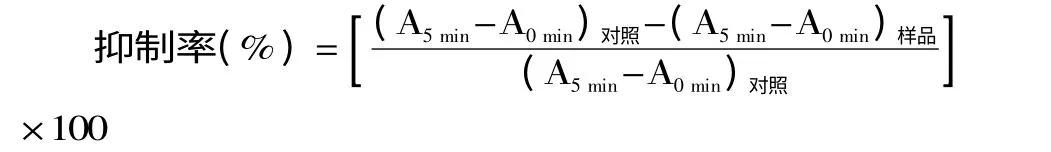
1.2.8 对α-淀粉酶的抑制作用的测定 参考文献[27]3,5-二硝基水杨酸比色法稍作修改,取200μL样品溶液于试管中,依次加入128μL蒸馏水,160μL的α-淀粉酶(1 U/mL)溶液,并在37℃摇床中孵育5 min后,加入0.5%淀粉溶液320μL,200μL柠檬酸-柠檬酸钠缓冲液(pH6.8)在37℃下反应10 min,再从中取出200μL溶液于试管中,加入100μL二硝基水杨酸(DNS)终止液,沸水浴15 min,取出冷却后,最后加入900μL蒸馏水,混匀后,再取出200μL于96孔板中,在540 nm下测定吸光值。以200μL样品的溶剂代替样品,加入0.5%淀粉溶液288μL和DNS溶液100μL作为空白;以200μL样品的溶剂代替样品,加入128μL的蒸馏水,160μL的α-淀粉酶(1 U/mL)溶液,100μL的DNS终止液作为对照。测定吸光值A,并计算抑制率。

1.3 数据统计分析
用SPSS 21.0软件对数据进行回归分析、处理,得到相应的酶半数抑制浓度(IC50);并进行皮尔逊相关性分析,数据用平均值±标准差表示(),以P<0.05作为差异显著性判断的标准。
2 结果与分析
2.1 玉蜀黍不同部位各成分含量
玉蜀黍不同部位总黄酮、总皂苷、总多糖、总蛋白质提取物含量的测定结果,如1表所示,总黄酮在玉蜀黍秸杆皮中含量最高(18.23%±0.61%),与秸秆芯、须相比较有显著性差异(P<0.05),玉蜀黍须总黄酮含量相对低(总黄酮含量80 mg/g,总黄酮得率为0.45%),与常波等[28]研究玉蜀黍须总黄酮得率为0.4229%实验结果一致。总皂苷在玉蜀黍须中含量最高(10.99%±0.45%),与秸秆芯、皮相比较有显著性差异(P<0.05)。与玉蜀黍须、秸秆皮相比较,总多糖在秸秆芯中含量最高(35.36%±0.57%),并与其它部位有显著性差异(P<0.05)。总蛋白质在玉蜀黍秸秆皮中含量最高(13.02%±0.12%),与须、秸秆芯相比较有显著性差异(P<0.05)。
2.2 玉蜀黍须总黄酮提取物对α-葡萄糖苷酶活性条件筛选结果
2.2.1 反应p H对α-葡萄糖苷酶抑制作用的影响 由图1可知,玉蜀黍须总黄酮提取物对α-葡萄糖苷酶的抑制作用随着不同pH的增加逐渐增强,当pH为6.8时,抑制率达到最高为64.21%,其抑制率显著高于其他pH(P<0.05),这与文献报道的一致[29],在pH到达6.8之后,抑制率逐渐减弱。可能是pH增大,使酶的活力降低。
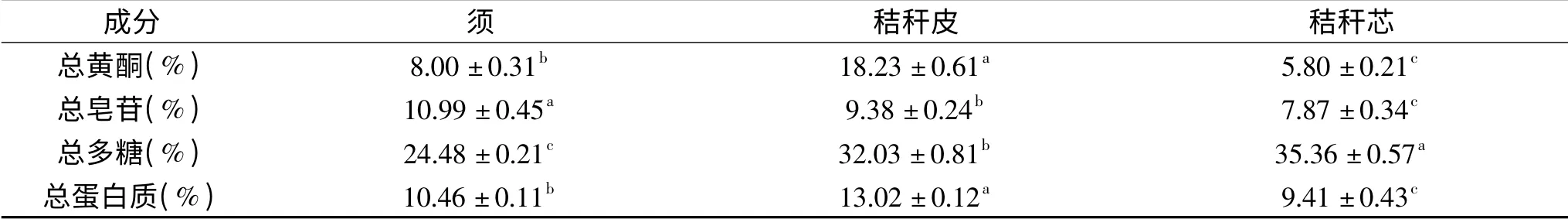
表1 玉蜀黍不同部位各成分含量(n=3)Table 1 Contents of components in different parts of maize(n=3)
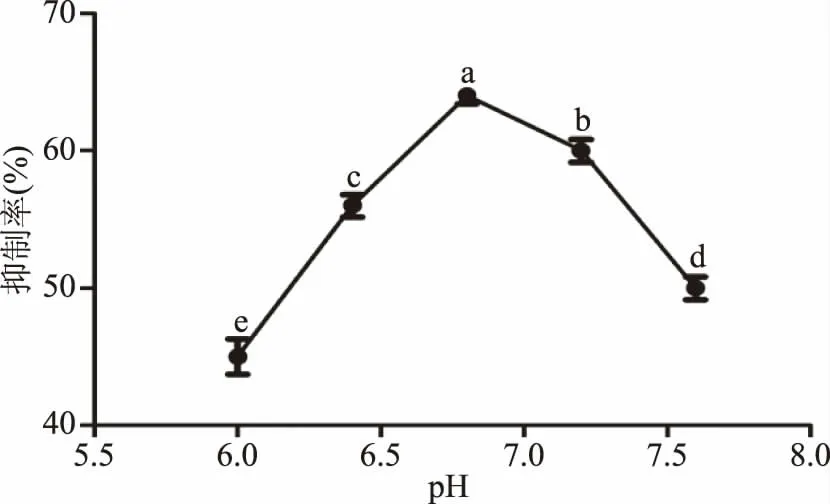
图1 反应pH对抑制作用的影响Fig.1 Effect of pH on inhibition
2.2.2 反应温度对α-葡萄糖苷酶抑制作用的影响 由图2可知,玉蜀黍须总黄酮提取物对α-葡萄糖苷酶的抑制作用随着反应温度的上升抑制率先增强后减弱的趋势,当温度达到37℃时,抑制率最大为63.47%,其抑制率与其他温度(除42℃外)之间有显著性差异(P<0.05),这与文献报道的一致[30],37℃之后温度继续升高,抑制率却有下降趋势,可能是温度升高,使酶的结构发生改变的原因,从而限制了玉蜀黍须中总黄酮提取物与α-葡萄糖苷酶的结合。
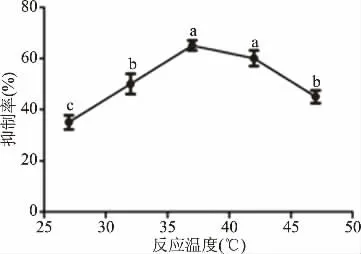
图2 反应温度对抑制作用的影响Fig.2 Effect of reaction temperature on inhibition
2.2.3 反应时间对α-葡萄糖苷酶抑制作用的影响 由图3可知,玉蜀黍须总黄酮提取物对α-葡萄糖苷酶的抑制作用随着反应时间的增加抑制率逐渐增强,当反应时间达到20 min时,抑制率最大为65.17%,其抑制率显著高于其他时间(P<0.05),随时间增加抑制率略有下降后,抑制曲线趋于平缓,可能是此时玉蜀黍须总黄酮提取物与α-葡萄糖苷酶的作用已趋于饱和[29]。后续抑制作用实验的反应时间为20 min。
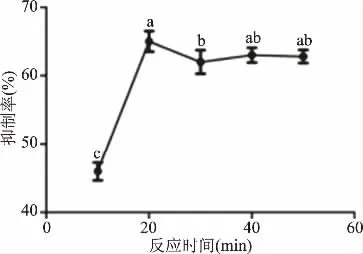
图3 反应时间对抑制作用的影响Fig.3 Effect of reaction time on inhibition
2.3 玉蜀黍须总黄酮提取物对α-淀粉酶抑制活性条件筛选结果
2.3.1 反应p H对α-淀粉酶抑制作用的影响 由图4所示,玉蜀黍须总黄酮提取物对α-淀粉酶的抑制作用条件偏中性,在pH6.0~6.8范围内,其抑制率随着pH的增加逐渐升高;在pH为6.8时,抑制率最大为22.39%,其抑制率显著高于其他p H(P<0.05),这与文献报道的一致[31]。当p H大于7.0后,随着pH升高其抑制率明显下降,可能由于碱性条件使淀粉酶的活性中心和玉蜀黍须总黄酮提取物结构发生解离或改变[29],从而阻碍了玉蜀黍须总黄酮提取物对α-淀粉酶的抑制作用。
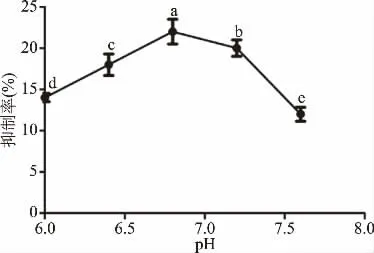
图4 反应pH对抑制作用的影响Fig.4 Effect of pH value on inhibition
2.3.2 反应温度对α-淀粉酶抑制作用的影响 由图5可知,当反应温度在27~47℃范围时,玉蜀黍须总黄酮提取物对α-淀粉酶的抑制率随温度的增加呈先增加后减小的趋势;玉蜀黍须总黄酮对α-淀粉酶的抑制作用在37℃时达到最大29.53%;随着反应温度的持续升高,α-淀粉酶抑制率却逐渐降低,这可能是由于温度的增加对酶的结构造成了一定的影响,从而限制了玉蜀黍须中总黄酮的抑制剂组分与淀粉酶的结合,但影响差异不明显,陈睿等[32]报道灰栒子提取物在0~90℃范围内对α-淀粉酶抑制作用无明显影响,故玉蜀黍须总黄酮提取物对α-淀粉酶的抑制率作用温度为37℃。
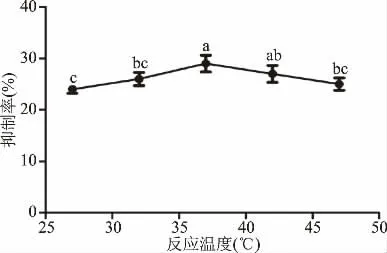
图5 反应温度对抑制作用的影响Fig.5 Effect of reaction temperature on inhibition
2.3.3 反应时间对α-淀粉酶抑制作用的影响 由图6可知,玉蜀黍须总黄酮提取物对α-淀粉酶的抑制作用随着反应时间的增加抑制率逐增强,当反应时间为10 min时,抑制率达到最大24.73%,在10 min之后抑制率增加逐渐减慢,抑制曲线趋于平缓,可能是10 min之后抑制剂与酶的作用已趋于饱和的原因。而魏振奇等[33]得到的齐墩果酸对α-淀粉酶作用的最佳反应时间为25 min,且随时间的增加,抑制率逐渐上升,这与本实验得出结果不同,推测造成不同的原因可能是二者间存在不同的抑制剂,其抑制剂的作用方式有所不同,具体原因还有待进一步研究。本试验表明玉蜀黍须总黄酮提取物与α-淀粉酶的结合作用较快,在10 min达到了最大。

图6 反应时间对抑制作用的影响Fig.6 Effect of reaction time on inhibition
2.4 玉蜀黍不同部位各成分对α-葡萄糖苷酶的抑制作用
从图7可以看出,玉蜀黍不同部位总黄酮粗提物对α-葡萄糖苷酶均有一定的抑制作用,当质量浓度在0.125~2 mg/mL之间时,抑制效果随浓度增大而增加,具有量效依赖关系。结果如表2所示,玉蜀黍须、秸秆芯、秸秆皮中总黄酮提取物对α-葡萄糖苷酶IC50分 别 为:0.63±0.03、0.35±0.06、0.13±0.01 mg/mL,其与空白组比较,差异有统计学意义(P<0.05)。玉蜀黍不同部位总黄酮提取物对α-葡萄糖苷酶的抑制效果:秸秆皮>秸秆芯>须,其中玉蜀黍秸秆皮中总黄酮对α-葡萄糖苷酶的抑制作用最强。
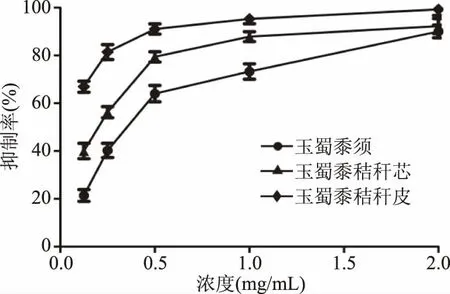
图7 玉蜀黍不同部位总黄酮提取物对α-葡萄糖苷酶抑制率Fig.7 Inhibition rate of total flavone extracts from different parts of maize toα-glucosidase
表2 玉蜀黍不同部位总黄酮提取物对α-葡萄糖苷酶抑制率测定结果(,n=3)Table 2 Determination of the inhibitory rate of total flavonoids onα-glucosidase in different parts of maize(,n=3)

表2 玉蜀黍不同部位总黄酮提取物对α-葡萄糖苷酶抑制率测定结果(,n=3)Table 2 Determination of the inhibitory rate of total flavonoids onα-glucosidase in different parts of maize(,n=3)
注:不同小写字母表示差异显著(P<0.05)。
组别(黄酮) IC50(mg/mL)空白组-玉蜀黍须 0.63±0.03a玉蜀黍秸秆芯 0.35±0.06b玉蜀黍秸秆皮 0.13±0.01 c
从图8~图10中可看出,在2 mg/mL时,玉蜀黍须总皂苷、总多糖、总蛋白质和秸秆芯、秸秆皮总多糖提取物对及α-葡萄糖苷酶抑制率分别为:4.26%±0.51%、8.31%±0.63%、9.23%±2.99%、4.47%±0.81%、12.22%±0.83%,但在质量浓度0.125~1 mg/mL内表现出较弱或负抑制活性,与廖彭莹等[34]报道杨桃不同部位提取物对α-葡萄糖苷酶负抑制活性结果相似。玉蜀黍不同部位其他成分集在质量浓度0.125~2 mg/mL对α-葡萄糖苷酶活性亦不佳,推测可能玉蜀黍提取物浓度过小或这几种提取物与α-葡萄糖苷酶结合能力不强,相较于相同浓度范围内玉蜀黍不同部位总黄酮提取物对α-葡萄糖苷酶抑制活性意义不大,故没有进行深入研究。综上所述,玉蜀黍不同部位中总黄酮提取物对α-葡萄糖苷酶抑制活性最好。其中玉蜀黍秸秆皮中总黄酮提取物对α-葡萄糖苷酶的抑制作用最强。
2.5 玉蜀黍不同部位总黄酮对α-糖苷酶抑制活性相关性分析
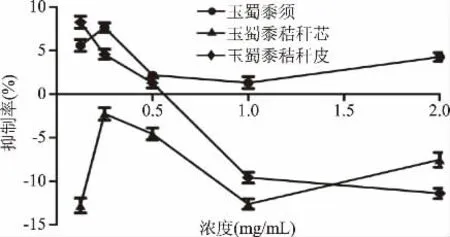
图8 玉蜀黍不同部位总皂苷粗提物对α-葡萄糖苷酶抑制率Fig.8 Inhibition rate of crude extracts of total saponins from different parts of maize toα-glucosidase
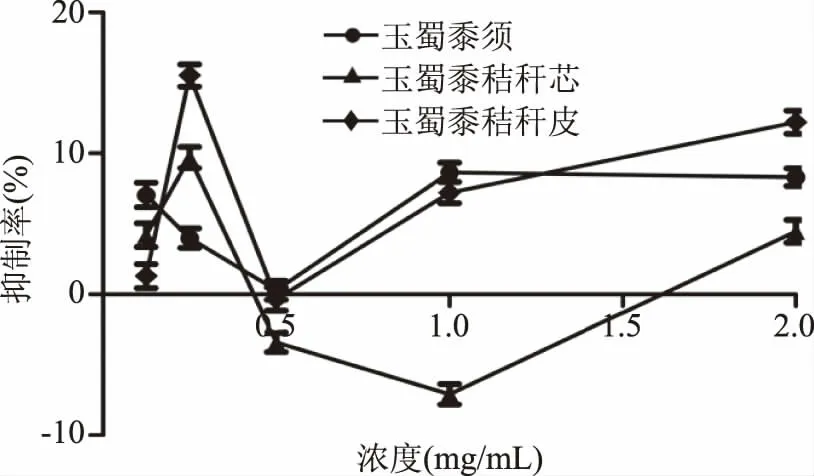
图9 玉蜀黍不同部位总多糖提取物对α-葡萄糖苷酶抑制率Fig.9 Inhibition rate of total polysaccharide extracts from different parts of maize toα-glucosidase
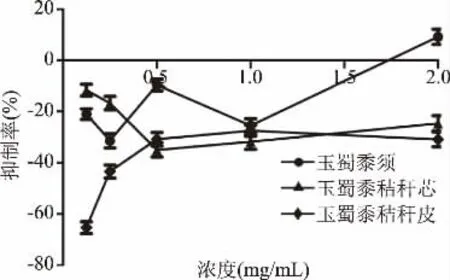
图10 玉蜀黍不同部位总蛋白提取物对α-葡萄糖苷酶抑制率Fig.10 Inhibition rate of total protein extracts from different parts of maize toα-glucosidase
为进一步探索玉蜀黍不同部位总黄酮提取物对α-葡萄糖苷酶抑制作用之间相关性,以皮尔逊相关性分析(Pearson correlation analysis)的相关系数衡量不同指标之间相关性。玉蜀黍须总黄酮质量浓度与α-葡萄糖苷酶抑制率呈现较强的正相关性,皮尔逊相关系数为r=0.895,P=0.04,。玉蜀黍秸秆芯总黄酮质量浓度与α-葡萄糖苷酶抑制率呈现较强的正相关性,皮尔逊相关系数为r=0.901,P=0.037。玉蜀黍秸秆皮总黄酮提取物质量浓度与α-葡萄糖苷酶抑制率呈现较强的正相关性,皮尔逊相关系数为r=0.925,P=0.024。IC50与玉蜀黍不同部位总黄酮提取物含量呈现较强的负相关性,皮尔逊相关系数为r=-0.997,P=0.048,。由此可见,玉蜀黍不同部位中总黄酮提取物是抑制α-葡萄糖苷酶的活性成分。
2.6 玉蜀黍不同部位各成分对α-淀粉酶的抑制作用
玉蜀黍不同部位总黄酮对α-淀粉酶抑制作用如图11所示,玉蜀黍不同部位总黄酮提取物对α-淀粉酶活性均有一定的抑制作用。玉蜀黍须、秸秆皮、秸秆芯总黄酮在质量浓度在0.125~2 mg/mL范围内对α-淀粉酶抑制作用先增大后减小,在质量浓度为1、0.5、0.125 mg/mL时对α-淀粉酶的抑制活性达到最 大 分 别 为:36.41%±0.26%、21.46%±1.45%、14.63%±0.62%。与对照组相比,各给药组都可显著抑制α-淀粉酶,差异均具有统计学意义(P<0.05)。
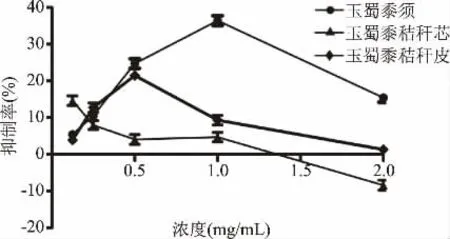
图11 玉蜀黍不同部位总黄酮粗提物对α-淀粉酶抑制率Fig.11 Inhibition rate of crude flavonoids from different parts of maize toα-amylase
从图12~图14可以看出,仅玉蜀黍须总皂苷提取物在质量浓度0.125~2 mg/mL内有一定的抑制率,但玉蜀黍不同部位其他成分集在质量浓度0.125~2 mg/mL对α-淀粉酶有极弱或者负数抑制率,可能增大浓度会有一定的抑制作用,但无论对α-淀粉酶是极弱或者负数抑制率均不稳定,且没有剂量依赖性,相较于玉蜀黍不同部位总黄酮提取物对α-淀粉酶抑制作用意义不大,故没有进行深入研究。周晓婷等[35]报道苦荞不同极性提取物对α-淀粉酶的抑制作用,阿依仙木·加帕尔等[36]研究维药石榴花多酚提取物对α-葡萄糖苷酶和α-淀粉酶抑制作用,与本实验结果相似,均对α-淀粉酶有极弱或者负数抑制率。
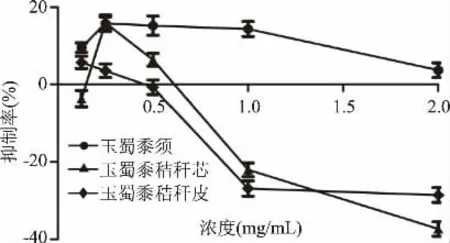
图12 玉蜀黍不同部位总皂苷粗提物对α-淀粉酶抑制率Fig.12 Inhibition rate of crude extracts of total saponins from different parts of maize toα-amylase
3 结论与讨论
玉蜀黍采摘过后须、秸秆等大部分以废弃物形式直接焚烧处理,浪费大量资源同时也污染环境,初步的文献检索发现,关于玉蜀黍研究大都集中在玉蜀黍须的抗氧化、降糖、免疫条件等方面,如刘娟等[37]发现,玉米须总多糖可通过促进糖尿病小鼠糖异生,调节小鼠的代谢功能,治疗糖尿病;马天成等[38]报道,玉米须总黄酮具有很好的抗氧化活性等。但关于玉蜀黍秸秆皮、秸秆芯药理作用研究较少,故本实验开展玉蜀黍不同部位(须、秸秆皮、秸秆芯)提取物体外降糖作用研究。
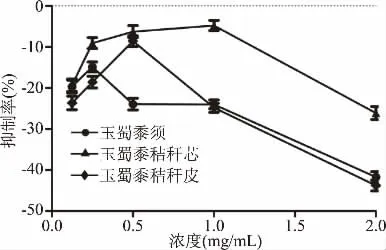
图13 玉蜀黍不同部位总多糖粗提物对α-淀粉酶抑制率Fig.13 Inhibition rate of crude polysaccharide extracts from different parts of maize toα-amylase
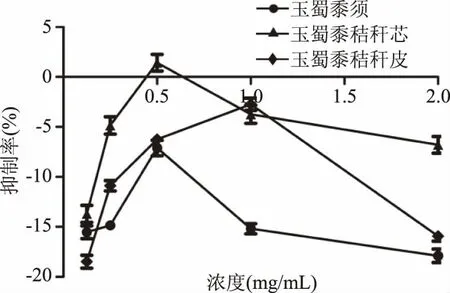
图14 玉蜀黍不同部位总蛋白提取物对α-淀粉酶抑制率Fig.14 Inhibition rate of crude protein extracts from different parts of maize toα-amylase
本实验以对α-淀粉酶和α-葡萄糖苷酶抑制率为降糖活性评价指标,对玉蜀黍不同部位各成分提取物进行考察,以玉蜀黍须总黄酮提取物为原料筛选α-葡萄糖苷酶抑制反应最适p H6.8、温度37℃、时间20 min;α-淀粉酶抑制反应最适pH为6.8、温度37℃、时间10 min,这表明玉蜀黍须总黄酮提取物对α-葡萄糖苷酶和α-淀粉酶的抑制作用温和,且亲和力较强。玉蜀黍不同部位(须、秸秆芯、秸秆皮)总黄酮提取物对α-葡萄糖苷酶抑制作用IC50分别为:0.63、0.35、0.13 mg/mL;对α-淀粉酶抑制活性在1、0.5、0.125 mg/mL时质量浓度范围内最大抑制率分别为:36.41%±0.26%、21.46%±1.45%、14.63%±0.62%,明显强于玉蜀黍不同部位总皂苷、总多糖、总蛋白质的降糖效果。但在体内实验中玉蜀黍不同部位提取物是否具有同样的药效及以其具体的药效成分和作用机制还有待进一步研究。
综上所述,本实验研究了玉蜀黍不同部位提取物对α-葡萄糖苷酶和α-淀粉酶活性的影响,结果表明玉蜀黍不同部位各成分提取物特别是总黄酮具有良好的体外降血糖活性,这为玉蜀黍扩大药用部位及其资源的进一步开发利用提供了理论依据。

