N-丙酰-唾液酸衍生物的化学酶法合成及在测定禽蛋中唾液酸含量的应用
王毛毛,张瑶瑶,+,姚宏亮,刘 丽,*,JOSEF Voglmeir,*
(1.南京农业大学食品科技学院,江苏南京210095;2.金陵科技学院动物科学与技术学院食品科学系,江苏南京210038)
唾液酸(Sialic acid,Sia),又称神经氨酸(Neuraminic acid,Neu),是一系列含有九个碳原子的羟基化单糖酰化衍生物的统称,通常位于高等动物糖蛋白、神经节苷脂及多糖胺等寡糖链的末端[1],通过α-2,3/6键连接在半乳糖(Gal)/N-乙酰半乳糖胺(GalNAc)上或α-2,8键连接到其他种类的唾液酸上[2]。唾液酸家族种类繁多,目前已经鉴定出50多种天然存在的唾液酸衍生物[3],其核心结构分为酮基-脱氧壬酮糖(Kdn)和神经氨酸(Neu)两大类[4]。常见两种构型为N-乙酰神经氨酸(Neu5Ac)和N-羟乙酰神经氨酸(Neu5Gc)[5],其中研究最多、最深入的唾液酸是Neu5Ac,它是合成其他种类唾液酸的前体[6]。唾液酸作为糖缀合物的重要组成部分,其所携带的负电荷能促进细胞之间的相互排斥,起到稳定细胞膜、增加偶联糖蛋白粘度的作用[7]。唾液酸还是重要的生物信息传递分子,如参与识别宿主与病原体之间以及细胞之间的反应[8-9]、参与衰老红细胞的触发和吞噬等[10]。另外,唾液酸与肿瘤的发生、发展都有着密切的关联[11-12]。研究发现唾液酸在脑中的含量很高,它能促进神经细胞的发育、分化和再生,并参与记忆和学习功能[13]。婴幼儿自身合成的唾液酸并不能满足机体需要,研究发现可以通过饮食补充外源性唾液酸以增加脑部唾液酸的含量。因此很有必要开发一种能够用于食品中唾液酸含量的准确定量方法,为婴幼儿膳食营养补充提供有力的依据。
Warren等[14]开发出一种用于唾液酸含量测定的比色法,但该方法的特异性差。随着分析技术的稳定和完善,如高效液相色谱(HPLC)、气相色谱(GC)和质谱的联用等分析技术使人们对唾液酸的结构有了更加清晰的认识。Koketsu等[15]应用高效液相色谱技术测定了乌鸡蛋中唾液酸的含量。但该方法的缺点是生物样品的基质效应使得唾液酸的检测结果准确度不高。为了解决这一问题,本实验室在前期研究中以X-Gal-α-2,6-Neu5Prop为内标,与红肉样品同时进行酸水解使分析物与内标物处于相同的基质背景,从而消除基质效应[16]。游离唾液酸经荧光标记物邻苯二胺衍生后采用HPLC-FLD进行检测[16-18],实现了红肉中唾液酸的准确定量。
膳食中Neu5Ac的主要来源之一是鸡蛋,研究发现鸡蛋中含有大量的Neu5Ac,尤其是蛋黄中含量更高(0.95 g/kg)[19],且不含其他种类的唾液酸[20]。鸡蛋作为Neu5Ac的饮食和工业来源具有巨大的潜力[21]。而其他种类禽蛋如鹌鹑蛋、鹅蛋、鸭蛋等却鲜有研究,因此本研究拟以化学酶法合成的X-Gal-α-2,6-Neu5Prop为内标并结合HPLC-FLD对9种禽类蛋黄和蛋清中Neu5Ac的含量进行测定,从而为膳食营养的摄入提供参考。
1 材料与方法
1.1 材料与仪器
新鲜禽蛋(鸡,鹌鹑、鹅、珍珠鸡、鸵鸟、鸭、鸽子、乌鸡和火鸡)购自江苏苏果超市和南京家禽养殖场;N-乙酰神经氨酸 分析纯,上海德默医药科技有限公司;NaHSO3、NaCl、冰醋酸 分析纯,国药集团化学试剂有限公司;邻苯二胺(OPD)分析纯,百灵威科技有限公司;甲醇、乙腈 色谱纯,默克公司;N-氨基琥珀酰亚胺(NHS)、二环己基碳二亚胺(DCC)、乙酸乙酯、三乙胺(Et3N)、甲醇、氯化镁、5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-Gal)、2-(N-吗啡啉)、乙磺酸(MES)、三磷酸胞苷(CTP)、甘露糖胺 分析纯,南京寿德公司;所有分离用有机溶剂 均为国产分析纯;唾液酸转移酶(~0.02 U)、CMP-唾液酸合成酶(~0.02 U)、唾液酸醛缩酶(≥13 mU)南京格莱克生物科技有限公司;乳糖酶(~10 U) 德国Pronatura公司。
1416R型高速冷冻离心机 珠海黑马医学仪器有限公司;GRP-9160型恒温培养箱 上海森信实验仪器有限公司;LNG-T12真空离心浓缩干燥仪 太仓市华利达实验设备有限公司;Shimadzu LC-30AD型超高效液相色谱配有SPD-20A型紫外检测器以及RF-20Axs型荧光检测器、SIL-30AC型自动进样器、CO-2000型柱温箱(恒温仪器)、LCMS-2020型液相质谱联用仪、LC solution工作站 岛津技迩(上海)商贸有限公司;UltrafileXtreme MALDI-TOF质谱仪 德国Bruker公司;数显恒温水浴锅 常州国华电器有限公司(江苏)。
1.2 实验方法
1.2.1 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的合成、纯化与检测 生物样品中唾液酸通常以糖缀合物的形式存在于糖脂和糖蛋白上与半乳糖残基相连。因此本文选择了X-Gal-α-2,6-Neu5Ac作为生物样品唾液酸糖缀合物的模型,并研究X-Gal-α-2,6-Neu5Ac在酸性条件下的水解特性以确定生物样品中唾液酸糖缀合物解离为游离唾液酸的最佳反应时间,同时跟内标物在酸性条件下水解特性进行比较,以判断X-Gal-α-2,6-Neu5Prop是否能作为合适的内标。
1.2.1.1 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的合成 以Neu5Ac和X-Gal为起始物,酶法合成X-Gal-α-2,6-Neu5Ac[22-25],将MES缓冲液(4 mL,0.5 mol/L,pH6.5)、MgCl2(80μL,1 mol/L)、胞苷三磷酸(5.52 mL,80 mmol/L)、Neu5Ac(0.92 mL,0.2 mol/L)、X-Gal(0.6 mL,61 mmol/L)、唾液酸转移酶(19.68 mL)和CMP-唾液酸合成酶(9.2 mL)混合后置于37℃恒温培养箱中反应。在10 min、30 min、1 h、2 h、3 h等反应时间点取样并用HPLC实时监测X-Gal-α-2,6-Neu5Ac的转化率,待转化率达到95%时加入乳糖酶(1 mL),继续反应1 h以除去过量的X-Gal。
以甘露糖胺为底物采用化学酶法合成X-Gal-α-2,6-Neu5Prop[16,25](X-Gal-α-2,6-Neu5Prop的合成流程及应用如图1所示)。将反应体系置于37℃恒温培养箱中反应,利用HPLC实时检测转化率,待转化率≥80%时加入乳糖酶(~10 U),37℃反应30 min以除去过量的X-Gal。
1.2.1.2 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的纯化 将1.2.1.1中X-Gal-α-2,6-Neu5Ac的反应体系先经 C18固相萃取柱(SupelcleanTM ENVITM-18 SPE,45μm平均孔径,500 mg/3 mL)纯化,上样后用4 mL水平衡柱子,然后分别用10 mL 10%、40%、100%的乙腈-水溶液(v/v)梯度洗脱并收集样品洗脱下来的样品,每管收集2 mL,利用HPLC在300 nm的波长下检测收集到的组分并将含有X-Gal-α-2,6-Neu5Ac的组分合并。将合并后的初提纯品减压真空浓缩干燥(28 Pa,1500 r/min,常温)后用硅胶柱进行二次纯化,硅胶柱采用湿法装柱,硅胶粉用量为样品量的30倍左右,待硅胶柱压实后将X-Gal-α-2,6-Neu5Ac的初提纯品加入硅胶柱的最上端,经乙酸乙酯∶甲醇∶水(12∶8∶1,v/v/v)混合溶剂洗脱,并收集洗脱液。用HPLC对收集到的样品进行再次检测,将含有X-Gal-α-2,6-Neu5Ac的洗脱组分合并,采用真空浓缩除去溶剂,得到10 mg X-Gal-α-2,6-Neu5Ac的纯品(产率为39%,产物的摩尔质量/底物的摩尔质量×100)。X-Gal-α-2,6-Neu5Prop的纯化方式与上述相同。
1.2.1.3 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的检测 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的HPLC检测洗脱程序如下:反相色谱柱:Phenomenex Hyperclone 5μm ODS C18,250 mm×4.60 mm。流动相A:50 mmol/L甲酸铵(p H4.5);流动相B:乙腈;流速1.0 mL/min;紫外检测波长:300 nm;进样量:10μL;柱温常温。洗脱程序:0~5 min B 10%~60%,5~6 min B 60%~90%,6~8 min B 90%,8~9 min B 90%~10%,9~15 min B 10%。
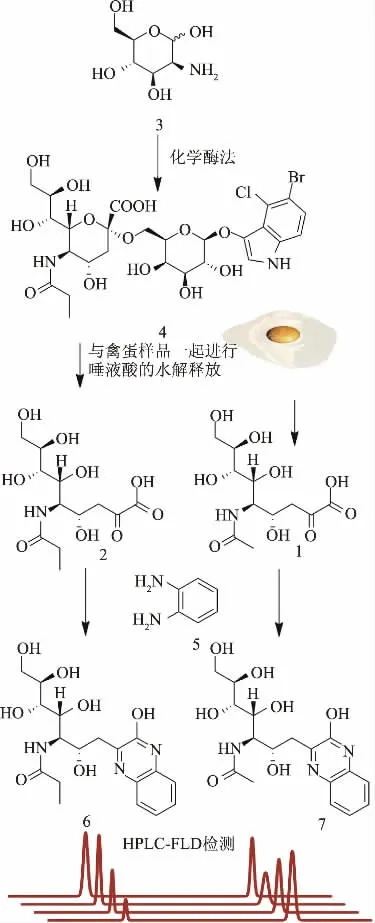
图1 以甘露糖胺为底物化学酶法合成X-Gal-α-2,6-Neu5Prop及其作为内标检测禽蛋样品中Neu5Ac含量的流程图Fig.1 The route of synthesis of X-Gal-α-2,6-Neu5Prop from mannosamine and determination of Neu5Ac content in poultry egg samples
对纯化后的X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop用高效液相色谱-质谱(HPLC-MS)检测后,采用基质辅助激光解吸电离飞行时间质谱(MALDI-ToF-MS)对这两种物质进一步验证以确定其准确性。质谱检测参数:电喷雾离子源,脱溶剂管温度250℃,雾化器流速3 L/min,干燥器流速15 L/min。MALDI-ToF-MS质谱条件为:离子加速电压20 k V,质荷比扫描范围m/z 300~1500,采集数据所用激光的能量为6000,采用Bruker Flexanalysis 3.3分析软件对质谱数据进行处理。
1.2.2 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop水解特性研究 为了确定生物样品中唾液酸糖缀合物解离为游离唾液酸的最佳反应时间,并进一步验证X-Gal-α-2,6-Neu5Prop能否作为禽蛋Neu5Ac定量检测的合适内标物,本文研究了X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop在酸性条件下的水解特性。分别取4、20、100μL 1.2.1中合成的X-Gal-α-2,6-Neu5Prop或X-Gal-α-2,6-Neu5Ac溶 液(0.4 mmol/L),醋 酸 溶 液(100μL,2 mol/L)和水(总体积200μL)加入到1.5 mL离心管中,80℃水浴下进行反应。在反应0、10、20、30、60、90、120、150、180 min时分别取4μL反应上清液,冰浴并用水稀释至20μL过滤膜,采用HPLC检测不同时间点的样品。高效液相色谱检测条件与1.2.1.3中相同。并根据下列公式计算水解程度:
水解程度(%)=(水解前的样品量-水解后的样品量)/水解前的样品量×100
1.2.3 Neu5Ac和Neu5Prop在酸性条件下的稳定性研究 为了检验唾液酸在酸性条件下的稳定性,将1.2.1.1中合成的X-Gal-α-2,6-Neu5Prop或X-Gal-α-2,6-Neu5Ac(4μL,0.4 mmol/L),冰醋酸(100μL,2 mol/L)和水(96μL)混匀后于80℃水浴中反应,在反应0、10、30 min,1、2、3、4、5、6、8、10、12、15 h时取反应上清液并迅速冰浴冷却以终止反应,将反应上清液减压真空浓缩干燥(28 Pa,1500 r/min,常温)并参照1.2.6中描述的方法进行检测。
1.2.4 Neu5Ac和Neu5Prop的浓度与色谱峰面积之间的线性关系考察 为了考察分析方法的准确性,本文研究了不同浓度的Neu5Ac和Neu5Prop与色谱峰面积之间的线性关系。将X-Gal-α-2,6-Neu5Prop或X-Gal-α-2,6-Neu5Ac分别溶于2 mol/L醋酸溶液中配制成1、2、2.5、5、10、15、20、40、60、80、100μmol/L的唾液酸衍生物,将配制好的溶液置于80℃水浴上加热3 h后,迅速冰浴冷却以终止反应,将反应液减压真空浓缩干燥(28 Pa,1500 r/min,常温)并参照1.2.6中描述的方法进行检测。
1.2.5 禽蛋样品中Neu5Ac的解离与定量检测 将蛋黄与蛋清分离,称取20 mg蛋黄或蛋清溶于1 mL醋酸溶液(2 mol/L)中,从中取出100μL加入4μL X-Gal-α-2,6-Neu5Prop水溶液(0.4 mmol/L)和96μL水。将反应体系置于80℃水浴中加热3 h。反应结束后迅速将水解样品冰浴冷却以终止反应,离心后(12000 g,5 min,4℃)取500μL上清液减压真空浓缩干燥(28 Pa,1500 r/min,常温)并参照1.2.6中描述的方法进行检测(流程如图2所示),并根据下列公式计算禽蛋样品中Neu5Ac的含量:
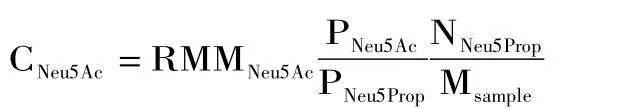
其中,CNeu5Ac表示Neu5Ac的含量,mg/g;RMMNeu5Ac表示Neu5Ac的相对分子质量309.27 g/mol;N表示样品中Neu5Prop的摩尔质量1.6 nmol;M表示样品质量,g;P表示峰面积。
1.2.6 唾液酸的荧光衍生与检测 将上述经真空干燥的游离唾液酸复溶在100μL 0.1 mol/L的氯化钠溶液中,离心(12000×g,5 min,4℃)后取50μL上清加入10μL OPD衍生试剂(10 mg/mL邻苯二胺(OPD)溶于0.2 mol/L NaHSO3溶液),置于80℃水浴中避光反应40 min。
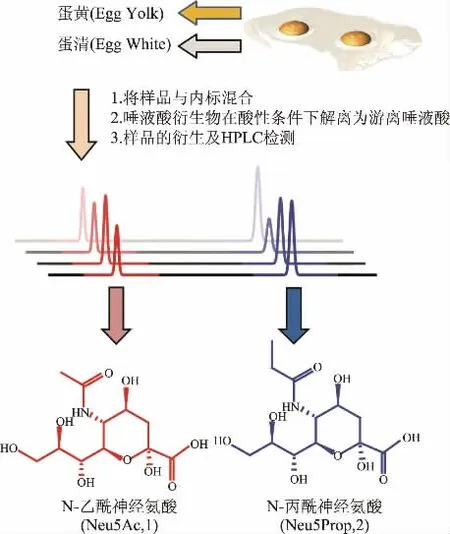
图2 以X-Gal-α-2,6-Neu5Prop为内标检测禽蛋样品中Neu5Ac的含量Fig.2 Determination of Neu5Ac in eggs by X-gal-α-2,6-neu5prop as internal standard
采用HPLC-FLD对衍生后的唾液酸样品进行检测。反相色谱柱:Phenomenex Hyperclone 5μm ODS C18,250 mm×4.60 mm。荧光激发波长Ex为373 nm,发射波长Em为448 nm,进样量10μL。流动相A为纯净水,流动相B为色谱纯乙腈,流动相C为色谱纯甲醇,总流速为1.0 mL/min,梯度洗脱时间为22 min。洗脱程序如下:流动相A∶B∶C的初始比例为90∶5∶5,10 min内流动相比例逐渐变为76∶12∶12,然后2 min内流动相比例变为20∶40∶40,并在此浓度保持10 min。
1.3 数据处理
采用Microsoft Excel Office 2010数据整理,绘图软件采用Adobe illustrator进行色谱图绘制。
2 结果与分析
2.1 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的合成、纯化与检测
酶法合成的X-Gal-α-2,6-Neu5Ac以及化学酶法合成的X-Gal-α-2,6-Neu5Prop,经C18固相萃取柱初提纯后再经硅胶柱二次纯化。纯化后的X-Gal-α-2,6-Neu5Ac与X-Gal-α-2,6-Neu5Prop经HPLC检测,结果如图3A中所示,X-Gal-α-2,6-Neu5Ac与X-Gal-α-2,6-Neu5Prop的保留时间均在7 min左右,采用LC-MS对其进行验证,提取在负离子模式下的离子流图,结果如图3B中所示,X-Gal-α-2,6-Neu5Ac的质荷比(m/z)为697.06([M-H]-),与理论值697.14([M-H]-,84%)相符。X-Gal-α-2,6-Neu5Prop的质荷比(m/z)为711.08([M-H]-),与理论值711.18([M-H]-,77%)一致。采用MALDI-ToF-MS对X-Gal-α-2,6-Neu5Ac与X-Gal-α-2,6-Neu5Prop进一步验证,结果如图3C和3D所示,检测结果均与理论值相符。因此,本研究成功合成并得到了X-Gal-α-2,6-Neu5Ac与X-Gal-α-2,6-Neu5Prop的纯品。

图3 X-Gal-唾液酸的HPLC-MS谱图和MALDI-ToF-MS谱图Fig.3 The HPLC-MSprofiling and MALDI-ToF-MS profiling of the X-Gal-sialoside
2.2 X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop的水解特性研究
本研究以酶法合成的X-Gal-α-2,6-Neu5Ac作为生物样品中唾液酸糖缀合物的模型,以化学酶法合成的X-Gal-α-2,6-Neu5Prop为内标物,研究了X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop在酸性条件下的水解特性。将不同样品量的X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop在2 mol/L的醋酸溶液中80℃的水解条件下反应,取反应0、10、20、30、60、90、120、150、180 min时的反应上清液冰浴、稀释并过滤膜后用HPLC进行分析。研究结果如图4所示,不同样品量的唾液酸衍生物在60 min内水解速率较快,唾液酸衍生物的解离程度与反应时间成正比。90 min后能完全转化为相应的游离唾液酸。因此,相同样品量的生物样品中唾液酸糖缀合物在2 mol/L的醋酸溶液中、80℃的水解条件下,90 min即可完全转化为游离的唾液酸。
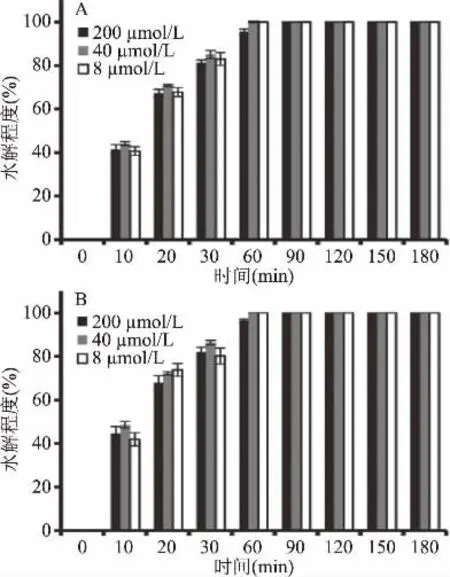
图4 底物浓度和水解时间对X-Gal-唾液酸水解程度的影响Fig.4 Effects of substrate concentration and time on the extent of the hydrolysis of X-Gal-α-2,6-sialoside
2.3 Neu5Ac和Neu5Prop在酸性条件下的稳定性分析
在样品处理和衍生过程中,分析物与内标的稳定性十分重要。因此本文研究了Neu5Ac和Neu5Prop在酸性条件下的稳定性。前期研究结果显示唾液酸衍生物如脱氨基神经氨酸(KDN)在酸性条件下的稳定性与Neu5Ac相比明显较差[16,26]。为了评估这一特性,将X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop分别溶于2 mol/L醋酸溶液中并在80℃下(与禽蛋样品中唾液酸的水解条件相同)反应,游离唾液酸经OPD衍生后采用HPLC进行分析。结果如图5所示,Neu5Ac和Neu5Prop在10 h内表现出相似的稳定性,反应10 h后,游离唾液酸的量随水解时间的延长呈逐渐下降的趋势。从图5B中可以看出,水解3 h后Neu5Prop的量随着水解时间的延长不再继续升高,因此X-Gal-α-2,6-Neu5Prop在水解3 h后能完全解离为游离的Neu5Prop。
2.4 底物浓度与峰面积之间的线性关系的考察
为了考察分析方法的准确性以及灵敏度,采用高效液相色谱对已知浓度的Neu5Ac和Neu5Prop(从X-Gal-α-2,6-唾液酸的定量水解得到)与峰面积之间的线性关系进行考察。以浓度为横坐标,峰面积为纵坐标进行线性回归分析,结果如图6所示。Neu5Ac和Neu5Prop在1~100μmol/L的浓度范围内均呈线性关系。
2.5 禽蛋中唾液酸含量的定量测定
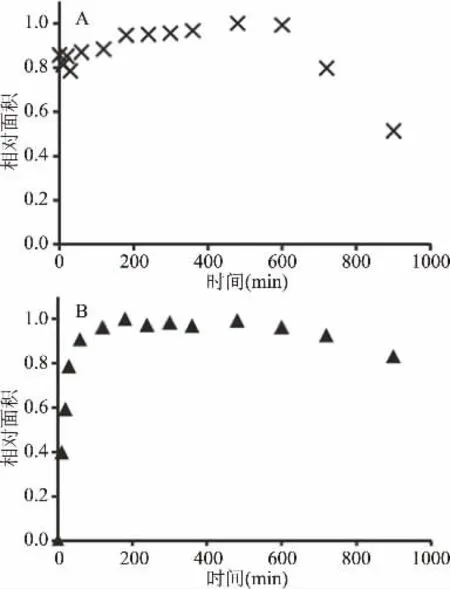
图5 唾液酸水解条件下Neu5Ac和Neu5Prop的稳定性Fig.5 Stability of Neu5Ac and Neu5Prop under sialic acid-releasing conditions
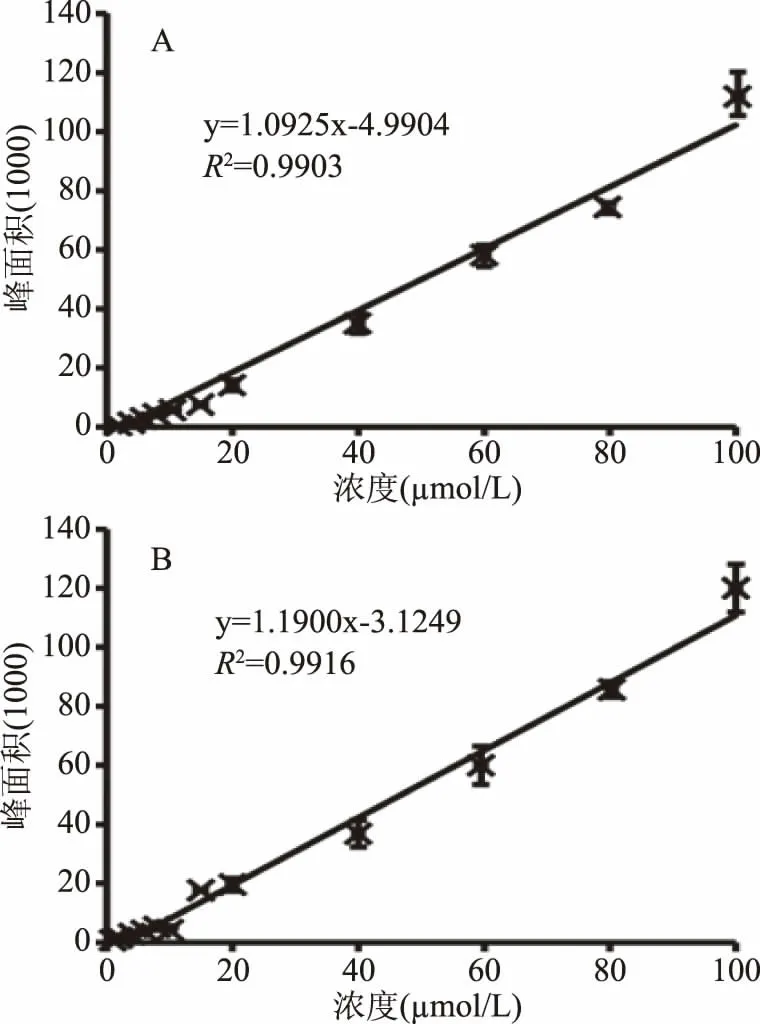
图6 底物浓度与峰面积之间的线性回归分析(n=3)Fig.6 The linear regression analysis between substrate concentration and peak area(n=3)
本研究采用内标法检测了9种禽类蛋黄和蛋清中Neu5Ac的含量(如表1所示)。游离唾液酸经荧光标记物OPD衍生后采用HPLC-FLD进行检测,MS结果显示m/z 382.0([Neu5Ac-OPD+H]+)、396.0([Neu5Prop-OPD+H]+)均与理论值相符,验证了液相色谱中9.1和11.8 min的色谱峰分别为Neu5Ac和Neu5Prop的色谱峰(如图7所示)。研究结果显示蛋清中Neu5Ac的含量在相同物种之间相差不大,但在不同物种之间表现出很大的差异。鹌鹑蛋清中Neu5Ac的含量最低(0.13 mg/g),而鸵鸟蛋清中的最高(2.20 mg/g),比鹌鹑蛋清Neu5Ac含量高出近17倍。蛋黄中Neu5Ac含量的差异较小,鸡蛋黄中含量为0.88 mg/g,鸵鸟蛋黄中含量为0.94 mg/g。检测到鸡蛋中唾液酸的含量与已报道的结果(蛋黄中0.95 mg/g,蛋清中0.1 mg/g)一致[19]。而乌鸡蛋黄和蛋清中Neu5Ac的含量与已报道的含量(蛋黄为7.1 mg/g,蛋清为0.49 mg/g)相比较低,今后需进一步研究种间变异对检测值造成的影响。
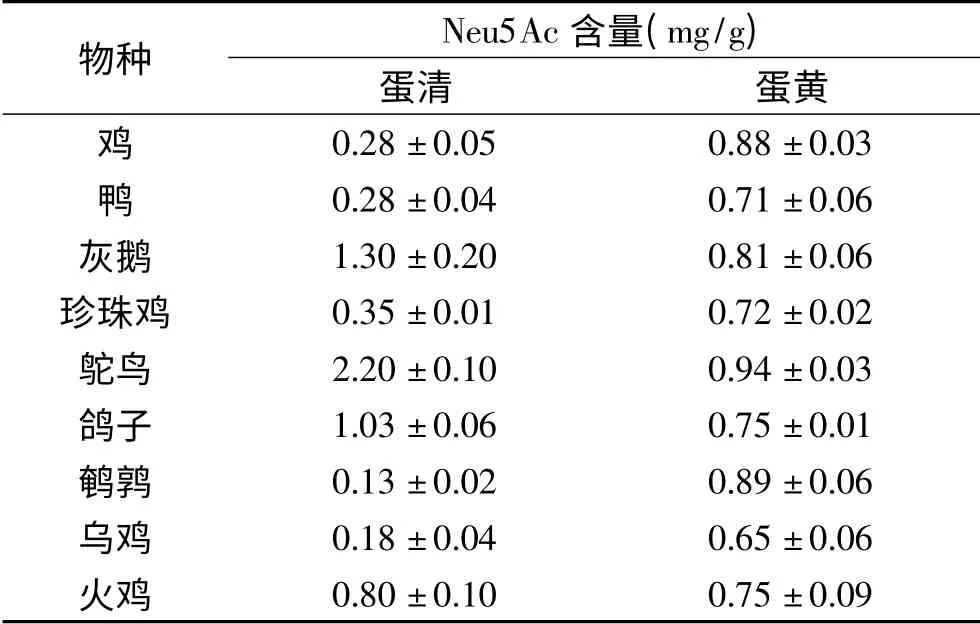
表1 不同种类禽蛋蛋清和蛋黄中Neu5Ac含量(n=3)Table 1 The content of Neu5Ac in egg whites and egg yolks of different species of bird(n=3)
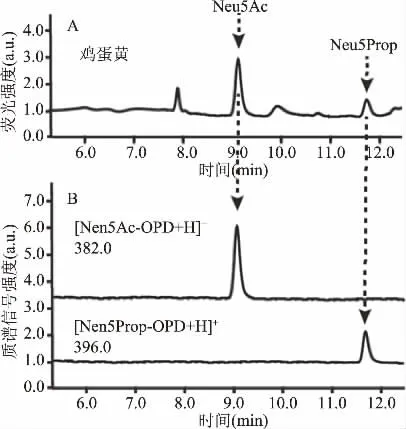
图7 鸡蛋黄中Neu5Ac和内标物Neu5Prop的定性测定Fig.7 Qualitative determination of Neu5Ac and Neu5Prop in egg york
实验以化学酶法合成的X-Gal-α-2,6-Neu5Prop为内标,消除了基质效应对检测结果造成的影响,实现了对禽类蛋清蛋黄中Neu5Ac的准确定量。基质效应通常是指样品在提取或在前处理中引入的其他杂质对检测的选择性和灵敏度造成的影响,进而影响到分析方法的准确度。内标法[27]、基质添加标准曲线法[28]和优化前处理条件[29]等方法是有效消除基质效应的方法。内标定量法是通过测量内标物与目标组分的峰面积的相对值来进行计算,在一定条件上消除了前处理条件变化等所引起的误差,测定结果较为准确。采用内标法消除基质效应时,应选择合适的内标物,本研究中用到的内标物X-Gal-α-2,6-Neu5Prop经酸水解为游离的Neu5Prop,该物质与被检测物质Neu5Ac的结构相似,仅单个侧链基团不同。因此,在液相色谱中与被检测物质有相似的响应值,可减小检测过程中带来的误差。但X-Gal-α-2,6-Neu5Prop不适用于分析样品中含有两种以上与被分析物与不可分离的唾液酸[30]。Cai等[17]应用同位素标记的唾液酸衍生物作为内标物实现了肉类和禽蛋中唾液酸含量的准确测定,但是同位素标记的内标物价格昂贵且不易获取。因此,选择合适的内标物至关重要。
3 结论
本研究采用化学酶法成功地合成了非天然唾液酸衍生物X-Gal-α-2,6-Neu5Prop,对该衍生物在酸性水解条件下水解特性以及稳定性进行了考察。并以该衍生物为内标结合高效液相色谱测定了鹌鹑、鹅、珍珠鸡、鸵鸟、鸭、鸽子、火鸡等9种禽类蛋黄和蛋清中Neu5Ac的含量。研究结果表明,相同浓度的X-Gal-α-2,6-Neu5Ac和X-Gal-α-2,6-Neu5Prop在2 mol/L的醋酸溶液80℃的水解条件下水解程度相当,90 min后能够完全转化为游离的唾液酸。Neu5Ac和Neu5Prop在10 h时仍保持相似的稳定性。蛋清中Neu5Ac的含量在相同物种之间相差不大但在不同物种之间表现出很大的差异。鹌鹑蛋清中Neu5Ac的含量最低(0.13 mg/g),而鸵鸟蛋清中的最高(2.20 mg/g),比鹌鹑蛋清Neu5Ac含量高出近17倍。鸡蛋蛋黄与蛋清中Neu5Ac含量与之前报道的结果一致[19]。本研究涉及的分析方法可行性高,易于操作,重复性强。因此,适于食品和生物样品的常规分析。

