川陈皮素调控LINC00116对结直肠癌细胞生物学功能的影响
孙嘉伟,卢秀,王燕
1济南市第四人民医院,济南 250031;2上海市浦东新区人民医院
在全球范围内,结直肠癌是最常见的癌症类型之一[1]。在结直肠癌的早期阶段(即Ⅰ、Ⅱ期),患者可以接受手术和治愈性治疗,其5年生存率大于60%。但是,超过50%的患者发现时已处于晚期,发生远处转移的风险较高,而这些患者的5年生存率降至10%[2]。由于转移被认为是癌症治疗失败的主要原因,因此开发用于预防和治疗癌症转移的新型药物至关重要。川陈皮素是一种在柑橘类水果中发现的多甲氧基类黄酮,具有抗肿瘤、抗炎、抗氧化、抗高血压和抗菌等作用,对肿瘤细胞的生长、迁移和侵袭表现一定的抑制活性[3-5]。研究发现,川陈皮素及其衍生物通过靶向癌症进展中的多种途径,阻滞细胞周期、抑制细胞增殖、诱导凋亡、防止肿瘤形成、减少炎症作用和限制血管生成[6],但其具体的作用机制尚未完全阐明。长链非编码RNA(lncRNA)是一类大于200个核苷酸的非编码RNA,研究发现lncRNA LINC00116在宫颈癌中高表达,敲除LINC00116可抑制癌细胞增殖、迁移、侵袭[7]。然而,LINC00116在结直肠癌中的生物学作用研究较少。本研究观察了川陈皮素对结直肠癌细胞增殖、凋亡、迁移和侵袭的影响,并对其潜在的分子机制进行探讨。
1 材料与方法
1.1 主要试剂 结直肠癌细胞HCT116购自中国医学科学院基础医学研究所细胞资源中心,RPMI1640培养基购自美国Hyclone公司。细胞HCT116在含10%胎牛血清的RPMI1640培养基中培养,在37℃、5%CO2的环境中生长。川陈皮素(纯度≥98%)购自成都曼斯特生物科技有限公司,磷脂酰结 合 蛋白V-FITC(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒购自江苏凯基生物公司,二辛可宁酸(BCA)试剂盒购自上海碧云天公司,甘油醛-3-磷酸脱氢酶(GAPDH)、P21、含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)、E-钙黏蛋白(Ecadherin)、基质金属蛋白酶2(MMP-2)一抗购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自北京博奥森生物技术有限公司。
1.2 细胞增殖情况观察 采用MTT法。将细胞HCT116以1×104/孔的密度接种到96孔板中,并分别使用0、10、20、40μg/mL川陈皮素处理48 h。每孔加入100μL 0.5 mg/mL MTT溶液,在37℃保持4 h。将反应得到的沉淀物溶于100μL二甲基亚砜中,用酶标仪在490 nm处测定细胞光密度(OD)值,计算细胞存活率。细胞存活率(%)=实验OD值/对照OD值×100%。
1.3 细胞克隆形成检测 采用克隆实验。细胞HCT116以0、10、20、40μg/mL川陈皮素处理48 h,之后将细胞接种于60 mm培养皿,在新鲜培养基中继续培养细胞10~14 d,每4~5 d更换1次培养基。当出现≥50个细胞集落时,磷酸盐缓冲液洗涤3次,甲醇固定20 min和吉姆萨染色30 min,统计克隆形成数。
1.4 细胞凋亡情况观察 使用Annexin V-FITC/PI细胞凋亡检测试剂盒对细胞凋亡进行评估。收集0、10、20、40μg/mL川陈皮素处理48 h的细胞HCT116。在细胞HCT116的单细胞悬液(1×106/mL)中加入5μL Annexin V-FITC和5μL PI,在室温下于黑暗处孵育15 min。流式细胞仪检测细胞凋亡率。
1.5 细胞迁移和侵袭能力检测 细胞HCT116用0、10、20、40μg/mL川陈皮素处理48 h,之后收获细胞,以Transwell小室法检测细胞的迁移和侵袭能力。检测细胞侵袭时,Transwell上室用100μL的Matrigel胶包被,静置3~4 h(检测细胞迁移时不加Matrigel胶)。将细胞HCT116重悬于无血清RPMI1640培养基,制成1×106/mL的密度,接种100μL于Transwell上室,并在下室添加含10%胎牛血清的RPMI1640培养基。37℃培养24 h后,除去上室的Matrigel胶和细胞,甲醛固定和结晶紫染色,统计迁移、侵袭细胞数。
1.6 细胞中P21、Caspase-3、E-cadherin、MMP-2蛋白检测 采用Western blotting法。0、10、20、40μg/mL川陈皮素处理细胞HCT116后,用预冷细胞裂解缓冲液冰上提取总蛋白,经BCA试剂盒定量,取30μg的蛋白在10%SDS-PAGE凝胶上分离,并转移到PVDF膜,在5%脱脂牛奶中封闭1 h。然后用1∶1 000稀释的P21、Caspase-3、E-cadherin、MMP-2和GAPDH(对照)的一抗,在4℃下孵育过夜。TBST洗涤10 min,3次后将PVDF膜与辣根过氧化物酶(HRP)标记的二抗孵育1 h,膜用TBST清洗10 min,3次后用增强的化学发光法显影蛋白条带。在ImageJ软件中通过光密度分析法检测P21、Caspase-3、E-cadherin、MMP-2蛋白。
1.7 细胞中LINC00116表达检测 采用实时荧光定量PCR。根据TRIzol试剂说明提取细胞HCT116的总RNA。参照TaKaRa公司Reverse Transcription Reagent试剂盒的步骤将总RNA反转录为cDNA。PCR反应使用引物和SYBR Green PCR试剂盒进行。LINC00116引物序列为5'-CATGGCGGATGTGTCAGAGA-3'(正向),5'-GCCTCCTTTTCCTCCAGTCC-3'(反向);内参U6引物序列为5'-CTCGCTTCGGCAGCACATATACTA-3'(正向),5'-ACGAATTTGCGTGTCATCCTTGCG-3'(反向)。使 用2-ΔΔCt法 计 算LINC00116相对表达量。
1.8 细胞转染 将细胞HCT116接种于6孔板,分为si-NC组、si-LINC00116组、NOB+pcDNA3.1组、NOB+pcDNA3.1-LINC00116组。细胞汇合至70%左右时,按照Lipofectamine2000试剂说明书的步骤,在细胞中分别转染si-NC、si-LINC00116、pcDNA3.1、pcDNA3.1-LINC00116。转染24 h后,NOB+pcDNA3.1组、NOB+pcDNA3.1-LINC00116组使用40μg/mL川陈皮素处理48 h。依照1.2~1.7所述方法检测各项指标。
1.9 统计学方法 采用SPSS22.0统计软件。计量资料以±s表示,两组间比较采用配对t检验,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 川陈皮素对细胞HCT116增殖、凋亡的影响见表1。
表1 不同浓度川陈皮素对细胞HCT116增殖、凋亡的影响(±s)

表1 不同浓度川陈皮素对细胞HCT116增殖、凋亡的影响(±s)
注:与0时相比,*P<0.05。
?
2.2 川陈皮素对细胞HCT116迁移、侵袭的影响 见表2。
表2 不同浓度川陈皮素对细胞HCT116迁移、侵袭的影响(±s)

表2 不同浓度川陈皮素对细胞HCT116迁移、侵袭的影响(±s)
注:与0时相比,*P<0.05。
?
2.3 川陈皮素对细胞HCT116中LINC00116表达的影响 0、10、20、40μg/mL川陈皮素处理细胞HCT116中的LINC00116相对表达量分别为1.02±0.10、0.78±0.08、0.56±0.05、0.34±0.03,川陈皮素减少细胞HCT116中LINC00116的表达(P均<0.05)。
2.4 抑制LINC00116对细胞HCT116增殖、凋亡、迁移、侵袭的影响 si-NC组、si-LINC00116组LINC00116相对表达量分别为1.03±0.10、0.28±0.03,两组相比P<0.05。抑制LINC00116对细胞HCT116增殖、凋亡、迁移、侵袭的影响见表3、4。
表3 抑制LINC00116对细胞HCT116增殖、凋亡的影响(±s)

表3 抑制LINC00116对细胞HCT116增殖、凋亡的影响(±s)
注:与si-NC组相比,*P<0.05。
?
表4 抑制LINC00116对细胞HCT116迁移、侵袭的影响(±s)
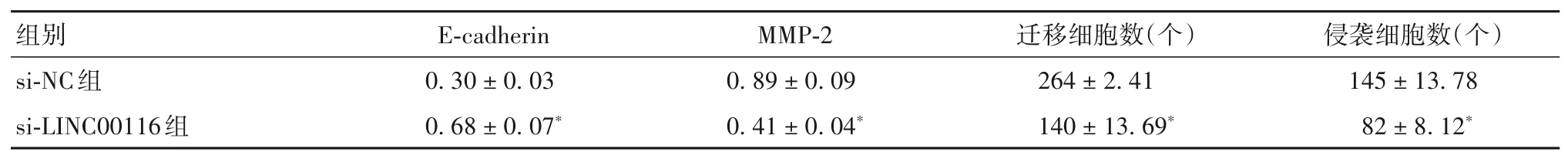
表4 抑制LINC00116对细胞HCT116迁移、侵袭的影响(±s)
注:与si-NC组相比,*P<0.05。
?
2.5 过表达LINC00116对川陈皮素作用的细胞HCT116增殖、凋亡的影响 NOB+pcDNA3.1组、NOB+pcDNA3.1-LINC00116组LINC00116相对表达量分别为1.00±0.10、2.36±0.23,两组相比P<0.05。过表达LINC00116对川陈皮素作用的细胞HCT116增殖、凋亡、迁移、侵袭的影响见表5、6。
表5 过表达LINC00116对川陈皮素作用的细胞HCT116增殖、凋亡的影响(±s)

表5 过表达LINC00116对川陈皮素作用的细胞HCT116增殖、凋亡的影响(±s)
注:与NOB+pcDNA3.1组相比,*P<0.05。
?
表6 过表达LINC00116对川陈皮素作用的细胞HCT116迁移、侵袭的影响(±s)

表6 过表达LINC00116对川陈皮素作用的细胞HCT116迁移、侵袭的影响(±s)
注:与NOB+pcDNA3.1组相比,*P<0.05。
?
3 讨论
结直肠癌是一种常见的胃肠道恶性肿瘤,也是人类癌症相关死亡的主要原因之一[8]。罹患结直肠癌的风险与个人特征或习惯(如年龄、慢性病史和生活方式)多种危险因素相关[9]。在临床实践中,手术、化疗和放疗仍然是结直肠癌的主要治疗策略[10]。但是,结直肠癌患者的预后仍然很差,特别是对于转移性结直肠癌患者[11]。因此,开发新的抗肿瘤药物是结直肠癌管理策略的重点。天然化合物已被用于治疗癌症多年,其毒副作用比非天然抗癌药物少。然而,天然来源的药物缺乏特定的靶标[12]。因此,研究天然产物的靶向治疗极具意义。本文研究了一种天然黄酮类化合物——川陈皮素,它可充当针对各种癌症的抗癌剂。
以往的研究已经证明了川陈皮素在多种肿瘤细胞系和肿瘤模型如膀胱癌、肺癌和前列腺癌中的生长抑制作用[13-15]。川陈皮素的抗癌功能包括抑制增殖、迁移、侵袭和血管生成,如川陈皮素以剂量和时间依赖的方式抑制人鼻咽癌C666-1细胞的活力,以剂量依赖的方式诱导细胞凋亡[16],还可显著抑制鼻咽癌HONE-1和NPC-BM细胞系的迁移、侵袭能力,下调MMP-2表达[17]。川陈皮素的代谢物与他汀类药物通过诱导G0/G1细胞周期停滞和凋亡而协同抑制人结肠癌细胞的生长[18]。本研究中,川陈皮素减少细胞HCT116的存活率、克隆形成数、迁移细胞数、侵袭细胞数、MMP-2蛋白表达,提高细胞凋亡率及P21、Caspase-3、E-cadherin蛋白表达,且作用效果随浓度增加而逐渐增强。川陈皮素显现出一定的抗结直肠癌活性,可以下调MMP-2和上调P21、Caspase-3、E-cadherin表达抑制结直肠癌细胞增殖、迁移、侵袭、凋亡,进而发挥其抗肿瘤作用,这提示富含川陈皮素的药物可能在结直肠癌的治疗中有一定的前景。
lncRNA在多种细胞过程中发挥重要的调节作用,例如细胞增殖、凋亡、分化和侵袭[19]。随着对结直肠癌发病相关分子机制的深入研究,lncRNA被认为是结直肠癌发生和发展的关键调控因子[20-22]。LINC00116是新发现的一种lncRNA,编码高度保守的56个氨基酸的微蛋白[23]。LINC00116编码连接呼吸和脂质代谢的线粒体肽[24],与脊椎关节炎/强直性脊柱炎密切相关[25],然而对于LINC00116的生物学功能研究较少。本研究发现,抑制LINC00116降低细胞HCT116的细胞存活率、克隆形成数、迁移细胞数、侵袭细胞数、MMP-2蛋白表达,增加细胞凋亡率及P21、Caspase-3、E-cadherin蛋白表达,表明抑制LINC00116可以抑制结直肠癌细胞的增殖、迁移和侵袭能力,与LAI等[7]的研究一致。同时,抑制LINC00116还可诱导结直肠癌细胞凋亡。可见LINC00116是一种促癌lncRNA,抑制其表达将有助于阻碍结直肠癌的恶性进展。为了揭示川陈皮素的抗肿瘤机制,在结直肠癌细胞中检测了LINC00116的表达及作用。发现不同浓度的川陈皮素减少细胞HCT116中LINC00116的表达,提示调控结直肠癌细胞中LINC00116的表达可能是川陈皮素发挥抗肿瘤作用的重要途径。此外,过表达LINC00116增加川陈皮素作用的细胞HCT116的细胞存活率、克隆形成数、迁移细胞数、侵袭细胞数、MMP-2蛋白表达,降低凋亡率及P21、Caspase-3、E-cadherin蛋白表达。这些结果说明,川陈皮素抑制结直肠癌细胞增殖、迁移和侵袭,并诱导其凋亡的作用可能是通过下调LINC00116的表达来实现的。
综上所述,川陈皮素可以抑制结直肠癌细胞的增殖、迁移和侵袭能力,并诱导细胞凋亡。抑制LINC00116同样具有抗结直肠癌细胞增殖、迁移和侵袭,及促进细胞凋亡的作用。另外,川陈皮素抗结直肠癌活性与调控LINC00116的表达有关。这为结直肠癌的治疗策略提供了新的线索。

