PD-1抑制剂联合化疗治疗晚期胃癌临床观察
刘文博,赵赟博
北京医院国家老年医学中心中国医学科学院老年医学研究院,北京 100730
胃癌在中国恶性肿瘤发病率排第二位,年发病数41万,病死率排第3位,年死亡数29.4万[1]。晚期胃癌的治疗以全身化疗为主,化疗药物包括氟尿嘧啶类药物、铂类药物、紫杉醇、多西他赛、伊立替康等,其中位总生存期为10~12个月。随着抗HER-2靶向药物曲妥珠单抗,以及抗血管生成靶向药物雷莫卢单抗及阿帕替尼应用于晚期胃癌,其中位总生存期有所延长,但延长有限[2-3]。新的晚期胃癌治疗方案值得探索。程序性死亡蛋白1(PD-1)主要表达于活化的T细胞、B细胞、树突状细胞、自然杀伤细胞上,它与表达于肿瘤细胞表面的PD-1配体(PD-L1)相结合可使免疫细胞失活,并发生免疫抑制作用[4]。PD-1抑制剂将两者阻断后,可重新激活人体自身的免疫细胞,发挥识别、杀伤肿瘤细胞的作用。近年来,PD-1抑制剂在多种晚期实体肿瘤(包括恶性黑色素瘤、非小细胞肺癌、头颈部鳞癌)中展现出较好疗效[5],也在晚期胃癌治疗中展现出效果[6-7]。基础研究表明,化疗与PD-1抑制剂具有协同抗肿瘤作用[8-9],PD-1抑制剂联合化疗在晚期胃癌治疗中受到关注。本研究回顾性分析了PD-1抑制剂联合化疗治疗晚期胃癌的安全性及有效性。
1 资料与方法
1.1 临床资料 收集2019年6月—2020年10月北京医院收治的32例晚期胃癌患者,其中男20例,女12例;中位年龄57.5(54.0~62.0)岁;美国东部肿瘤协作组体能状态(ECOG-PS)评分0分13例,1分19例;原发灶为胃癌23例,胃食管结合部癌9例;转移部位位于腹腔淋巴结20例、肝脏14例、腹膜11例。19例患者PD-L1检测结果阳性(阳性标准为联合阳性分数CPS≥1),13例患者PD-L1状态不明。纳入标准:①经组织学或细胞学证实的胃癌或胃食管结合部癌;②存在腹腔转移或其他远处转移,无法行根治性手术治疗;③ECOG-PS评分0或1分;④初诊初治,或接受过一线化疗但肿瘤再次进展;⑤至少有一个可测量病灶;⑥接受PD-1抑制剂治疗联合化疗;⑦临床资料完整。排除标准:①胃癌病理基因检测提示HER2扩增者;②存在严重器官功能不全者。本研究经北京医院医学伦理委员会备案,患者均签署知情同意书。
1.2 PD-1抑制剂治疗联合化疗方法 21例患者为初诊初治,接受免疫联合化疗为一线抗肿瘤治疗,11例患者曾接受过一线化疗,免疫联合化疗为二线抗肿瘤治疗。联合化疗方案为规范一线及二线化疗方案,10例患者联合奥沙利铂及卡培他滨化疗,12例患者联合奥沙利铂及替吉奥化疗,10例患者联合白蛋白结合型紫杉醇及替吉奥化疗。患者接受PD-1抑制剂治疗联合化疗,21 d为1个周期。PD-1抑制剂包括帕博利珠单抗(200 mg)、纳武利尤单抗(200 mg)、信迪利单抗(200 mg)、卡瑞利珠单抗(200 mg)、特瑞普利单抗(240 mg),每周期第1天静脉滴注。化疗方案包括奥沙利铂及卡培他滨(奥沙利铂130 mg/m2第1天静脉滴注;卡培他滨1 000 mg/m2从第1天开始连续口服14 d,2次/天),奥沙利铂及替吉奥(奥沙利铂130 mg/m2第1天静脉滴注;替吉奥40 mg/m2从第1天开始连续口服14 d,2次/天),白蛋白结合型紫杉醇及替吉奥(白蛋白结合型紫杉醇120 mg/m2第1天、第8天静脉滴注;替吉奥40 mg/m2从第1天开始连续口服14 d,2次/天)。PD-1抑制剂联合化疗6周期后,应用PD-1抑制剂初始剂量维持治疗,21 d为1个周期,每周期第1天给药。如果患者药物耐受情况良好,可联合卡培他滨(1 000 mg/m2从第1天开始连续口服14 d,2次/天,21 d为1个周期)或替吉奥(40 mg/m2从第1天开始连续口服14 d,2次/天,21 d为1个周期)治疗,直至出现疾病进展、死亡或不能耐受的毒性反应。
1.3 疗效评价及不良反应评价 依据RECIST1.1版进行疗效评价,评价结果为完全缓解(CR),即目标病灶完全消失;部分缓解(PR),即目标病灶缩小≥30%;疾病进展(PD),即目标病灶增大≥20%,或出现新发病灶;疾病稳定(SD),即目标病灶介于PR与PD之间。用药每3周期评价1次,记录最好疗效评价结果,计算客观缓解率(ORR,CR+PR的患者数占患者总数百分比)、疾病控制率(DCR,CR+PR+SD的患者数占患者总数百分比),记录无进展生存期(PFS,开始接受治疗至肿瘤进展或死亡的时间)。治疗过程中门诊随访及入院治疗前记录药物相关不良反应,根据美国国立癌症研究所推荐的不良事件标准(NCI-CTCAE)4.0版进行评价。
1.4 统计学方法 采用SPSS22.0统计软件。患者的一般人口学及疾病特征采用描述性统计分析;符合偏态分布的计量资料采用中位数(四分位间距)表示;计数资料采用例数(百分比)表示;采用单因素Cox比例风险回归模型分析PFS的相关因素。P<0.05为差异有统计学意义。
2 结果
Cox回归单因素分析结果显示,年龄、性别、ECOG-PS评分、治疗线数、PD-L1状态、联合化疗方案均与PFS无相关性,见表1。
2.1 疗效 32例接受PD-1抑制剂联合化疗患者,达到PR 25例(78.1%),SD 7例(21.9%),ORR为78.1%(95%C I:63.8%~92.5%),DCR为96.9%,中位PFS为9.0(95%C I:7.3~9.6)个月。PD-L1阳性患者ORR为79.0%,PD-L1不明患者ORR为77.0%。接受奥沙利铂及卡培他滨治疗者ORR分别为80.0%,奥沙利铂及替吉奥治疗者ORR为75.0%,白蛋白紫杉醇及替吉奥治疗者ORR为80.0%。
2.2 不良反应 32例患者发生了不同程度不良反应,发生率最高的是白细胞减少(16例),其次是食欲减退(14例),血小板减少(14例),恶心(12例),转氨酶升高(11例),腹泻(9例),贫血(8例),乏力(8例),呕吐(5例),皮疹(4例),口腔黏膜炎(3例),免疫性肺炎(2例),免疫性肠炎(2例),甲状腺功能减退(2例),体表毛细血管增生(2例)和1型糖尿病(1例)。17例发生3/4级不良反应,其中发生率最高的是白细胞减少(5例),其次是血小板减少(4例),周围神经损伤(3例),贫血(2例),转氨酶升高(2例),口腔黏膜炎(1例),腹泻(1例),呕吐(1例),甲状腺功能减退(1例)和1型糖尿病(1例)。2例患者分别因为4度肝功能损伤、4度血小板减少中断治疗,在对症支持治疗后恢复,无药物导致死亡发生。
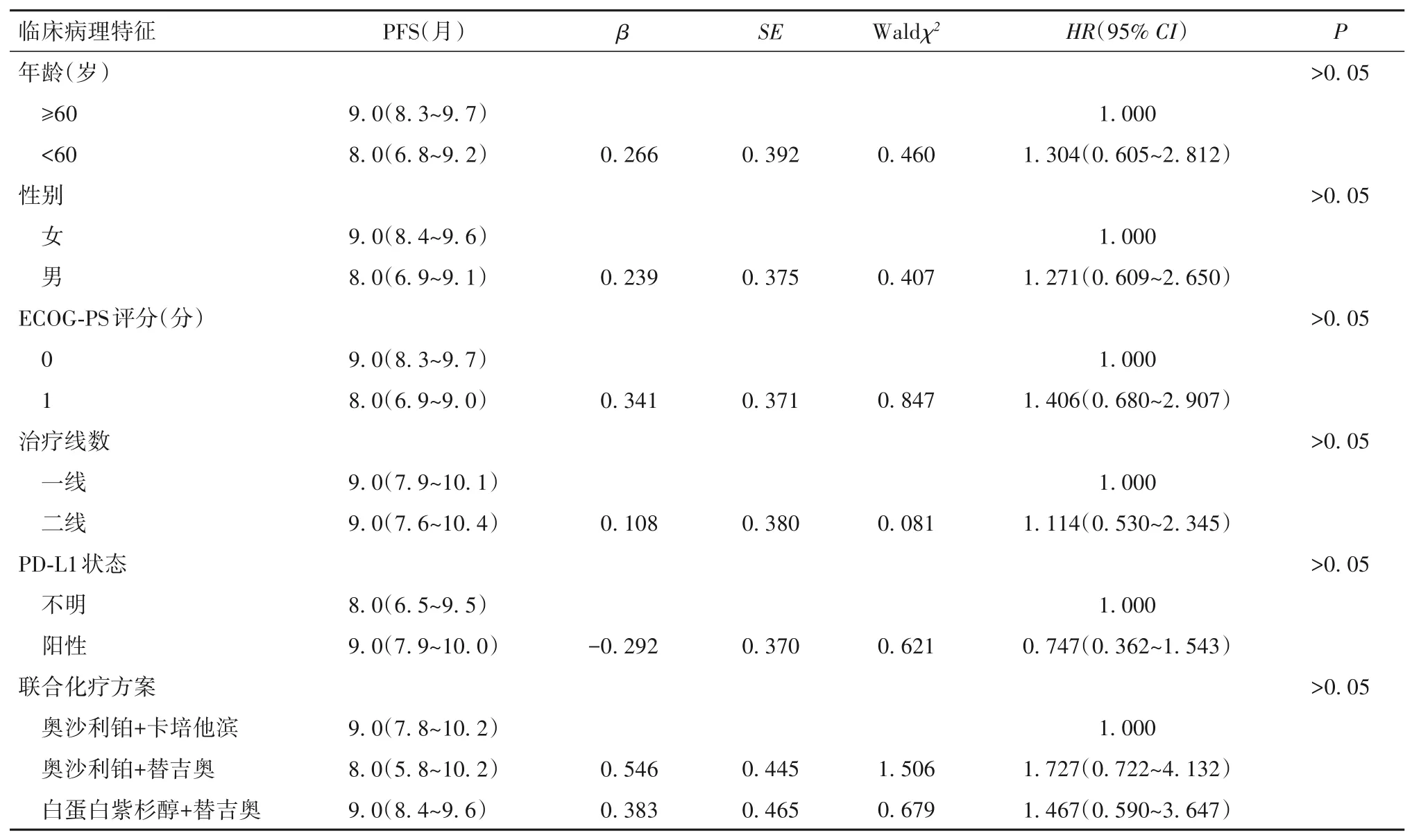
表1 影响晚期胃癌患者PFS的单因素分析结果
3 讨论
胃癌具有发病率高、病死率高的特点,大部分胃癌起病隐匿,发现时已失去根治性手术机会。化疗目前是晚期胃癌治疗的基础,但疗效有限。日本的一项Ⅲ期临床试验显示,奥沙利铂联合替吉奥一线治疗胃癌的ORR为56%~59%,PFS为5.5~6.5个月[10-11]。一项临床研究显示,白蛋白紫杉醇联合替吉奥一线治疗晚期胃癌ORR为54.5%,PFS为5.8个月[12]。靶向药物可以使晚期胃癌患者从治疗中获益,在基因检测HER扩增的患者中,TOGA研究证实曲妥珠单抗联合化疗可延长总生存期至13.8个月[2]。近年来,PD-1抑制剂已成功应用于各种实体肿瘤的治疗,适应证主要包括黑色素瘤和非小细胞肺癌,在肝癌、膀胱癌、肾癌的治疗中也表现出较好的疗效[5]。临床试验表明,晚期胃癌患者同样可以从PD-1抑制剂治疗中获益。在KEYNOTE-012临床试验中,PD-1抑制剂帕博利珠单抗单药治疗化疗失败后晚期胃癌患者的ORR可达22%[6]。在ATTRACTION-2临床试验中,PD-1抑制剂纳武利尤单抗单药治疗既往化疗失败晚期胃癌,可延长患者总生存期至5.3个月,对比安慰剂有统计学差异[7]。
研究表明,化疗与PD-1抑制剂具有协同抗肿瘤作用,化疗可增强肿瘤细胞免疫原性、促进抗原递呈、清除宿主细胞内免疫抑制细胞,从而增强肿瘤免疫应答,而PD-1抑制剂能通过增强抗肿瘤的免疫反应提高化疗的敏感性[8-9]。因此研究者们在临床试验中不断探索PD-1抑制剂联合化疗治疗晚期胃癌的效果。在KEYNOTE-059临床试验中,针对一线晚期胃/胃食管结合部癌,PD-1抑制剂帕博利珠单抗联合化疗(5-Fu+顺铂或卡培他滨)有效率为60.0%(95%C I:38.7%~78.9%)[13]。在KENOTE-062临床试验中[14],接受帕博利珠单抗联合顺铂及5-Fu(或卡培他滨)化疗方案一线治疗晚期胃癌患者ORR为48.6%(CPS≥1)和52.5%(CPS≥10),PFS可达6.9个月(CPS≥1)和5.7个月(CPS≥10)。在ATTRACTION-4临床试验的第一部分中,接受纳武利尤单抗联合替吉奥及奥沙利铂方案化疗一线治疗晚期胃癌患者ORR达到57.1%,PFS为9.7个月,接受纳武利尤单抗联合卡培他滨及奥沙利铂方案化疗患者ORR达到76.5%,PFS为10.6个月[15]。在日本的KENOTE-659临床试验中,帕博利珠单抗联合替吉奥及奥沙利铂方案化疗一线治疗晚期胃癌,ORR可达72.2%,PFS为9.4个月[16]。
本研究回顾分析了PD-1抑制剂联合化疗治疗32例晚期胃癌的临床资料,其中一线治疗的患者占65.6%,二线治疗的患者占34.4%,PD-L1阳性(CPS≥1)患者占59.4%,PD-L1状态未检测者占40.6%。全组患者ORR达到78.1%,PFS达到9.0个月,ORR高于KENOTE-059及KENOTE-062研究[13-14],略高于亚洲人群的ARRACTION-4和KENOTE-659试验[15-16]。本研究为回顾性研究,化疗选择更加优化,可能提升了治疗疗效。
药物安全性方面,本研究中不良反应与传统化疗不良反应及既往临床试验中报道过的PD-1抑制剂不良反应一致,未出现非预期的不良反应。主要有白细胞减少、食欲减退、血小板减少、恶心、转氨酶升高、腹泻等[13-16]。免疫相关不良反应发生率相对较低,主要有免疫性肺炎、免疫性肠炎、免疫性甲状腺功能损伤和1型糖尿病,有2例患者发生了卡瑞利珠单抗相关的体表毛细血管增生。17例发生3/4级不良反应,其中发生率较高的是白细胞减少、血小板减少和周围神经损伤,与传统化疗类似。
本研究结果显示PD-L1状态及CPS评分与晚期胃癌患者接受PD-1抑制剂联合化疗的PFS无明显相关性,这与既往临床研究结果类似。KENOTE-062试验显示[14],在CPS≥1和CPS≥10人群中,帕博利珠单抗联合顺铂及5-Fu(或卡培他滨)的化疗方案对比单纯化疗一线治疗晚期胃癌没有达到总生存获益,但是ORR有提升。在ATTRACTION-4临床试验中,PD-L1阳性患者对比阴性患者,纳武利尤单抗联合替吉奥及奥沙利铂方案化疗ORR分别为50.0%(2/4)及58.8%(10/17),纳武利尤单抗联合卡培他滨及奥沙利铂方案化疗ORR分别为100.0%(1/1)及75.0%(12/16)[15]。KENOTE-659临床试验全部入组PD-L1阳性患者,帕博利珠单抗联合替吉奥及奥沙利铂方案化疗,在CPS≥1人群中ORR为73.9%,在CPS≥10人群中ORR为71.0%[16]。KENOTE-859、CheckMate-649研究也继续探讨了PD-L1表达与PD-1抑制剂联合化疗对晚期胃癌疗效的关系。本研究同时显示PD-1抑制剂联合不同化疗方案与PFS无相关性。在ATTRACTION-4临床试验中,纳武利尤单抗联合替吉奥及奥沙利铂方案化疗一线治疗晚期胃癌ORR达到57.1%,PFS为9.7个月,纳武利尤单抗联合卡培他滨及奥沙利铂方案化疗ORR达到76.5%,PFS为10.6个月,两者无统计学差异,结果与本研究一致[15]。
本研究是回顾性分析,且样本量较小,仍存在一定的局限性。总之,PD-1抑制剂联合化疗对于晚期胃癌患者具有较好疗效,不良反应可控,值得进一步研究探索。

