产黄青霉β-甘露聚糖酶的高效表达、性质及应用
甄红敏,华晓晗,马俊文,温永平,3,李延啸,*,闫巧娟,*,江正强
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.中国农业大学工学院,北京 100083;3.蒙牛高科乳制品(北京)有限责任公司,北京 100101)
β-甘露聚糖酶是一种能够特异性水解甘露聚糖主链中β-1,4-糖苷键的水解酶,产物主要为不同聚合度的甘露寡糖[1]。β-甘露聚糖酶在细菌、放线菌、真菌、植物和一些低等动物中广泛存在,微生物来源的β-甘露聚糖酶产量高、成本低、提取简单,因而最具应用潜力[2]。根据氨基酸序列相似性,β-甘露聚糖酶可分为4 个糖苷水解酶(glycoside hydrolases,GH)家族,即GH5、GH26、GH113和GH134家族。大部分动植物和真菌来源的β-甘露聚糖酶和部分细菌β-甘露聚糖酶属于GH5家族,多数细菌β-甘露聚糖酶和少数真菌β-甘露聚糖酶则属于GH26家族[3]。GH113家族的β-甘露聚糖酶主要来源于脂环酸芽孢杆菌(Alicyclobacillussp.)等少数细菌[4];GH134家族的β-甘露聚糖酶则主要来源于构巢曲霉(Aspergillus nidulans)和微孢根霉(Rhizopus microsporus)等[5]。作为一种重要的糖苷水解酶,β-甘露聚糖酶的应用范围已涵盖食品、饲料、造纸等多个行业[6]。
生产甘露寡糖是β-甘露聚糖酶的一个重要应用。甘露寡糖的制备方法主要包括物理降解、化学降解以及酶法降解[7-9]。与物理和化学法相比,酶法降解条件温和、过程可控、成本低廉、环境友好,是制备甘露寡糖最常用的方法。目前,甘露寡糖已被证实具有促进益生菌增殖、降低血脂、控制血糖等功能活性[10]。实现β-甘露聚糖酶的高效表达,是应用于甘露寡糖生产的前提和基础。虽然一些β-甘露聚糖酶已在毕赤酵母(Pichia pastoris)中进行高效表达,但它们大多数属于GH5家族,如米黑根毛霉(R. miehei)来源的RmMan5A、mRmMan5A和毛壳菌(Chaetomiumsp.)来源的CsMan5A等[11-13],仅有少数GH26家族β-甘露聚糖酶在毕赤酵母中实现了高效表达,如芽孢杆菌(Bacillussp.)来源的mannS和Bman26/MEIR[14-15]。这些GH26家族的β-甘露聚糖酶难以满足不同大规模应用的需要。此外,不同家族β-甘露聚糖酶的水解特性明显不同,如毛壳菌CQ31来源的GH5家族β-甘露聚糖酶CsMan5A水解魔芋粉等甘露聚糖主要产生聚合度2~4的寡糖和一些甘露糖[11];牛瘤胃宏基因组来源的GH26家族β-甘露聚糖酶CrMan26的最佳水解底物为角豆胶等半乳甘露聚糖[16]。不同来源β-甘露聚糖酶水解魔芋粉所得产物也有所不同,如Talaromyces cellulolyticus来源的β-甘露聚糖酶水解魔芋粉可获得聚合度3~7的甘露寡糖,单糖组分含量较少[17];而枯草芽孢杆菌(Bacillus subtilis)来源的β-甘露聚糖酶水解魔芋粉,甘露寡糖得率为57.8%,且会产生较多的甘露糖和葡萄糖[18]。因此,开发更多适用于甘露寡糖生产的甘露聚糖酶,并实现其高效生产,对甘露寡糖的生产具有重要意义。
产黄青霉(Penicillium chrysogenum)是一种重要的工业用真菌,主要用于生产青霉素和多种有机酸,同时能够分泌木聚糖酶、淀粉酶等多种糖苷水解酶[19-20]。本研究从产黄青霉基因组中发掘出一个假想蛋白(GenBank No.CAP97963.1),预测为GH26家族β-甘露聚糖酶(PcMan26A),将其基因导入毕赤酵母GS115中高效表达,研究该酶酶学性质,并用于水解魔芋粉制备魔芋甘露寡糖,旨在为利用魔芋粉制备魔芋甘露寡糖提供更多选择。
1 材料与方法
1.1 材料与试剂
毕赤酵母GS115 北京全式金生物技术有限公司;载体pPIC9K 美国Invitrogen公司;甘露寡糖(甘露二糖、甘露三糖、甘露四糖、甘露五糖) 爱尔兰Megazyme公司;槐豆胶、瓜尔胶 美国Sigma-Aldrich公司;魔芋粉(葡甘露聚糖含量≥80%,甘露糖/葡萄糖=1.62) 湖北强森魔芋科技有限公司。
1.2 仪器与设备
1260 Infinity II system高效液相色谱仪、1260 Infinity system凝胶排阻色谱仪、G7162A型示差折光检测器美国Agilent公司;ÄKTA蛋白纯化系统 美国GE Healthcare公司;5 L发酵罐 上海国强生化工程装备有限公司。
1.3 方法
1.3.1β-甘露聚糖酶基因(PcMan26A)的克隆及表达
根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)信息,发掘出一段预测为GH26家族β-甘露聚糖酶基因(GenBank Accession No.CAP97963.1)。根据该基因序列设计特异性扩增引物PcMan26AF(5′-GATCCTCCGGA ATTCGCTGGTTTGTCTTACGATAATATTGATAA-3′)和PcMan26AR(5′-GATACAAGCGGCCGCTTAATTCT TTTTCTTATCCTCAATAGTAACAAC-3′),以产黄青霉的cDNA为模板扩增该基因(PcMan26A)。聚合酶链式反应扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,30 个循环;72 ℃延伸8 min。扩增产物经限制性内切酶EcoRI和NotI双酶切后与载体pPIC9K连接,得到重组质粒pPIC9K-PcMan26A,利用限制性内切酶SalI线性化后电转化毕赤酵母感受态细胞。β-甘露聚糖酶的分泌表达及高拷贝转化子的筛选参考Li Yanxiao等[12]的方法。高拷贝转化子筛选时,用2~3 mL无菌水重悬MD培养基上的重组菌,分别涂布在含有不同质量浓度(1.0~8.0 mg/mL)遗传霉素G418的YPD-G418筛选培养基上,在30 ℃倒置培养3 d。挑取筛选培养基上的单菌落接种于5 mL甘油发酵(buffered minimal glycerol-complex medium,BMGY)培养基,在30 ℃、200 r/min下振荡培养至OD600nm达2~6,3 000×g离心5 min收集细胞,重悬于10 mL诱导表达(buffered methanol-complex medium,BMMY)培养基进行诱导表达,每24 h加甲醇(终体积分数0.5%),诱导3 d后测定酶活力。
1.3.2 高密度发酵产PcMan26A
利用5 L发酵罐进行毕赤酵母高密度发酵,方法参考文献[21]。在200 mL BMGY培养基中接种重组毕赤酵母,于30 ℃、200 r/min培养至OD600nm达到10.0,得到种子液;发酵罐内1.5 L BSM培养基灭菌后,用氨水调节pH值至4.0,温度30 ℃,转速600 r/min,通气量1 vvm;随后将种子液接种于发酵罐中,发酵18~24 h,罐内甘油耗尽后,继续流加甘油4~5 h;待发酵液OD600nm达180~220,饥饿30 min;随后流加100%甲醇诱导培养基,并调节pH值至6.0、转速800 r/min、通气量1.5 vvm,通过控制流加速度和空气流量使罐内溶氧保持在20%以上,继续发酵168 h,并每隔12 h取样,分析PcMan26A酶活力、蛋白含量和菌体湿质量。
1.3.3PcMan26A的纯化
发酵液10 000×g离心10 min,上清液4 ℃透析12 h,透析液为20 mmol/L Tris-HCl缓冲液(pH 8.0)。利用Q-Sepharose阴离子交换层析纯化PcMan26A,用Tris-HCl缓冲液(20 mmol/L,pH 8.0)平衡Q-Sepharose柱,上样后用0~500 mmol/L NaCl溶液(20 mmol/L Tris-HCl缓冲液,pH 8.0)线性洗脱(12 个柱体积),流速为1.0 mL/min,整个过程在ÄKTA纯化系统上进行。收集有酶活力的组分4 ℃透析12 h,透析液为20 mmol/L醋酸缓冲液(pH 6.0)。用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分析纯酶和Endo H处理后的酶[22]。
对PcMan26A进行酶谱分析时,在分离胶中添加1 mg/mL槐豆胶,电泳结束后用25%(V/V)异丙醇溶液浸泡3 次(15 min/次),用50 mmol/L醋酸缓冲液(pH 6.0)漂洗电泳胶3 次(10 min/次),随后将电泳胶浸泡于50 mmol/L醋酸缓冲液(pH 6.0)置于40 ℃反应30 min,并用0.5 g/L刚果红溶液染色20 min,再用1 mol/L NaCl溶液脱色20 min,最后用0.5%(V/V)乙酸溶液定色。
1.3.4PcMan26A酶活力和蛋白浓度的测定
以甘露糖为标准,用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定PcMan26A酶活力[23]。将900 μL槐豆胶溶液(5 mg/mL,50 mmol/L醋酸缓冲液,pH 6.0)与100 μL稀释后的酶液混合均匀后,50 ℃反应10 min,加入1 mL DNS试剂沸水浴15 min显色,随后加入1 mL 40%酒石酸钾钠溶液并迅速冷却,在540 nm波长处测定吸光度。酶活力定义:每分钟产生1 μmol还原糖所需要的酶量为一个酶活力单位(U)。以牛血清蛋白为标准,参照Lowry等[24]的方法测定蛋白含量。
1.3.5PcMan26A的酶学性质
测定最适pH值时,用50 mmol/L不同pH值的缓冲液按照标准方法测定酶活力,以最高酶活力为100%,计算各pH值下的相对酶活力。缓冲体系为:柠檬酸缓冲液(pH 3.0~6.0)、醋酸缓冲液(pH 4.0~6.0)、MES缓冲液(pH 5.5~6.5)、磷酸缓冲液(pH 6.0~8.0)、HEPS缓冲液(pH 6.5~8.0)和CHES缓冲液(pH 8.0~10.0)。测定pH值稳定性时,用上述缓冲液稀释酶液,并在30 ℃保温30 min,按标准方法测定酶活力,以未经处理的酶液为100%,计算各pH值下的残余酶活力。
测定最适温度时,在30~70 ℃按照标准方法测定酶活力,以最高酶活力为100%,计算各温度下的相对酶活力。测定温度稳定性时,将适当稀释后的酶液于30~70 ℃保温30 min,按照标准方法测定酶活力,以未经处理的酶液为100%,计算各温度下的残余酶活力。
1.3.6PcMan26A的底物特异性和水解特性
以槐豆胶、瓜尔胶和魔芋粉等为底物(5 mg/mL),按照标准方法测定酶活力,计算该酶对不同底物的比活力。
测定水解特性时,用醋酸缓冲液(50 mmol/L,pH 6.0)分别配制10 mg/mL的甘露聚糖(魔芋粉、槐豆胶和瓜尔胶)和甘露寡糖(甘露二糖、甘露三糖、甘露四糖和甘露五糖),添加5 U/mL的PcMan26A 40 ℃水解12 h,在不同时间点取样。用薄层层析检测产物组成,标准品为甘露糖、甘露二糖、甘露三糖、甘露四糖和甘露五糖。
1.3.7PcMan26A水解魔芋粉
在高速搅拌下,将100.0 g魔芋粉溶于500 mL醋酸缓冲液(50 mmol/L,pH 6.0),置于40 ℃预热30 min,加入PcMan26A(加酶量200 U/mL),在40 ℃、600 r/min下水解12 h,之后沸水浴灭酶20 min。10 000×g离心15 min,取上清液浓缩冻干后即为魔芋甘露寡糖。
魔芋甘露寡糖的组成用高效液相色谱-示差折光检测器(high performance liquid chromatography-differential refractive index detector,HPLC-RID)分析测定。样品过0.22 μm滤膜上样,色谱柱为Shodex Sugar KS-802(7.8 mm×300 mm),柱温为65 ℃,流动相为纯水,流速0.8 mL/min,检测器温度35 ℃,标准品为甘露糖、甘露二糖、甘露三糖、甘露四糖、甘露五糖和甘露六糖。
2 结果与分析
2.1 PcMan26A的基因克隆
产黄青霉来源的PcMan26A全长1 017 bp,编码338 个氨基酸,属于GH26家族。经SignalP 4.1分析,N端有一个信号肽序列,含有18 个氨基酸。氨基酸序列同源比对分析表明(图1),该酶与黑曲霉(Aspergillus niger)CBS 513.88来源的β-甘露聚糖酶(GenBank No.A2R6F5.1)相似性最高,为67.8%;其次分别为Thermothelomyces thermophilusATCC 42464(GenBank No.G2Q4H7.1)、构巢曲霉(A. nidulans)FGSC A4(GenBank No.Q5AWB7.1)、海洋红嗜热盐菌(Rhodothermus marinus)DSM 4252(GenBank No.P49425.3)和Piromycessp.(GenBank No.P55296.1)来源的β-甘露聚糖酶,其相似性分别为43.2%、41.8%、40.5%和31.0%。通过氨基酸序列比对预测,该酶中第189位和281位的谷氨酸残基(Glu189和Glu281)分别为该酶亲核试剂和广义酸碱。

图1 产黄青霉PcMan26A与其他同家族β-甘露聚糖酶多重序列比对Fig. 1 Amino acid sequence similarity between PcMan26A and other β-mannanases from the family GH 26
2.2 PcMan26A的高效表达及纯化
通过高拷贝转化子筛选,1 株高产重组菌株的摇瓶发酵酶活力为261.8 U/mL。将该重组菌株进行高密度发酵,168 h后菌体湿质量达500 g/L,酶活力和蛋白质量浓度分别达到25 200 U/mL和10.1 mg/mL(图2A)。甲醇诱导开始后,发酵液中首先出现分子质量60 kDa的蛋白条带,发酵48 h后出现47 kDa的蛋白条带;随着诱导时间延长,2 条蛋白条带均逐渐变粗(图2B)。
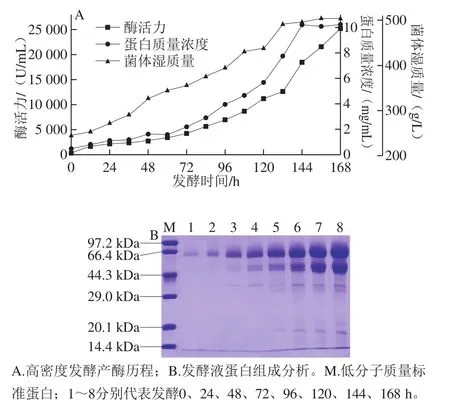
图2 毕赤酵母高密度发酵产PcMan26A历程Fig. 2 Expression of PcMan26A in P. pastoris GS115 during high cell density fermentation
通过阴离子交换层析一步纯化得到电泳级纯酶(PcMan26A),回收率为80.7%,纯化倍数为1.2 倍。PcMan26A在电泳胶上呈2 条不同的条带,其分子质量分别为60 kDa和47 kDa,均有明显拖尾现象;酶谱分析表明,2 条蛋白均有β-甘露聚糖酶活性(图3),这表明该酶在毕赤酵母中表达可能发生了不同程度的糖基化。去糖基化酶Endo H处理后,PcMan26A在电泳胶上仍然呈2 条带,但分子质量分别降低至50 kDa和39 kDa,没有出现拖尾现象,表明毕赤酵母表达的PcMan26A确实发生了糖基化。

图3 PcMan26A的纯化图Fig. 3 SDS-PAGE profiles of crude and purified PcMan26A
2.3 PcMan26A的酶学性质
如图4所示,该酶的最适pH值为6.0,pH 4.0~8.0处理30 min仍保留80%以上的酶活力;该酶的最适温度为50 ℃,在45 ℃下处理30 min仍保留90%以上的酶活力。

图4 PcMan26A的最适pH值(A)、pH值稳定性(B)、最适温度(C)和温度稳定性(D)Fig. 4 Optimal pH (A), pH stability (B), optimal temperature (C), and thermostability (D) of PcMan26A
2.4 PcMan26A的底物特异性和水解特性


图5 PcMan26A的水解特性Fig. 5 TLC analysis of mannans and manno-oligosaccharides hydrolyzed by PcMan26A
PcMan26A对槐豆胶的比活力为2 967.7 U/mg,对魔芋粉和瓜尔胶的比活力分别为3 581.0 U/mg和1 442.1 U/mg。水解特性分析表明(图5),该酶水解槐豆胶时主要产生甘露二糖、甘露三糖和一些聚合度大于3的甘露寡糖;水解魔芋粉时主要产生聚合度大于4的甘露寡糖;水解瓜尔胶时主要产生聚合度大于5的甘露寡糖。此外,该酶的最小水解底物为甘露五糖,主要产生甘露四糖和少量的甘露糖。
2.5 魔芋甘露聚糖的制备
利用PcMan26A在最适条件下(200 g/L魔芋粉,加酶量200 U/mL)水解魔芋粉12 h后,魔芋粉中葡甘露聚糖的水解率为91.8%,魔芋甘露寡糖总得率为86.2%。经HPLC分析,产物主要为聚合度大于4的甘露寡糖(图6)。此外,甘露六糖保留时间右侧寡糖组分的峰面积超过总峰面积的50%,符合我国颁布的“新食品原料”(2013年第10号公告)目录[25]中的相关规定。

图6 魔芋甘露寡糖的组分分析Fig. 6 HPLC profile showing the composition of konjac manno-oligosaccharides
3 讨 论
本研究从产黄青霉基因组中发掘了一个GH26家族PcMan26A,该酶与黑曲霉CBS 513.88来源的β-甘露聚糖酶同源性最高(67.8%),与其他GH26家族β-甘露聚糖酶同源性均在45%以下(图1),表明该酶为一个新型GH26家族β-甘露聚糖酶。经高密度发酵,该酶的毕赤酵母发酵液蛋白质量浓度可达10.1 mg/mL(图2),显著高于芽孢杆菌和枯草芽孢杆菌等来源的β-甘露聚糖酶,它们在毕赤酵母中的表达水平仅为2.2~6.6 mg/mL[15,26]。虽然该酶产酶水平低于一些GH5家族β-甘露聚糖酶,如毛壳菌CQ31来源的CsMan5A(50 030 U/mL)[11]和米黑根毛霉CAU432来源的RmMan5A(85 200 U/mL)[12],但其产酶水平明显高于大多数GH26家族β-甘露聚糖酶,如黑曲霉CBS 513.88来源的Man26A(5 069 U/mL)[27]和枯草芽孢杆菌TBS2来源的ReTMan26(5 435 U/mL)[28]。
该酶在电泳胶上呈47 kDa和60 kDa两条蛋白条带,酶谱分析表明它们均具有β-甘露聚糖酶活性(图3)。通过NetNGlyc和NetOGlyc分析,PcMan26A氨基酸序列中有3 个N-糖基化位点(Asn147-Ser148-Thr149、Asn154-Gly155-Thr156和Asn269-Val270-Thr271)和4 个O-糖基化位点(Ser13、Thr29、Ser148和Thr149)。利用Endo H处理后,2 个条带分别降低至39 kDa和50 kDa,其中39 kDa的条带与该酶的预测分子质量(38 kDa)一致,而另一个条带的分子质量(50 kDa)则高于预测分子质量。这可能是由于该酶在毕赤酵母中同时发生了N-糖基化和O-糖基化,Endo H只能去除N-糖基化,而无法去除O-糖基化。
PcMan26A的最适pH值为6.0,在酸性条件下具有较高催化活性(图4),这与大部分真菌来源β-甘露聚糖酶类似,如米曲霉(A. oryzae)RIB40、嗜热毁丝菌(Myceliophthora thermophila)和哈茨木霉(Trichoderma harzianum)MGQ2来源的β-甘露聚糖酶[29-31]。其最适pH值明显低于一些细菌来源β-甘露聚糖酶,如肠杆菌(Enterobactersp.)N18(pH 7.5)、嗜热裂孢菌(Thermobifida fusca)BCRC 19214(pH 8.0)和芽孢杆菌N16-5(pH 9.5)来源的β-甘露聚糖酶[32-34]。该酶的最适温度为50 ℃,与大部分微生物β-甘露聚糖酶最适温度(40~60 ℃)相似[14,35],但明显低于一些嗜热微生物来源β-甘露聚糖酶,如费氏新萨托菌(Neosartorya fischeri)P1的rMan5P1(80 ℃)[36]、来源于嗜热裂孢菌BCRC 19214的Tfu-man(80 ℃)[32]和来源于Talaromyces leycettanusJCM12802的TlMan5A(90 ℃)[37]。
不同家族β-甘露聚糖酶的最小水解底物有所不同。大部分GH5家族β-甘露聚糖酶的最小水解底物为甘露三糖,多数GH26家族β-甘露聚糖酶的最小水解底物为甘露四糖[38]。枯草芽孢杆菌来源的GH26家族β-甘露聚糖酶Bman26/MEIR水解甘露四糖主要产生甘露二糖以及少量甘露糖和甘露三糖[14];Clostridium thermocellum来源的GH26家族β-甘露聚糖酶则具有糖苷酶活性,其能将甘露二糖水解为甘露糖[39]。与大部分GH26家族β-甘露聚糖酶不同,PcMan26A的最小水解底物为甘露五糖,能将甘露五糖水解为甘露糖和甘露四糖,不产生甘露二糖和甘露三糖(图5),这有利于水解时甘露寡糖组分的积累。利用该酶水解槐豆胶、魔芋粉、瓜尔胶等底物时,产物主要为高聚合度寡糖,几乎不产生甘露糖,表明该酶适用于甘露寡糖生产。利用PcMan26A水解200 g/L魔芋粉所得魔芋甘露寡糖中,主要为聚合度大于4的寡糖组分(图6)。与低聚合度的甘露寡糖相比,高聚合度的甘露寡糖在人体肠道内发酵速度更慢,能够顺利到达人体远端结肠,促进远端结肠中有益菌生长增殖[40]。因此,将上述魔芋甘露寡糖与低聚木糖、低聚果糖等低聚合度寡糖复配,对整个结肠(近端和远端)中有益菌生长均可起到促进作用。
4 结 论
本研究将一个来源于产黄青霉GH26家族的PcMan26A在毕赤酵母中高效表达,经高密度发酵产酶水平达25 200 U/mL。该酶对魔芋粉具有最高的比活力,水解甘露聚糖主要产生一些高聚合度(>4)甘露寡糖,在甘露寡糖酶法制备中具有应用潜力。利用PcMan26A水解魔芋粉成功制备得到魔芋甘露寡糖。这为魔芋甘露寡糖的酶法制备提供了更多选择。

