湿腌时盐质量浓度对草鱼肌肉组织结构和品质的影响
姜晶丹,杨明远,许长华,施文正,卢 瑛
(上海海洋大学食品学院,农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海水产品加工及贮藏工程技术研究中心,上海 201306)
草鱼是我国主要淡水养殖鱼种之一,有较高的营养价值[1],深受人们欢迎。在我国,草鱼产量常年稳居养殖鱼类首位,2018年达到534.56万 t[2]。目前,草鱼除鲜活销售之外,大多是经企业加工后再销售,但是因企业使用的传统生产技术存在生产效率低和产品竞争力不足等缺点[3],使得企业淡水鱼产业的加工率低[2]。因此,草鱼的加工技术和生产方式亟待改进,以迎合消费者对安全、卫生、健康产品的需求,并实现规模化生产。
腌制是我国水产品加工的传统方法之一,腌制产品广受消费者喜爱[4]。食盐腌制作为最基本的腌制方法主要分为干腌法、湿腌法和混合腌制法,干腌虽然操作简便,但腌制时间长且易造成腌制产品品质下降,混合腌制法因其生产工艺复杂,运用不多,而湿腌法虽然劳动量相较于干腌法大,但其可缩短腌制时间,且产品肉质柔软,在水产品腌制加工中广泛运用[5]。目前国内外关于湿腌鱼类的研究大多是关于渗透动力学[6-7]和鱼类蛋白质的氧化机制[8-11],水产品在湿腌过程中鱼肉组织内部和盐溶液间发生一系列运动,除水分和氯化钠的相互传质外,还包括蛋白质、脂肪等物质的变化[12],而在腌制过程中蛋白质、脂肪等的变化对水产品营养品质和质构的影响研究仍较少[13],因此,研究肌肉组织在湿腌过程中发生的质构或者品质变化及其原因,对于改善湿腌产品品质、开发健康的方便水产品具有重要的意义。本实验以草鱼为原料,探究盐质量浓度(30、60、90、120 mg/mL)对鱼肉肌肉蛋白质、水分、脂肪和肌肉组织结构和质构的影响,以期为营养、高品质方便水产制品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜活草鱼购于上海市浦东新区芦潮港,规格为1.5~2 kg/条,致死方式为二氧化碳窒息;食盐购于农工商超市。
浓硫酸、盐酸(分析纯) 国药集团化学试剂有限公司;硫酸钾、硫酸铜、石油醚、β-巯基乙醇(均为分析纯) 麦克林生化科技有限公司;R-250考马斯亮蓝染色液、2×上样缓冲液、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、Tris(均为分析纯) 生工生物工程(上海)股份有限公司;蛋白质Marker(10~200 kDa) 上海碧云天生物技术有限公司。
1.2 仪器与设备
DHG-9053A鼓风干燥箱 上海一恒科学仪器有限公司;PL2002电子天平 瑞士梅特勒-托利多仪器(上海)有限公司;IKA T10匀浆机 上海楚柏实验室设备有限公司;Z36HK高速冷冻离心机 德国Hermle公司;TA.XT plus物性测试仪 超技仪器有限公司;FOSS Kjeltec 8400全自动凯氏定氮仪、FOSS Soxtec 2050全自动索氏脂肪浸提仪 上海瑞国际芬贸易有限公司;TS-8脱色摇床 江苏海门其林贝尔仪器制造有限公司;Meso MR23-060H-I低场核磁共振仪 上海纽迈电子科技有限公司;Spotlight 400傅里叶变换红外光谱仪 珀金埃尔默仪器(上海)有限公司。
1.3 方法
1.3.1 原料处理
新鲜草鱼,一整条装袋,袋中装水,水中充二氧化碳气体直至活鱼死亡,去鳞、头、骨、内脏,流水洗净,切块称质量,随机分成5 组,每组5 块。采用湿腌法进行腌制,盐质量浓度分别为30、60、90、120 mg/mL,腌制温度为4 ℃,腌制时间30 min,新鲜鱼作为对照(C)。
1.3.2 营养成分测定
针对鱼肌肉组织样品,采用GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法测定粗蛋白,采用GB 5009.6—2016《食品中脂肪的测定》中的索氏抽提法测定粗脂肪。
1.3.3 离心损失率测定
根据Jiang Qingqing[14]的方法,稍作修改。将样品切块(1 cm×1 cm×0.5 cm),称质量于离心管中,在离心管底部放入吸水纸,以8 000 r/min离心20 min,称取离心后样品的质量。通过下式计算离心损失率:
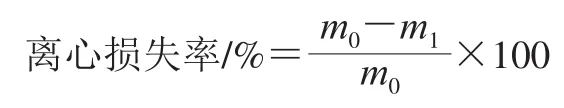
式中:m0为离心前样品质量;m1为离心后样品质量。
1.3.4 硫代巴比妥酸反应物(thiobarbituric reactive substances,TBARS)值测定
参考包建强等[15]的方法,稍作修改。准确称取搅碎的鱼肉5.00 g加入25 mL 20%的三氯乙酸,匀浆后4 ℃静置1 h,以8 000 r/min离心10 min,过滤后蒸馏水定容至50 mL,取滤液5 mL,加入0.02 mol/L的硫代巴比妥酸溶液5 mL混匀后,沸水浴20 min,冷却至室温后在532 nm波长处测吸光度。空白对照以5 mL 20%三氯乙酸代替5 mL滤液。每个样品3 个平行,结果以mg/100 g表示。
1.3.5 SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)
参考Shi Yan等[16]的方法,稍作修改。称取3 g样品,加入27 mL溶解液(5% SDS,0.1%)匀浆,80 ℃水浴1 h后,8 000 r/min离心20 min,上清液过滤后稀释至蛋白质量浓度1 mg/mL。将处理好的蛋白质样品与SDS-PAGE样品缓冲液1∶1混合,沸水浴5 min。电泳时,采用5%浓缩胶和10%分离胶制成凝胶,样品量为8 μL。设置电源电压进行跑胶,待电泳结束后取出,染色1 h,脱色至蛋白质条带清晰。
1.3.6 质构参数
取草鱼背肉切成3 cm×2 cm×1 cm块状,使用质构仪TA.XT Plus进行TPA测试,对草鱼的硬度、弹性和咀嚼性进行测定。设定参数:探头型号P50,触发力5 g,测试速率为1 mm/s,最后结果为6 次平行实验结果的平均值。
1.3.7 低场核磁共振分析
参考卞瑞姣等[17]的方法,稍作修改。取3 cm×1 cm×1 cm的鱼块,每个样品取3 个平行。采用MesoMR70核磁共振成像分析仪进行测定,共振频率23.143 MHz,磁体强度0.54 T,线圈直径为70 mm,磁体温度为32 ℃。
T2测试参数:P1=20 μs,P2=36 μs,TW=2 000 ms,TE=0.4 ms,NECH=4 000,NS=4,SW=200 kHz。使用核磁共振分析测量软件及CPMG序列采集样品信号, 采用SIRT 1000000进行反演。
1.3.8 微观结构分析
扫描电镜(scanning electron microscope,SEM)样品:将草鱼鱼片切成3 mm×3 mm×2 mm大小,用2.5%戊二醛4 ℃固定24 h,接着用磷酸缓冲液漂洗样品,然后用乙醇溶液和甲醛进行梯度沉淀,最后将处理好的样品进行冷冻干燥,喷金后进行观察。
透射电镜(transmission electron microscopy,TEM)样品:将用磷酸盐漂洗的样品,用乙醇和丙酮溶液梯度洗脱后,再用四氧化锇固定后进行观察。
1.3.9 红外光谱数据采集
原始光谱采集:取5 g鱼肉搅碎成鱼糜状,冷冻干燥24 h除去水分,之后将其与溴化钾碎晶按1∶100混合研磨充分后,用傅里叶红外光谱仪进行光谱采集,波数范围为4 000~400 cm-1,分辨率为4 cm-1,光谱累加32 次。
二阶导数谱图:将原始光谱图用谱图处理软件PerkinElmer Spectrum(Version 10.4.3)进行基线校正、13点多项式最小二乘法平滑处理得到样品的二阶导数谱图。
1.4 数据分析
采用SPSS 20.0、单因素方差分析(ANOVA)对数据进行统计分析,并用Excel制图。
2 结果与分析
2.1 湿腌对草鱼肌肉蛋白质的影响
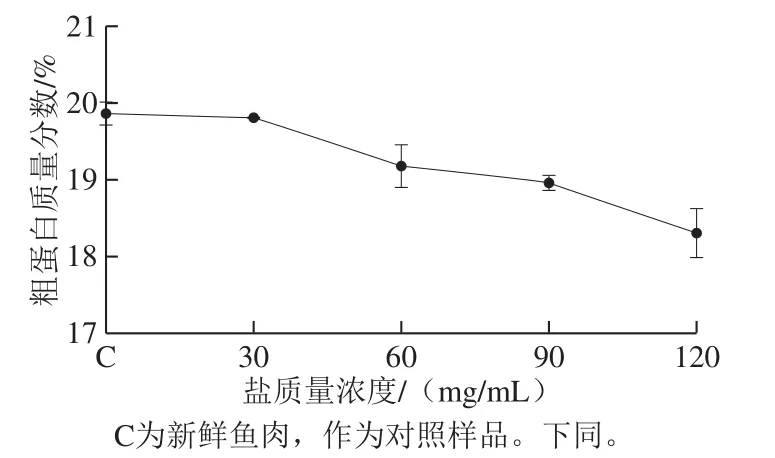
图1 不同盐质量浓度下鱼肉粗蛋白含量Fig. 1 Crude protein content of cured grass carp with different salt concentrations
蛋白质是组成鱼类肌肉的主要成分,淡水鱼肌肉中粗蛋白质量分数一般在15%~22%,而草鱼的蛋白质质量分数大致在18%左右[5]。鱼类肌肉蛋白质可分为肌原纤维蛋白、肌浆蛋白和肌基质蛋白三大类,而肌原纤维蛋白占肌肉蛋白总量的50%以上[18]。目前有许多研究发现腌制会引起肌肉蛋白质的降解和聚集[19],导致蛋白质变性。从图1可以看出,在湿腌过程中,当盐质量浓度为30 mg/mL时,草鱼蛋白质含量没有发生变化,当盐质量浓度逐渐增加时,粗蛋白含量逐渐降低,说明草鱼蛋白质有流失,此结果与郝子娜等[20]鲈鱼腌制加工结果一致。从图2可以看出,30 mg/mL质量浓度盐腌制草鱼肉中的蛋白质条带的数量和强度与新鲜草鱼的样品最接近,表明30 mg/mL的盐质量浓度对草鱼肌肉蛋白质影响不大;当盐质量浓度达到120 mg/mL时,鱼肉组织中的肌球蛋白和肌动蛋白条带变细,且强度变弱,表明蛋白质的含量减少,其可能是蛋白质流失或降解导致的。随着盐质量浓度的增加,蛋白质含量明显下降,可能是钠离子和带相反电荷的蛋白质基团相互作用,从而形成了一个离子双电层,降低了蛋白质分子间的静电相互作用,导致蛋白质的水化[21]。张蕊[22]研究发现在盐离子溶液中蛋白形态会发生改变,主要是蛋白二级、三级和形态因子的改变,从而导致蛋白构象的改变,致使蛋白发生变性,变得更易流失。
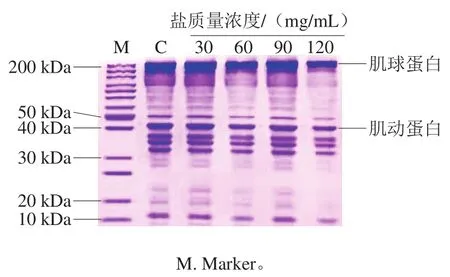
图2 不同盐质量浓度下草鱼肌肉的SDS-PAGEFig. 2 SDS-PAGE patterns of proteins from cured grass carp muscle with different salt concentrations
2.2 湿腌对水分的影响
鱼肉的持水能力被认为与蛋白质性质和组织微观结构密切相关,尤其是肌纤维的膨胀[23-24]。如图3所示,30 mg/mL盐质量浓度的离心损失率最高,其后随着盐质量浓度的增加离心损失率逐渐下降,表明随着盐质量浓度增加,草鱼肌肉的持水能力是下降的。食盐会增强水的极化作用,使得蛋白质周围的双电层厚度发生变化,从而影响蛋白质的稳定性[18]。在低盐质量浓度下,蛋白质表面的双电层厚度增加,蛋白质的持水性加大,当盐质量浓度加大时,蛋白质表面的双电层厚度减少,蛋白质的稳定性降低,从而使得蛋白质发生流失。
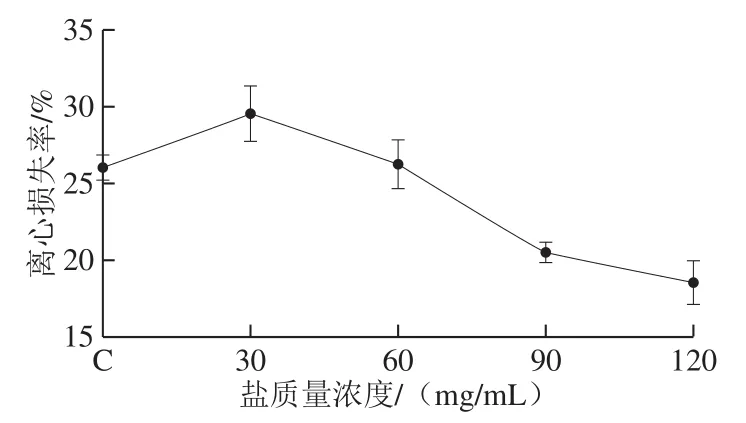
图3 不同盐质量浓度下草鱼肌肉离心损失率变化Fig. 3 Centrifugal loss rate of cured grass carp muscle with different salt concentrations
在草鱼腌制过程中,由于盐类会和氨基酸侧链基团竞争水分子,因此湿腌溶液的盐离子强度会对存在于蛋白质网络结构中的不易流动水、自由水以及结合水的状态产生影响,从而导致鱼肉质构发生变化。因此通过低场核磁共振技术对鱼肉水分变化进行分析。图4是低场核磁共振测定的不同质量浓度盐腌制的草鱼T2横向弛豫时间图谱。弛豫时间的变化表征不同腌制盐质量浓度下不同水分的迁移情况,即不同状态下水分的结合状态和迁移程度,而峰面积代表着不同状态水的含量。从图中可以看出,草鱼共产生了3 个峰,分别对应3 种水分相态,即结合水T21(0.01~10 ms)、不易流动水T22(10~100 ms)和自由水T23(>100 ms)。由图4可见,30 mg/mL和60 mg/mL质量浓度盐腌制的草鱼,其肌肉组织中不易流动水含量最高。结合峰总面积及相应组分所占总水分的百分比(表1),与新鲜草鱼相比,随着盐质量浓度增加,草鱼的A总总体下降,说明草鱼水分含量逐渐下降。同时随腌制盐质量浓度的增加,结合水S21和自由水S23比例呈减小的趋势,而不易流动水S22比例增大,表明腌制处理使得部分结合水与自由水转化为不易流动水。此结果与卞瑞姣等[17]的研究结果一致。
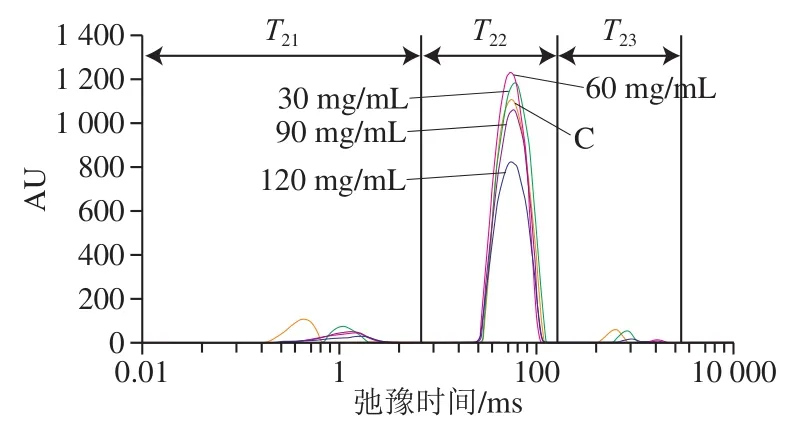
图4 不同盐质量浓度下腌制草鱼的T2弛豫图谱Fig. 4 T2 relaxation spectra of cured grass carp muscle with different salt concentrations
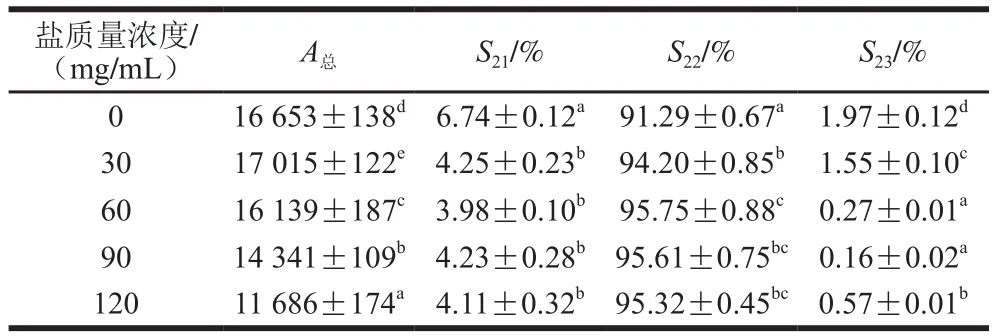
表1 总水分面积及相应组分所占总水分的百分比Table 1 Total water area and percentage of each component
由于低盐处理后草鱼肌肉的粗蛋白和水分变化不明显,但是高质量浓度盐处理后的草鱼蛋白质和水分发生了明显变化,因此进一步对比分析30 mg/mL和120 mg/mL盐质量浓度下的草鱼肌肉显微结构。如图5所示,未处理草鱼肌肉组织呈现清晰的多层重叠结构,且粗丝和细丝有规律地交替排列而成的肌原纤维和肌浆亦清晰可见。经30 mg/mL质量浓度盐湿腌后的肌肉组织,多层次状结构变薄、相互连接形成片状,且观察不到粗丝和细丝,肌原纤维组织变模糊,肌浆团聚状的嵌在肌肉中。当鱼经120 mg/mL质量浓度盐进行湿腌后,肌肉组织的多层次状完全消失,呈现片状外形,且肌浆裂解、缩小。这可能是肌肉组织细胞在低盐质量浓度下,渗透压小,蛋白质的水化能力增强,所以组织细胞吸收水分,导致纤维细胞内粗丝和细丝膨胀,细胞间的间隔变小从而连接形成片状外观。但在高盐质量浓度下,水分子和盐离子之间的相互作用强烈,因而引起蛋白质脱水,组织细胞彻底被破坏,肌浆裂解而水分发生流失。
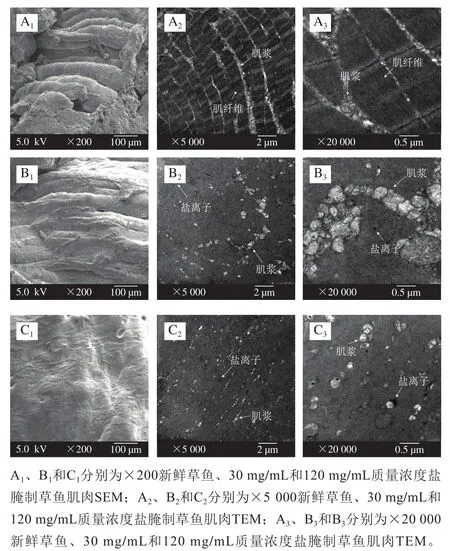
图5 湿腌草鱼肌肉的SEM和TEM组织微观结构Fig. 5 Microstructure of wet-cured grass carp muscle observed by SEM and TEM
2.3 湿腌对脂肪的影响
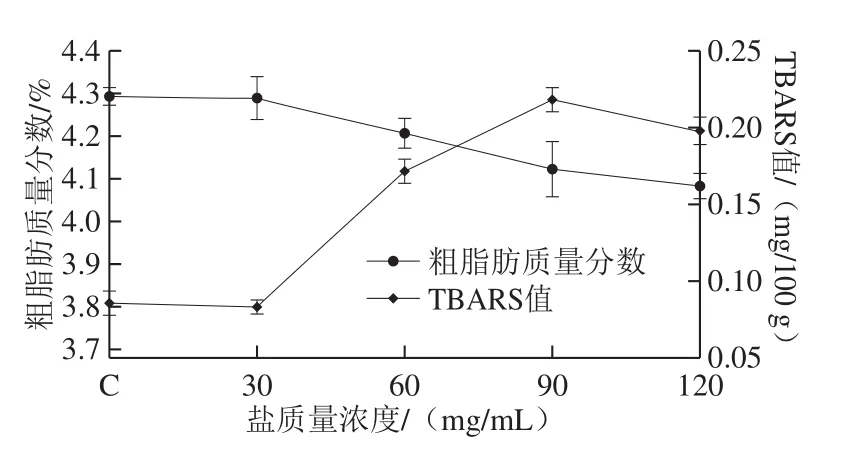
图6 不同盐质量浓度下草鱼脂肪含量及TBARS值变化Fig. 6 Changes in fat content and TBARS value of cured grass carp with different salt concentrations
从图6可以看出,随着盐质量浓度的增加,TBARS值逐渐上升。低盐质量浓度对TBARS值没有影响,随着盐质量浓度的增加,TBARS值呈明显增加趋势,表明盐质量浓度越高,草鱼脂肪氧化的速度越快。与之相反,草鱼的粗脂肪质量分数随着盐质量浓度增加而逐渐下降。腌制过程中脂肪氧化可能是由于自身内源性酶活引起的,也可能是湿腌处理加速了肌肉脂肪的氧化[25]。有研究[26]表明肌肉中TBARS值在0.5~1.0 mg/kg之间不会发生明显的腐败,由于腌制时间为30 min,即使是高盐腌制,草鱼的TBARS值只有0.198 mg/100 g,由此可见,短暂的湿腌处理对鱼肉风味的影响较小。
红外光谱是分子振动能级的吸收光谱,任何官能团都有红外吸收,因此红外光谱可以反映样品化学成分的综合信息[27]。鱼肉蛋白质的酰胺I带、II带红外光谱特征峰区域分别为1 612~1 698 cm-1和1 523~1 553 cm-1。二阶导数红外光谱可将原谱中重叠峰进行分离,增强光谱的表观分辨率,从而提高图谱的指纹特征性并获得特定化合物的特征峰[28]。由图7可以看出,相较于未腌制样品,1 653、1 631、1 625、1 541、1 534 cm-1峰面积在30 mg/mL时增加,但随着盐质量浓度增加,这些峰的波长出现位移,且面积变小。这可能是盐离子夺取水分子从而使得蛋白质的N—H、C—N键暴露出来,而当盐质量浓度逐渐增加后,部分N—H、C—N键可能遭到破坏,从而造成这些吸收峰的强度逐渐减弱或发生位移。湿腌后1 747 cm-1处吸收峰(主要归属于脂类物质的C=O伸缩振动吸收)的减弱,很可能是腌制引起脂肪的氧化从而造成脂肪的减少,此结果和TBARS值的分析结果一致。
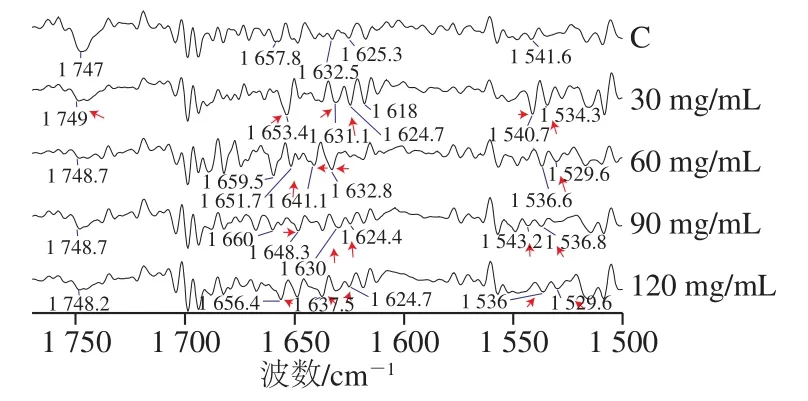
图7 不同质量浓度盐腌制草鱼蛋白二阶导数光谱图Fig. 7 econd derivative FR-IR spectra of salted fish with different salt concentrations
2.4 湿腌对草鱼质构变化的影响
质构特性是鱼肉最重要的特征之一[29]。一般而言,肌纤维越粗、结构越致密则所需的咀嚼力越大,而弹性和硬度则受肌肉的持水性、微观结构的破坏程度影响较大。由于食盐影响整个腌制过程的渗透压,改变蛋白质与水分子之间的相互作用和肌肉组织结构,本研究发现120 mg/mL质量浓度盐腌制草鱼的硬度、弹性和咀嚼性都最低(表2),表明高质量浓度的盐对草鱼肌肉的品质影响比较大,这和该质量浓度下其蛋白质、脂肪、水分以及肌肉组织微观结构的变化最大一致。离心损失率结果(图3)显示30 mg/mL质量浓度盐腌制草鱼的持水性能比较好,而肌肉组织的微观结构(图5)显示30 mg/mL质量浓度盐对肌肉组织结构破坏比较小,质构分析也发现30 mg/mL质量浓度盐腌制草鱼的弹性和咀嚼性最高(表2)。由此可见,湿腌过程中,高盐质量浓度对草鱼鱼肉质构变化具有较大影响,胡晓飞等[30]的研究也发现高盐导致肌肉组织状态变化大,硬度下降,和本实验结果一致。综合营养组成分、肌肉组织结构和鱼肉的质构数据,发现低盐腌制对草鱼肌肉组织结构的影响比较小,其食用品质和未腌制鱼肉最为接近。

表2 不同质量浓度盐腌制草鱼的质构变化Table 2 Changes in texture of salted grass carp with different salt concentrations
3 结 论
草鱼在湿腌过程中,盐质量浓度对草鱼蛋白质和质构的影响均较显著。湿腌处理引起草鱼肌肉的蛋白质和脂质的官能团发生变化,使得草鱼肌肉结构变松散,蛋白质、水分流失,脂肪发生氧化,鱼肉品质下降。30 mg/mL质量浓度盐湿腌的草鱼,其肌肉的蛋白质、水分和脂肪变化很小,腌制后的鱼肉弹性和咀嚼性增加,说明低盐腌制的草鱼的营养成分损失少,口感佳,可用于营养方便水产制品的开发。

