血浆胺氧化酶交联明胶及其产物结构表征与性能分析
刘新柱,程 珊,李 玉,王稳航,*
(1.天津科技大学食品科学与工程学院,天津 300457;2.天津科技大学生物工程学院,天津 300457)
明胶是由来源于动物的皮肤、骨头等结缔组织中的胶原蛋白水解而得到的一种天然生物大分子,分子质量为几万到几十万不等[1]。由于其具有良好的发泡和乳化能力、优良的成膜特性、高水结合能力、较好的生物相容性和良好的生物降解能力等,明胶被广泛应用于食品、制药和化妆品等行业中[2-3]。在明胶制备过程中,由于受到酸、碱和热的作用,原有胶原蛋白分子的三股螺旋结构受到不同程度的破坏,因此所形成的明胶凝胶强度在很多时候不能完全满足食品加工的需求[4-5]。为了调节明胶蛋白的功能特性,拓宽其在食品工业中的应用范围,通常采用交联方式改善明胶的结构与性能[6-7]。通常,蛋白交联主要分2 种形式:物理交联和化学交联。物理交联是指分子内或分子间的弱键相互作用,如氢键、范德华力、疏水相互作用、π键等,适合于食品加工,但其缺点是交联强度较小,对蛋白性能的提升能力较小[8-9]。相比而言,蛋白质化学交联比物理交联会使蛋白拥有更高更稳定的交联度以及可控制的蛋白性能改良。化学交联一般是指分子的共价交联,包括二硫键的形成,其可以通过化学反应实现[10-11]。然而,化学反应在食品加工中往往是禁用的,这是因为通常用的醛类以及一些性质活泼的氧化剂具有生物毒性[12]。相反,通过酶催化形成共价键交联具有反应条件温和、无毒害、催化高效的优势,可以有效改善食品蛋白质的特性,是目前最易被人们所接受的蛋白改良手段之一[13-14]。目前在食品领域中用于交联的酶主要有谷氨酰胺转氨酶(glutamine transaminase,TG)、多酚氧化酶、过氧化物酶等[12,15],除TG外,其他的酶法交联或改性而形成的共价交联大多属于氧化交联,其在蛋白质交联中的应用已逐渐引起了人们的关注[10,16]。
赖氨酰氧化酶(lysyl oxidase,LOX)家族是一类动物体内广泛存在的氧化酶类,其能够催化初级胺形成醛再进而形成共价交联,用于胶原蛋白和弹性蛋白的翻译后修饰,与组织TG共同维持生物体结缔组织的结构形态和力学强度,同时具有多种生理功能。研究表明,LOX交联胶原蛋白时,其酶学特性会因为Cu2+的缺失而大大降低,并会导致相关组织缺陷如阻塞性肺疾病、主动脉瘤及各种皮肤和骨骼缺陷等[17]。血浆胺氧化酶(plasma amine oxidase,PAO)是一种与LOX的作用机制相似的氧化酶,其可以氧化初级胺形成醛,随后形成的活性醛可以进一步反映交联细胞外基质形成最终的交联产物[18]。据报道,PAO也是一种铜依赖性酶,Cu2+参与胶原和弹性蛋白的细胞外加工,但不影响PAO的表达,PAO中活性醛的形成是由PAO活性位点铜介导的直接催化作用的结果[19-20],其酶学特性会因为Cu2+的缺失而大大降低。此外,据Jalkanen等[21]研究,通过添加PAO可以加强多肽纳米纤维的交联重组强度。与LOX相比,PAO的优势在于其具有商业化来源,通常可由动物血液制备而得到,这为进一步拓宽PAO作为新的交联剂改善蛋白质类产品功能特性打下了基础。目前,PAO仅有少数报道用于生物材料制备[21],在食品蛋白质包括明胶的交联中未见研究,PAO处理明胶结构和功能变化的关系及作用机制的研究还不清楚。
为此,本实验以明胶为对象,利用不同添加量PAO有无Cu2+辅助交联条件下对其交联,研究交联后明胶结构和功能特性的变化。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、扫描电子显微镜(scanning electron microscope,SEM)、差示扫描量热(differential scanning calorimetry,DSC)仪、傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)、Zeta电位测定、流变性能分析、粒径分析、荧光分光光度等仪器方法对PAO交联明胶的二级结构及变化进行分析,所得结果将为进一步研究PAO作为新型的食品蛋白质交联酶提供支持。
1 材料与方法
1.1 材料与试剂
A型明胶(食品级、220 Bloom) 上海阿拉丁生化科技股份有限公司;PAO(78 U/g) 美国Sigma公司;冰乙酸、氯化钠、磷酸氢二钠、考马斯亮蓝R-250、30%聚丙烯酰胺 天津市江天化工技术有限公司;5×蛋白上样缓冲液 北京索莱宝科技有限公司。
1.2 仪器与设备
Mini VE电泳仪 美国Hercules公司;JSPM-5200原子力显微镜 日本电子株式会社;DSC60 DSC仪、RF-5301PC荧光分光光度计 日本岛津公司;Tap300Al-G原子力显微镜探针 北京安立通科技有限公司;Vecror22 FTIR仪 德国布鲁克光谱仪公司;FPA Zeta电位仪 上海久贸贸易有限公司;BT-9300S激光粒度分析仪 中国丹东市百特仪器有限公司;DV-3流变仪美国博力飞公司。
1.3 方法
1.3.1 PAO交联明胶样品的制备
将明胶溶于pH 5的醋酸溶液中,配制成质量分数5%的凝胶溶液。随后将PAO溶于pH值为5的醋酸溶液中,制得酶活力为78 U/mL的酶溶液。将所得到的酶溶液平均分为2 组,参考Kosonenk[19]和Lopez[20]等的研究,其中一组酶溶液中加入50 μL、100 mmol/mL的Cu2+,另外一组未加入Cu2+的酶液中加入相同含量的pH值为5的醋酸溶液作为对照。
分别将上述2 组酶液分别按照酶基于明胶含量(0、25、50、100 U/g)的添加量加入到配制好的凝胶体系中,得到共8 个样品。随后将所有溶液均放置于37 ℃下搅拌4 h,并将样品冻干贮存于4 ℃条件下备用。
1.3.2 SDS-PAGE分析
明胶的分子质量分布由SDS-PAGE测定[22]。分别取上述加入了不同浓度酶液的有Cu2+和无Cu2+处理冻干8 个样品各5 mg。分别溶于pH值为7的磷酸缓冲液中,得到质量浓度均为10 mg/mL的凝胶样品。从中分别取出50 μL样品加入25 μL蛋白上样缓冲液混合,随后所有样品在100 ℃下加热煮沸5 min使蛋白变性。按照上述相同的方法配制PAO。将所有样品混合溶液及Marker加入到配制好的电泳胶中(含5%的浓缩胶与8%的分离胶)。控制所有样品的上样量均为25 μL,先用80 V电压进行实验,待样品达到浓缩胶与分离胶的分界线后转变电压为120 V直至实验结束。电泳结束后,用0.1%考马斯亮蓝R-250、50%甲醇和6.8%乙酸配成的染色液染色2 h,随后用7%冰乙酸、30%甲醇配制成的脱色液进行脱色直至条带清晰。
1.3.3 SEM分析
参照文献[23],将冻干后的样品放在真空干燥箱中干燥24 h后,取适量的样品裁剪成约5 mm×5 mm的结构,将其固定在粘有导电胶的载物台上,标号后进行表面喷金处理,并在5 kV加速电压下进行微观测定。
1.3.4 DSC分析
明胶的热稳定分析采用DSC法[24]。分别取上述加入了不同浓度酶液的有Cu2+和无Cu2+处理的明胶样品20 μL置于液体DSC坩埚内,密封,并用空坩埚作对比。升温速率为1 ℃/min。不同的样品分别做3 次平行实验分析热稳定性差异。
1.3.5 FTIR分析
参照文献[25]的测定方法,将冻干后的明胶样品置于真空干燥箱中,在25 ℃条件下干燥3 d,尽可能减少水分对样品测定的影响。分别取冻干后的样品1.0 mg,加入150 mg KBr,置于玛瑙研钵中,充分研磨成粉末,使压片后保持透明的片状的结构。扫描范围为4 000~400 cm-1,分辨率为4 cm-1,扫描频率为16 次/分,不同的样品分别做3 次平行实验。
1.3.6 Zeta电位测定
参照Kang Pan等[26]的方法。取冻干后的样品重新溶解在pH值为5的醋酸溶液中获得0.5 mg/mL的凝胶溶液,将样品加入到比色皿中约1/3处用Zeta电位仪进行电位测定。测量3 次平行结果取平均值。
1.3.7 流变性能分析
将冻干后的明胶样品溶于pH值为5的醋酸溶液中获得50 mg/mL的凝胶溶液,此状态下的明胶溶液接近凝胶状态。参考Valencia等[27]的测定方法,取适量样品在室温下用DV-3流变仪进行测试,进行应变扫描测定合适的线型黏弹区间,通过对频率扫描确定弹性模量(G′)和黏性模量(G”)与频率之间的关系,频率范围为0.1~100 Hz。
1.3.8 粒径分析
将冻干后的明胶样品溶于pH 5的醋酸溶液中获得0.5 mg/mL的凝胶溶液,取适量溶液加入到比色皿中,并用蒸馏水作分散剂,采用BT-9300S型激光粒度分布仪测试样品的粒径分布,粒径测试范围为0.1~341 μm,并用蒸馏水作空白对照。每组样品平行测定3 次。
1.3.9 荧光分光光度计分析
将冻干后的明胶样品溶于pH 5的醋酸溶液中获得50 mg/mL的凝胶溶液,取适量样品加入到比色皿3/4处,采用Acquire模式,调整激发波长为350 nm,发射波长为370~900 nm,适当调整狭缝参数,进行最大荧光强度测定。
1.4 数据统计与分析
数据均采用SPSS 17.0软件进行数据的统计学处理,相关表格中数据均以表示,并通过方差分析软件(ANOVA)进行分析。P<0.05,差异显著。
2 结果与分析
2.1 SDS-PAGE分析

图1 明胶在不同处理条件下的SDS-PAGE图Fig. 1 SDS-PAGE patterns of gelatin treated with different concentrations of PAO in the presence and absence of Cu2+
如图1所示,交联后的明胶分子链在γ处位置颜色更深,不符合明胶的三螺旋结构,即不符合含有少量的γ链、β链与含量较多的α链[28]。推测在γ处PAO里的杂蛋白和γ链重叠形成遮挡,造成颜色发深。不加入Cu2+时,随着酶活力的增加,明胶大分子质量条带逐渐加深,使大分子质量组分增加。但是与纯胶原条带相比整体条带颜色较浅,这可解释为明胶发生了部分降解,但仍然保留部分三螺旋结构。当加入Cu2+时,与不加Cu2+的样品相比,所有条带颜色均变浅,部分大分子质量条带甚至消失,这说明加入100 mmol/mL Cu2+条件下可能会使明胶变性而酶活力也会受到影响,无法形成有效的结合,因此加入浓度为100 mmol/mL的Cu2+效果并不是很理想。
2.2 SEM分析
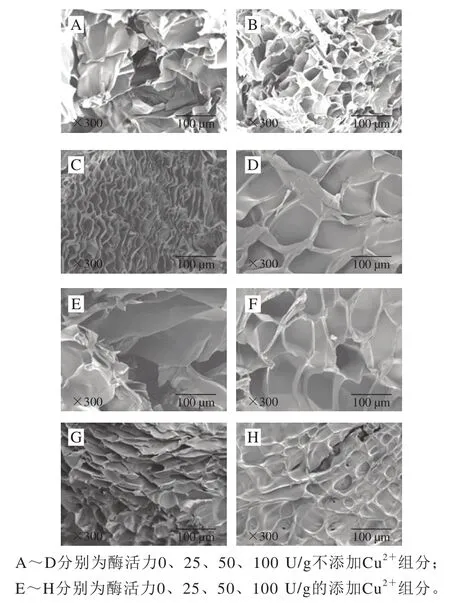
图2 不同条件处理下明胶样品的SEM图像Fig. 2 SEM images of gelatin samples treated with different concentrations of PAO in the presence and absence of Cu2+
由图2可以看出,纯明胶(对照品)呈现较松散的结构,层次结构中有较多的空隙存在,并且内壁较厚且光滑。随着PAO的添加(不加入Cu2+),明胶的结构变得越来越紧密,结构空隙也越来越小,当酶活力增加到100 U/g时,明胶表面的结构最为致密并且光滑,看不到层次结构,这可以解释为PAO可以与明胶发生交联,最终使明胶的网络结构变得更为致密。当加入Cu2+后,纯明胶的结构变得更为松散,这可能是因为在加入Cu2+条件下,明胶发生变性,导致其结构变得疏松;同时,随着酶含量的增加,明胶的网络结构也呈现一定程度的紧密,但是层状结构并不明显,并且明胶网络比未加入Cu2+的样品空隙大,这说明在100 mmol/mL Cu2+存在条件下,Cu2+可能会阻碍酶与明胶的交联,未交联的酶填充到明胶的网络结构中,使结构变得紧实,但这并不排除其他适宜浓度的Cu2+促进明胶与酶发生交联的可能性,包括明胶中原有的金属元素也可能通过提高PAO酶活性促进了交联[29]。
2.3 DSC分析
从表1和图3可以看出,在不加入Cu2+时,峰值温度与焓变的变化趋势保持一致,这说明酶的加入能够使明胶的网络结构变得更加稳定;随着PAO添加量的增加,PAO与部分解螺旋结构的明胶发生交联并且会增加分子间作用力,因此破坏其结构需要更多的热量。当加入Cu2+时,Tm与ΔHm的变化趋势均与未加入时趋势相反,Cu2+会破坏酶与明胶的结构,使其发生变性,无法产生相互交联作用及分子间相互作用。这一结果也与电泳和SEM结果一致。在50 U/g+Cu2+时焓变最大,这可能由于该添加量为明胶分子间交联及Cu2+与部分带负电荷的基团发生静电相互作用的合适添加量;而随着PAO添加量的增大,PAO会干扰明胶的空间结构,明胶分子逐渐变的不稳定,破坏其结构需要的热量减少。
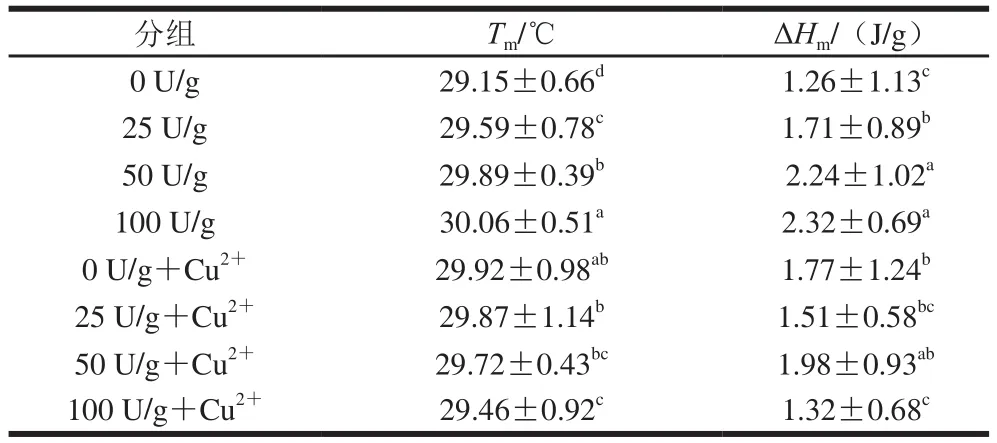
表1 不同样品DSC测定的峰值温度(Tm)与焓变(ΔHm)Table 1 Peak values (Tm) and enthalpy changes (ΔHm) measured by DSC for different samples
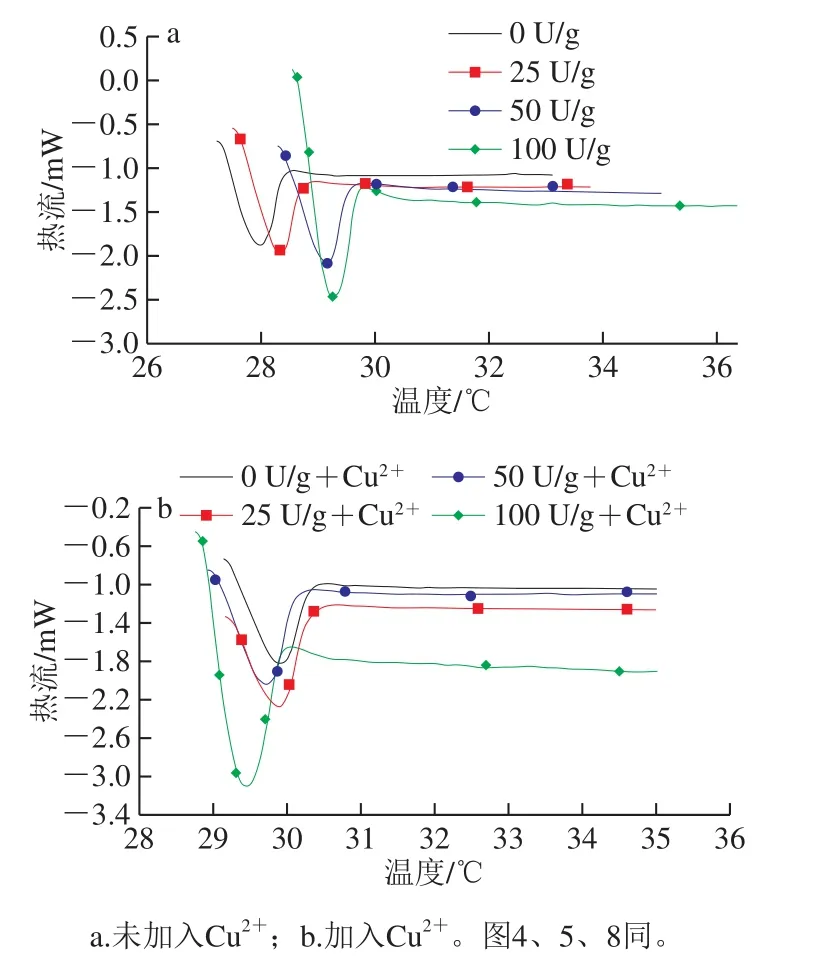
图3 不同条件处理的明胶样品的DSC曲线图Fig. 3 DSC curves of gelatin samples treated under different conditions
2.4 FTIR分析
不同处理明胶样品的FTIR如图4所示,参照已有研究方法[30],其二级结构中酰胺I带的不同结构含量分析如表2所示。明胶的酰胺I带(1 700~1 600 cm-1)是分析其结构发生显著变化的重要特征带,明胶的结构越稳定,则酰胺I带中的无规卷曲结构含量越少,而β-折叠、α-螺旋和β-转角等规则结构含量增加,反之,明胶的网络结构变得不稳定,无规卷曲含量增加。在不加入Cu2+时,随着PAO添加量的增大,无规卷曲含量显著增加,β-折叠和β-转角先减少后增加,α-螺旋先增加后减少,这可能是由于不同含量的酶与明胶的多肽链发生不同程度的交联,并且产生不同含量的次级键,使明胶中的肽链发生聚合,形成稳定的二级结构。当加入Cu2+后,明胶中的无规卷曲含量先增加后减少,并且在50 U/g时无规卷曲含量最多,α-螺旋含量先增加后减少,这可能是由于Cu2+的存在破坏打乱二级结构,但在PAO添加量为50 U/g时发生静电相互作用力最大,明胶带负电的COO-含量的减少,阻碍了明胶链之间的交联,不能形成紧密的网络结构,因此在该PAO添加量下无规卷曲含量最多。

图4 不同明胶样品的FTIR图Fig. 4 FTIR spectra of gelatin samples
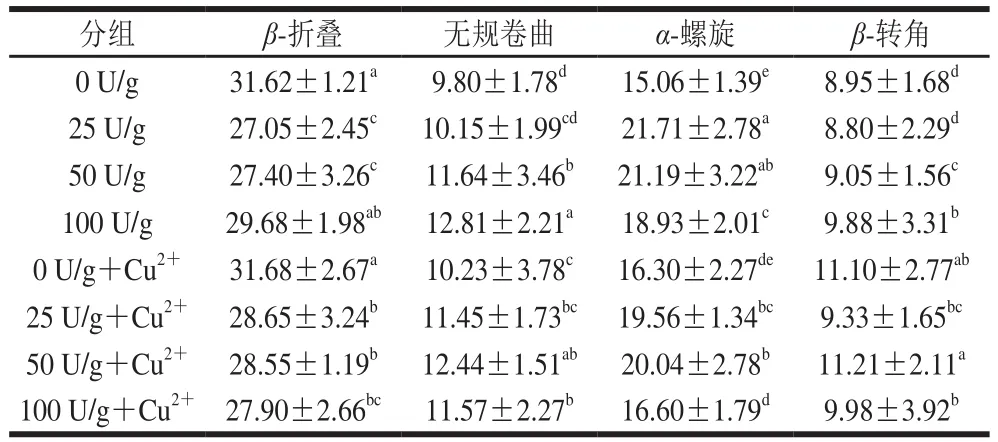
表2 明胶FTIR图酰胺I带结构分析Table 2 Secondary structure analysis of gelatin samples based on amide I band in FTIR spectra%
2.5 Zeta电位分析
Zeta电位表示体系的稳定性,Zeta电位(正或负)越高,分子或分散粒子越小,体系越稳定;反之,Zeta电位(正或负)越低,越倾向于凝结或凝聚[31]。从图5a可以看出,在不加入Cu2+时,电位整体偏向于负值,说明该明胶为酸性明胶。随着PAO添加量的增加,电位逐渐趋向于负值,说明酶的加入与明胶中存在的酸性基团发生有效结合,PAO氧化端肽的碱性赖氨酸形成α-氨基脂肪-δ-半醛,随后与另一个氨基或者醛形成共价交联,形成的网络结构呈现酸性。如图5b所示,当加入Cu2+后,明胶的整体电位呈现中性,并且不同含量的明胶电位无明显变化,这说明Cu2+的加入与明胶及酶之间发生静电相互作用,并且会破坏明胶分子结构,使酶变性,阻碍明胶分子的相互作用。
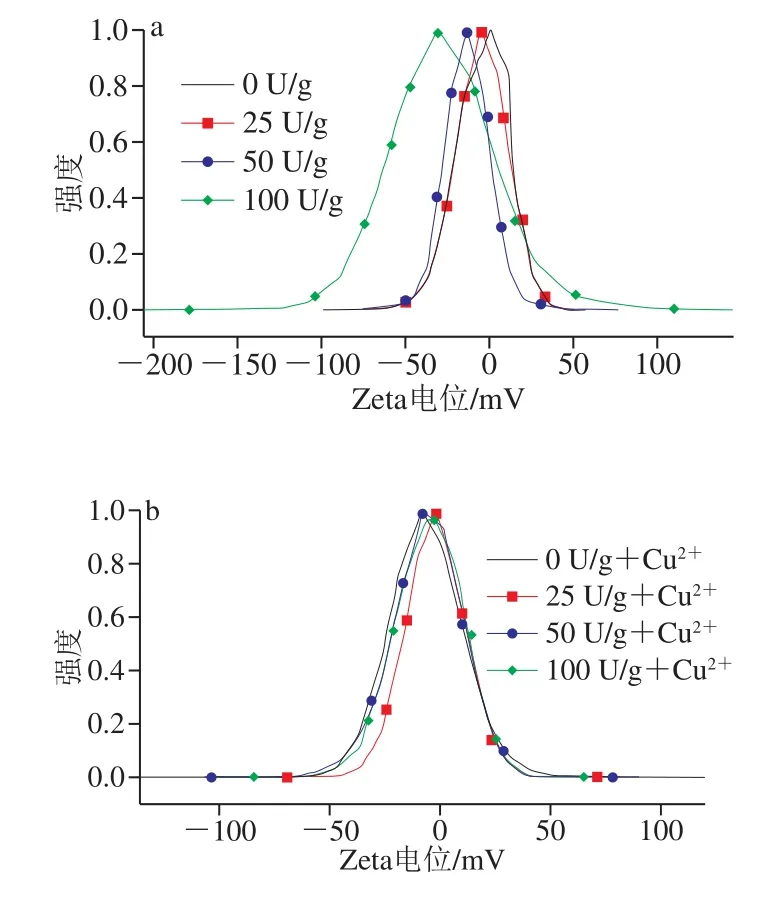
图5 不同处理条件下所得明胶的Zeta电位图Fig. 5 Zeta potential curves of gelatin treated under different conditions
2.6 流变性能分析
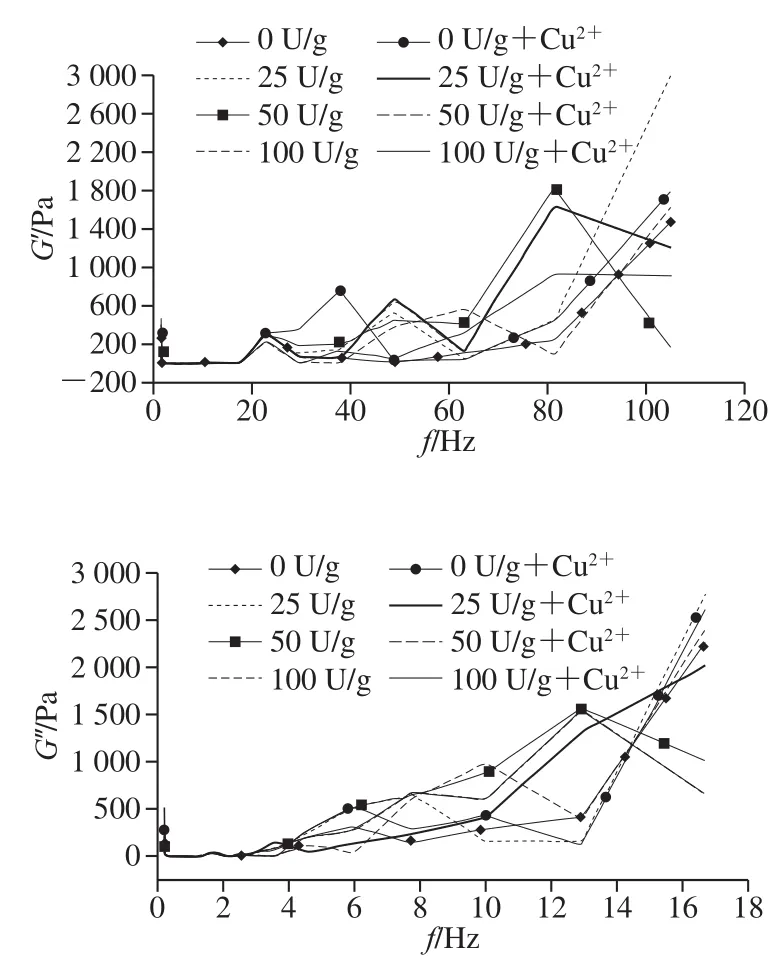
图6 明胶的流变学特性曲线Fig. 6 Rheological properties of gelatin samples
明胶的凝胶现象是由于蛋白质分子间的相互作用造成的,如氢键、静电相互作用等[32],将其溶于酸醋有利于打破这种弱键相互作用,进而利于分析共价交联的区别。如图6所示,纯明胶为典型的牛顿流体,随着酶含量的增加,明胶的牛顿流体行为减弱,而表现出假塑性,这可能是由于明胶与PAO的相互作用的原因。G′大于G′′,说明体系以弹性为主,反映明胶的凝胶特性。当加入Cu2+后,明胶的弹性模量和黏性模量均呈现增大的趋势,且随着剪切频率的增大而增大,呈现线性相关,说明Cu2+的存在影响明胶的网络结构,使明胶的凝胶特性提高,这可能是由于Cu2+与明胶发生静电相互作用的结果。此外,明胶样品的曲线出现的不平滑性,可能是由于交联或冻干过程中造成的明胶聚集物的出现而导到结构的不均一性和高弹性所致。
2.7 粒径分析
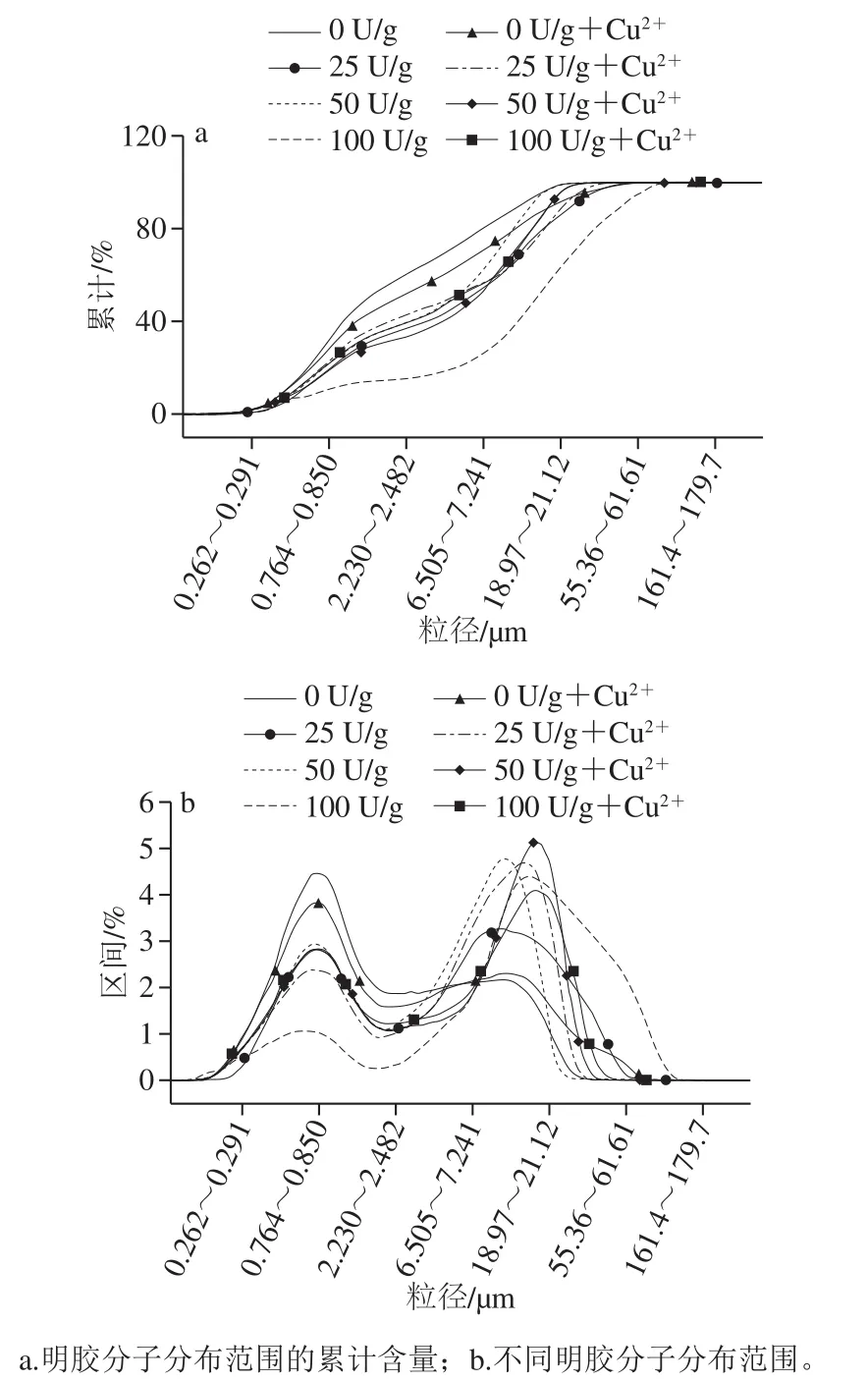
图7 不同处理条件下明胶的粒径分布Fig. 7 Particle size distribution of gelatin under different treatment conditions
从图7可以看出,在未加入PAO时,明胶主要分布在小分子质量范围内(0.764~0.850 μm),而在大分子质量分布范围内(18.97~61.61 μm)含量较少。随着PAO添加量的增加,明胶小分子含量逐渐减少,而大分子含量增加,说明酶的加入使明胶分子发生交联,纤维之间相互聚合,分子内氢键及相互作用力等增加,使明胶的结构紧密,最终使分子质量增加。这一结果也与前面的电泳分析结果一致。当加入Cu2+后,小分子质量比未加入Cu2+时减少,而大分子质量增加,这说明Cu2+的加入可以与明胶分子链发生结合,使分子链增大,从而大分子质量增加。大分子质量的分布范围最大,原因可能是由于空间位阻效应使该条件下发生的聚合程度最大,使结构最为致密。当酶含量为50 U/g时,Cu2+对明胶分子质量分布影响最为明显。
2.8 荧光分析

图8 不同处理条件下明胶的荧光分布图Fig. 8 Fluorescence intensity of gelatin under different treatment conditions with and without Cu2+
样品经过光源激发后使处于基态的分子吸收激发光后变为激发态,激发态不稳定会重新返回到基态,该过程的能量释放产生荧光。酶与胶原交联可以产生荧光性物质[33]。明胶经过酶与Cu2+处理后,由于酶含量的不同及是否添加Cu2+而导致其荧光强度发生变化。从图8可以看出,所有样品显示2 个不同的峰,分别为400~450 nm与700 nm波长处左右的峰(其中700 nm波长处的峰为倍频峰,在这里不做分析)。从图8a可以看出,随着PAO添加量的增加,明胶的荧光强度呈现先增加后减少的趋势,并且在PAO添加量为25 U/g时荧光强度最大,这可以解释为在PAO添加量为25 U/g时酶与明胶交联产生的荧光性物质含量最多,即交联强度最大;随着PAO添加量的继续增加,过多的酶可能填充到交联的网络间隙,对荧光性物质产生阻碍,因此荧光强度减小。加入Cu2+处理后,荧光强度也呈现先增大后减小的趋势,但是在PAO添加量为50 U/g处的荧光强度最大。这可能是因为Cu2+的存在与明胶发生离子相互作用,进一步影响明胶的网状结构,使明胶及酶的构象发生改变,进而影响荧光特性。
3 结 论
本实验以PAO作为交联剂对明胶分子进行酶法改性,分析了酶处理后明胶的分子质量、分子结构和相关性能的变化。SDS-PAGE结果显示,随着加入PAO添加量的增大,蛋白质大分子质量条带含量增加,表明明胶分子间发生了交联。同时,从SEM图可以看出,发生交联后的明胶结构由松散变得越来越紧密,结构空隙越来越小,网络结构更为致密。FTIR分析结果表明明胶由于分子间交联而逐渐形成了稳定的二级结构。DSC结果表明加入PAO后明胶网络结构的热稳定性有提高。更为重要的是,流变性能与粒径分析的结果表明随着PAO添加量的增多,明胶聚集度逐渐增加,颗粒不断增加,进而提高明胶的黏弹性。荧光分光测定结果显示,明胶的荧光强度呈现先增加后减少的趋势,在PAO添加量为50 U/g时荧光强度最大,交联的效果最好。此外,与对照组相比,添加100 mmol/mL Cu2+并不能对交联起到积极的作用,反而会对交联起到阻碍作用。研究结果表明在无Cu2+作为辅助因子的情况下PAO也能够交联明胶分子并对其性能的改良具有积极的效果,初步证明了PAO作为新型的氧化酶交联食品蛋白质的可能性,其具体机制包括辅助因子的确切影响以及PAO对其他蛋白质的交联效果仍需进一步研究。

