NaCl浓度对麦醇溶蛋白与槲皮素相互作用的影响
王启明,唐瑜婉,李春翼,赵吉春,张宇昊,明 建,2,*
(1.西南大学食品科学学院,重庆 400715;2.西南大学食品贮藏与物流研究中心,重庆 400715)
小麦在人类饮食中起着重要作用,小麦粉被广泛用于以面粉为原料的食品中,如面包和面条[1]。尽管全世界的饮食模式不同,但小麦制品仍然是大多数人的主要食物来源。麦醇溶蛋白(gliadin,G),是小麦蛋白中主要的疏水性贮藏蛋白,具有两亲性和表面活性,在面包制作过程中具有维持气室及在啤酒酿造中稳定泡沫的潜力,主要用作面团流变性质和结构的改良剂[2-3]。槲皮素(quercetin,Q),3,5,7,3′,4′-五羟基黄酮,是谷物(如小麦、荞麦)、果蔬(如葡萄、洋葱)中的主要类黄酮之一,具有抗菌、抗癌和抗过敏活性,被认为是安全的食品添加剂,多羟基结构能与食物基质中的蛋白质发生相互作用,具有改善蛋白质特性的潜力[4-6]。
近年来,食品工业中新型复合食品体系的需求量逐渐增加,蛋白质、多酚作为生物体中重要的营养物质,两者在食品加工及人体消化过程中的相互作用不可避免。研究证明,膳食多酚作为小麦粉添加剂,主要通过二硫键、氢键和疏水相互作用等与面筋蛋白发生交联,影响面团的流变学性质及面制品的营养品质[7-10]。在食品加工过程中,荞麦粉和小麦粉常混合食用,Q和G之间的相互作用,会引起蛋白结构和功能特性的改变。王丽颖[11]采用反溶剂法,在pH 7.4条件下,运用荧光光谱技术结合浊度和粒径分析,初步探讨了G与Q二元体系的相互作用。研究结果证明Q对G有较强的荧光猝灭作用,猝灭方式为形成基态复合物的静态猝灭。但研究未涉及到pH值、离子强度、温度等典型化学加工条件。其中,pH值和离子强度影响蛋白质的带电性质以及溶液中离子-偶极和离子-离子的相互作用,是影响食品组分间相互作用类型和蛋白质结构和功能特性的重要因素[12]。通过实验已经证明不同pH值条件下Q通过共价键和非共价相互作用(氢键、静电和疏水相互作用)与G结合,可以改善蛋白的结构和理化性质以及Pickering乳液特性[13-14]。然而对于不同NaCl浓度下,Q与G的相互作用尚不清楚。
NaCl几乎是所有烘焙产品和谷类零食不可或缺的一种成分,成为影响面团和谷类食品加工和质量特性的关键因素[1]。Tang Yu等[15]指出,NaCl促成多肽在面筋中的解折叠和面筋网络结构的形成。因此,本实验通过光谱技术初步研究不同NaCl浓度下G和Q的相互作用,便于更好地了解两者的结合常数、热力学参数与结合力类型。此外,通过红外光谱和拉曼光谱评估蛋白质结构变化。旨在为了解不同NaCl浓度下G和Q的结合方式,以及拓宽两者在小麦制品中的应用范围提供参考。
1 材料与方法
1.1 材料与试剂
G、Q 美国Sigma公司。
氯化钠、乙醇、冰乙酸、溴化钾(均为分析纯)成都科龙化工试剂公司。
1.2 仪器与设备
F-2500荧光分光光度计 日本日立公司;85-2A数显恒温磁力搅拌器 金坛市科析仪器有限公司;XHFDY高速分散器 宁波新芝生物科技股份公司;UV-2450紫外分光光度计 日本Shimadzu公司;LGJ-10真空冷冻干燥机 北京松原华兴科技有限公司;Spectrum100傅里叶红外光谱仪 美国Perkin-Elmer公司。
1.3 方法
1.3.1 样品的制备
在前期实验基础上,通过反溶剂法制备G及其复合物G/Q分散液[13]。在磁力搅拌下将1.0 g G和7.5 mg Q溶解在100 mL 70%(V/V)乙醇溶液中。在反溶剂过程中,水相-醇相体积比2.5∶1。将G溶液缓慢滴入1%(V/V)乙酸溶液中,边滴边均质,然后在45 ℃水浴下旋蒸。在没有Q的情况下相同条件制备蛋白溶液。调节溶液NaCl浓度,得到0、10、20、50、100、200 mmol/L的分散液,冷冻干燥,备用。
1.3.2 荧光光谱测定
参考王丽颖[11]的方法略作修改。
内源荧光发射光谱:吸取1 mL不同NaCl浓度的混合溶液(混合前,G浓度为10 μmol/L,Q浓度梯度为0、3、5、10、20、30、60、100 μmol/L)。用F-2500荧光分光光度计分别在293、303、313 K下进行测定。激发波长λex=295 nm,扫描范围为300~500 nm。参考Lakowicz[16]的方法校正内滤光效应。
结合类型、结合参数、热力学参数:采用Stern-Volme方程描述荧光猝灭:
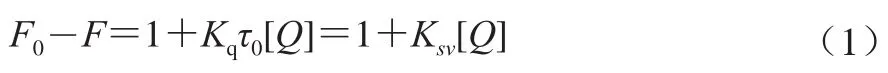
式中:F0和F分别为不存在和存在猝灭剂(Q)时的荧光强度;Kq为双分子猝灭速率常数/(L/(mol·s)),动态扩散的Kq最大值为2.0×1010L/(mol·s);τ0为没有荧光猝灭剂状态下的平均荧光寿命,一般为10-8s;[Q]为Q的浓度/(μmol/L);Ksv为Stern-Volme方程猝灭常数/(L/mol),通过F0/F对[Q]的曲线斜率计算获得。
其结合常数和结合位点数可用式(2)进行计算:
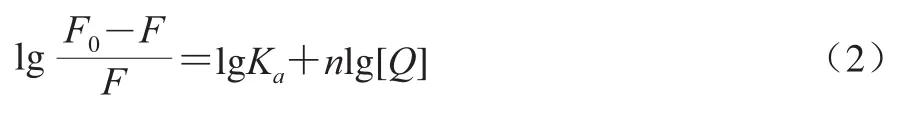
式中:Ka为结合常数/(L/mol);n为结合位点数。
通过Van’t Hoff方程计算出反应的焓变(ΔH)、熵变(ΔS)、自由能变(ΔG),从而推测出蛋白与小分子物质间的相互作用力。

由吉布斯自由能公式计算ΔG:

式中:R为理想气体常数8.314 J/(mol·K);T为绝对温度/K。
1.3.3 同步光谱测定
在250~500 nm波长范围内扫描样品,293 K下进行同步荧光测量。设置波长差Δλ=15 nm和Δλ=60 nm,激发和发射狭缝宽度保持恒定为5.0 nm,扫描速度为1 500 nm/min。
1.3.4 紫外光谱测定
参考王丽颖[11]的方法略作修改。以70%乙醇溶液为参比,依次移取3.0 mL样品溶液于比色皿样品池中。采用UV-2450分光光度计测定样品在200~450 nm波长范围内的紫外吸收光谱。
1.3.5 色氨酸距离测定
参考Lakowicz[16]的方法略作修改。以70%乙醇溶液为参比,分别用F-2500荧光分光光度计、UV-2450分光光度计测定G(5 μmol/L)的荧光光谱、Q(5 μmol/L)的紫外吸收光谱。
根据Forster’s能量转移理论,供体(G)与受体(Q)之间的距离以及能量转移效率用下式计算:

式中:F0和F分别为不存在和存在猝灭剂(Q)时的荧光强度;r为距离/nm;E为能量转移效率/%;R0为能量转移效率为50%时的Forster’s临界距离/nm,可用下式计算:

式中:K2为过渡偶极子取向的空间因子,取值2/3;N为介质的折射率,取值1.336;σ为供体的荧光量子产率,取值0.118;J为供体荧光光谱和受体吸收光谱的重叠积分,可用下式计算:

式中:F(λ)为供体在λ处的荧光强度;ε(λ)为波长在λ处时受体的摩尔吸光系数/(L/(mol·cm))。
1.3.6 傅里叶变换红外光谱测定
参考Liu Rui等[8]的方法略作修改。将干燥样品(3.0 mg)与溴化钾(50.0 mg)混合,压成光滑圆片,在500~4 000 cm-1的波数范围内收集每个光谱,分辨率为4 cm-1,扫描次数为32。
1.3.7 拉曼光谱测定
参考王丽颖[11]的方法略作修改。将干燥的样品放在光滑的玻璃载玻片上,用激光拉曼显微镜在785 nm的激发波长下进行实验。测试条件为:显微镜物镜为20 倍,光斑尺寸为1 μm,狭缝宽度为50 μm,激光功率为15 mW,背景曝光时间为512 s,扫描范围为500~4 000 cm-1,分辨率为1 cm-1,扫描次数为32。通过以1 003 cm-1的苯丙氨酸作为内标进行归一化处理。使用OMNIC 8.2(Thermo Fisher Scientific Inc., Waltham,MA,USA)软件进行光谱基线校正,平滑和原始数据归一化处理。
1.4 数据处理
所有实验至少进行3 次重复,采用Sigma Plot 12.5和Origin 8.5软件进行图形绘制。
2 结果与分析
2.1 不同NaCl浓度下Q对G荧光猝灭的影响


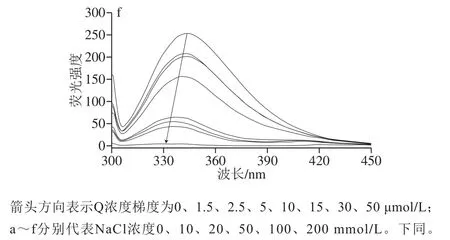
图1 不同NaCl浓度下Q对G的荧光猝灭效应Fig. 1 Fluorescence quenching effects of Q on G at different NaCl concentrations
蛋白质固有的荧光团(色氨酸和酪氨酸)对其微环境的极性高度敏感。如图1所示,G浓度为5 μmol/L,在未荷载Q时,不同NaCl浓度下蛋白在波长340 nm左右有最强荧光发射峰,而随着Q的加入及浓度的增大,荧光强度降低且伴随着明显的蓝移现象(0 mmol/L:343 nm→331 nm;10 mmol/L:343 nm→330 nm;20 mmol/L:344 nm→330 nm;50 mmol/L:344 nm→330 nm;100 mmol/L:345 nm→330 nm;200 mmol/L:344 nm→329 nm),表明Q与G之间存在相互作用,且Q以剂量依赖方式导致蛋白质的荧光猝灭,与王晨等[10]报道的花青素对G的荧光猝灭和Joye等[17]报道的白藜芦醇对G的荧光猝灭结果一致。当Q浓度为50 μmol/L时,荧光猝灭率为96%~98%。蛋白质处于折叠状态时产生高荧光强度,色氨酸残基通常位于蛋白质的疏水环境中;而在展开状态下,它们暴露于溶剂(亲水环境)中,导致荧光强度降低[18]。蓝移表明氨基酸附近的微环境极性减弱,疏水性增强,与Xia Wenyin等[19]的研究结果一致。随着NaCl浓度的增大,蓝移现象更明显,表明NaCl在一定程度上能增强G与Q的相互作用。此外,在NaCl浓度条件下,蛋白发射带的分离更加明显,Hasni等[18]报道这与色氨酸残基的更多暴露和蛋白质结构的展开有关。
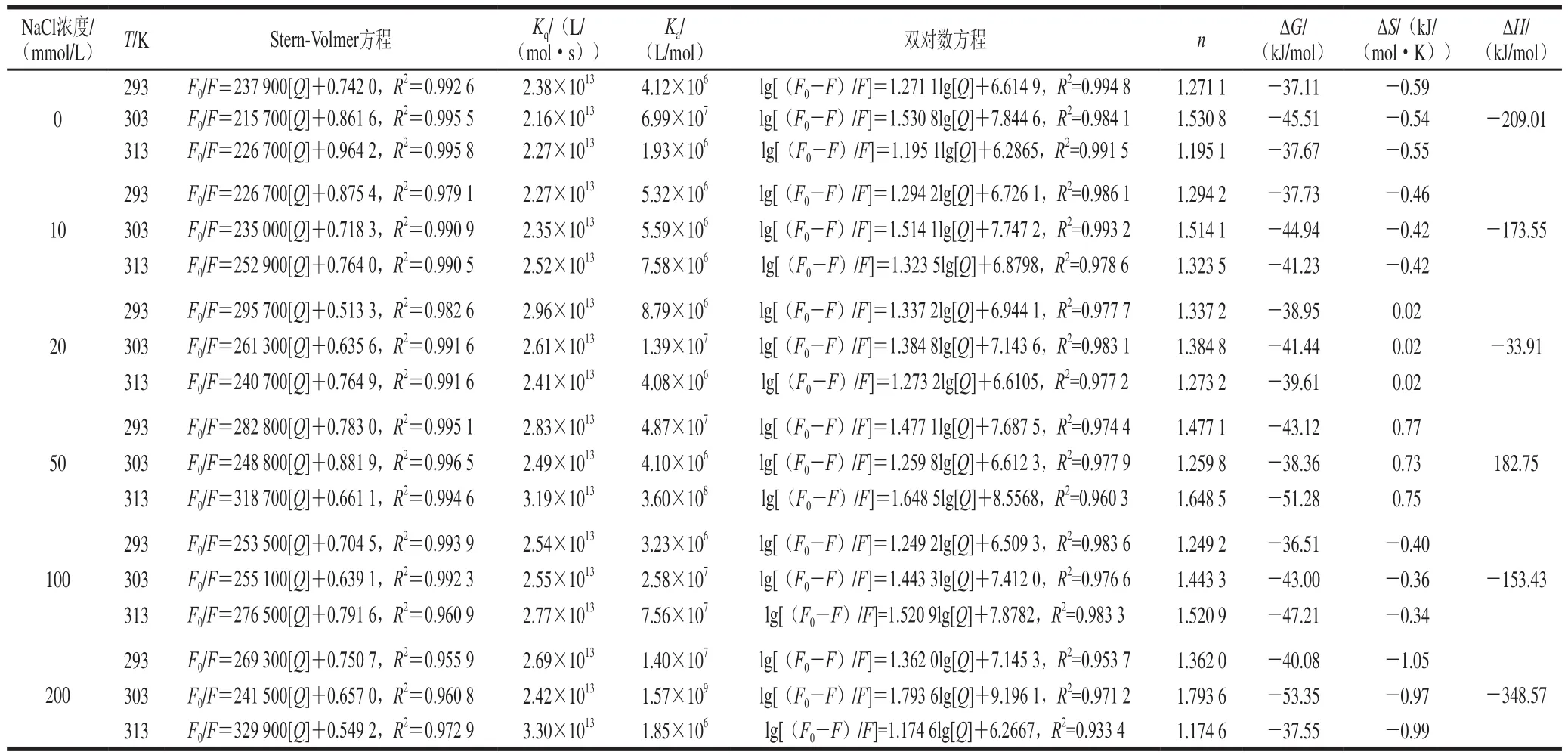
表1 G/Q复合物在不同NaCl浓度和3 个温度下的猝灭常数和热力学参数Table 1 Quenching constants and thermodynamic parameters of the formation of gliadin/quercetin (G/Q) complexes at different NaCl concentrations and three temperatures
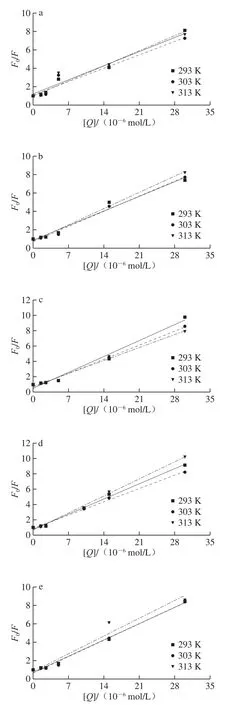

图2 不同温度下Q猝灭G的Stern-Volmer图Fig. 2 Stern-Volmer plot of Q quenching G at different temperatures
猝灭机理通常分为动态猝灭和静态猝灭。温度升高导致静态猝灭常数降低或动态猝灭常数升高。如图2所示,在较低的[Q]区域范围,F0/F和[Q]之间存在线性相关性,在NaCl浓度为0 mmol/L时,Ksv(303 K)>Ksv(313 K)>Ksv(293 K)或Ksv(313 K)>Ksv(303 K)>Ksv(293 K),说明G与Q之间发生了动态猝灭现象。室温(293 K)下,NaCl存在时的Ksv较大,表明在此温度下离子的存在使Q对蛋白的荧光猝灭效应有所增强,且顺序为Ksv(50 mmol/L)>Ksv(200 mmol/L)>Ksv(20 mmol/L)>Ksv(10 mmol/L)>Ksv(100 mmol/L),离子可能也参与了相互作用过程。通过无荧光猝灭剂状态下的平均荧光寿命τ0(一般为10-8s)和猝灭常数Ksv得到双分子猝灭速率常数Kq(Ksv=10-8×Kq),如表1所示。Kq值(在2.16×1013~3.30×1013L/(mol·s)之间)高于最大动态猝灭速率,这表明在G和Q相互作用期间存在静态猝灭,所以Q对G的猝灭方式为动、静态结合。而在20 mmol/L NaCl浓度时,斜率随温度升高而降低,且不同温度条件下Kq远大于最大动态猝灭速率2.0×1010L/(mol·s),说明此条件下的相互作用过程是形成复合物的静态猝灭。王晨等[10]发现黑豆皮中的花青素对G的猝灭方式为动、静态结合;Joye等[17]研究报道温度在308 K上升到318 K的过程中,白藜芦醇和G相互作用的猝灭常数呈现增大的趋势,说明两者的作用模式为动、静态结合;而王丽颖[11]模拟生理pH值条件发现Q对G的猝灭方式为静态猝灭。以上结果表明,多酚种类及环境条件(pH值、NaCl浓度等)对G有不同的猝灭作用。
2.2 不同NaCl浓度下G/Q复合物的结合常数和结合位点数分析
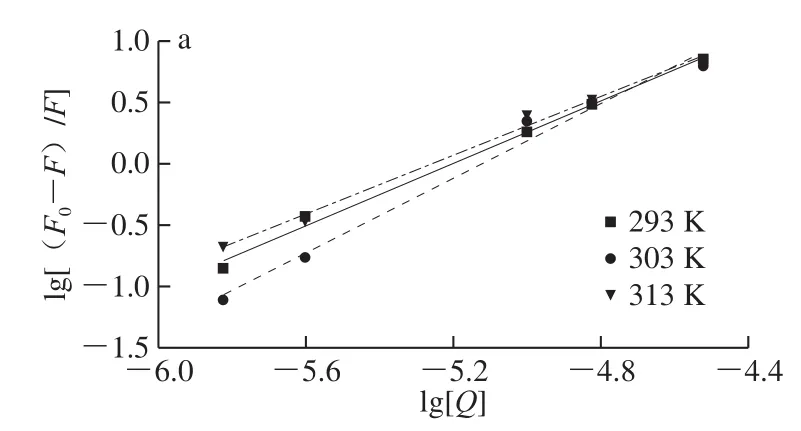
图3 不同温度下Q猝灭G的双对数图Fig. 3 Double logarithmic plot of Q quenching G at different temperatures
如图3所示,lg[(F0-F)/F]和lg[Q]的拟合直线关系可提供结合常数Ka和结合位点数n的信息,其值列于表1。Ka值均较大,数值为106~107量级,属于强相互作用范畴[20],Q与G的相互作用强于花青素[10]和白藜芦醇[17]。各条件下n>1,表明G与Q之间至少有一个结合位点。与G与其他多酚相互作用的研究结果一致[10-11,17]。
2.3 不同NaCl浓度下G/Q复合物的热力学参数与结合力类型分析
为了研究G与Q之间的主要结合力,获得了热力学参数(ΔG、ΔH和ΔS)的数值。根据Ross等[21]的结果,如果ΔH<0和ΔS<0,则主要力是范德华力和氢键;如果ΔH>0和ΔS>0,则为疏水作用;如果ΔH<0且ΔS>0,则为静电相互作用。由表1可得,50 mmol/L NaCl浓度下,G与Q之间主要为疏水作用力,ΔH>0表明G与Q的相互作用为吸热反应,升温有利于反应的进行,这与结合常数Ka值随温度升高而趋于升高相吻合;而其他NaCl浓度下,G与Q之间主要为氢键相互作用,20 mmol/L NaCl浓度下存在静电作用。王丽颖[11]的研究发现G与Q结合的主要驱动力是氢键和范德华力,说明NaCl浓度影响着蛋白-多酚的主要结合力类型。而所有NaCl浓度下ΔG<0,表明G与Q的结合可以自发进行。
2.4 Q与G相互作用的同步光谱分析

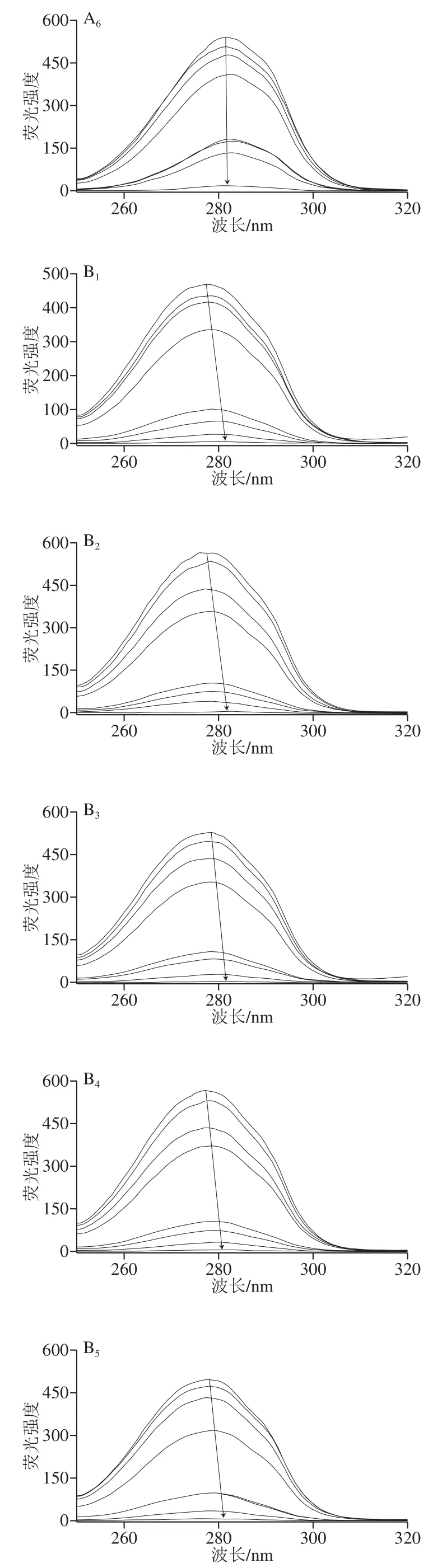
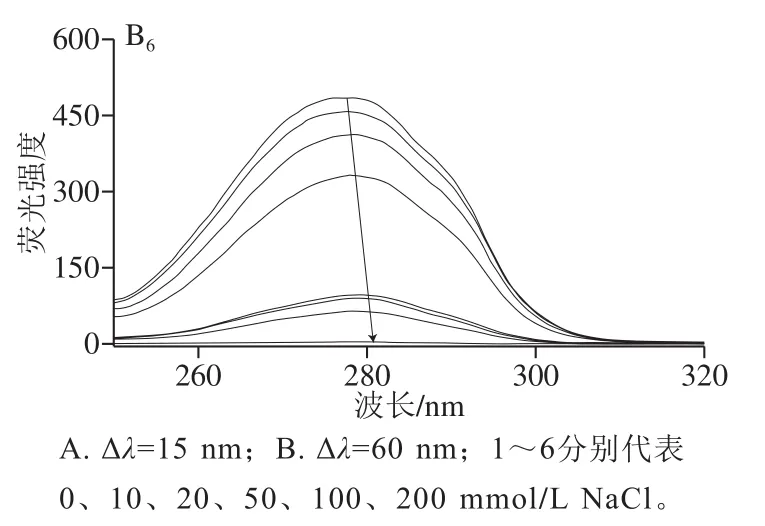
图4 不同NaCl浓度下Q对G同步荧光光谱的影响Fig. 4 Effect of Q on the synchronous fluorescence spectrum of G at different NaCl concentrations
同步荧光光谱技术可以研究配体对蛋白质构象的影响。根据最大发射波长和荧光强度的变化,它可以提供荧光团官能团附近微环境的极性变化的信息[13]。采用同步光谱法记录不同NaCl浓度下蛋白质色氨酸残基和酪氨酸残基在Q作用下的特征光谱。激发和发射波长之间的差值(Δλ)设置为15 nm或60 nm,则显示酪氨酸或色氨酸残基周围的环境变化。如图4所示,不同NaCl浓度下,随着Q浓度的增大,蛋白的酪氨酸和色氨酸残基的荧光强度均有猝灭现象且最大吸收波长均有不同程度的红移现象,与王晨等[10]的研究结果一致。该观察结果表明,Q使荧光团附近区域极性增大。Q与G之间的相互作用,使得蛋白质构象发生变化,荧光强度降低,氨基酸残基间的能量传递也降低。酪氨酸残基红移1~2 nm(图4A);色氨酸残基红移2~4 nm(图4B)。在所测试的NaCl浓度下,色氨酸残基强于酪氨酸残基,这表明色氨酸残基对蛋白固有荧光的猝灭贡献更大[22]。黄渊等[23]指出表没食子儿茶素没食子酸酯与肌球蛋白相互作用过程中,色氨酸比酪氨酸的荧光贡献率更大,这与激发波长的设置及两种氨基酸的相对含量有关。不同NaCl浓度下,最大发射波长和荧光强度明显不同,表明荧光团附近微环境的极性变化受离子强度的影响。
2.5 Q与G相互作用的紫外光谱分析
利用蛋白质的紫外-可见吸收光谱初步探究蛋白质结构的变化。蛋白质分子中芳香族氨基酸残基所处的微环境发生变化,会引起蛋白吸收波长的改变[24]。280 nm波长附近的吸收峰属于蛋白氨基酸(色氨酸和酪氨酸残基)。如图5所示,在Q和NaCl添加的情况下,蛋白质的吸收峰显示出增色现象,最大吸收值出现约20 nm的蓝移。吸光度的这种变化表明,蛋白质发色团周围的微环境发生了变化,蛋白分子内部色氨酸和酪氨酸残基中的芳香杂环疏水基团暴露。在365 nm波长左右也出现了一个峰,这表明在复合物形成过程中Q被氧化,可能发生了蛋白质构象变化[25]。最大吸收峰的变化也进一步证明复合物的形成。与0 mmol/L NaCl浓度的蛋白相比,200 mmol/L NaCl浓度下G的紫外光谱在275 nm波长附近的吸收峰略微降低,这可能是蛋白的自聚集反应所致。荷载Q后明显改变了蛋白的紫外光谱,且随着NaCl浓度的增加,在253 nm波长附近的紫外特征吸收峰逐渐增强。以上结果表明Q与G的复合改变了蛋白的分子结构,且一定NaCl浓度使得色氨酸和酪氨酸残基附近疏水性增强,从而改变蛋白质构象。刘勤勤等[24]报道加入茶多酚后,大豆分离蛋白的色氨酸和酪氨酸微环境的变化,表明蛋白质的二级结构发生了改变。王斌[26]指出蛋白构象的改变更有利于分子中色氨酸和酪氨酸残基芳香杂环的π—π*跃迁。

图5 紫外-可见吸收光谱的变化Fig. 5 Changes in UV-visible absorption spectra
2.6 Q与G相互作用的能量转移分析
由于分子之间的偶极-偶极相互作用,能量转移现象发生在激发态的供体和受体之间。这种现象的发生程度取决于供体发射和受体吸收光谱之间的重叠程度,供体量子产率,供体和受体转变偶极子的取向,以及供体和受体分子之间的距离。由于距离特异性,能量转移分析可用于确定供体和受体分子之间的距离[16]。图6为Q UV-Vis吸收光谱和G荧光发射光谱的重叠光谱,根据公式(5)~(7)可计算J、E、R0和r的值,见表2。不同NaCl浓度下,r值在3.12~3.69 nm范围内,均小于8 nm,这表明分子之间具备能量转移的条件,且非辐射能量转移也是引起荧光猝灭的原因之一[16]。不同NaCl浓度下,J、E、R0和r的值明显不同,表明能量转移现象的发生程度受离子强度的影响。

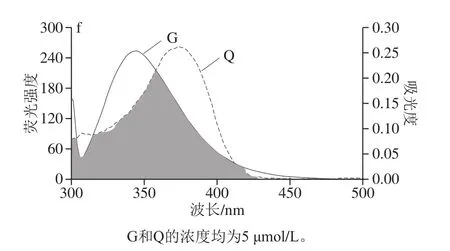
图6 G的荧光光谱和Q的吸收光谱merge图Fig. 6 Merge between the fluorescence spectrum of wheat gliadin and absorption spectrum of quercetin
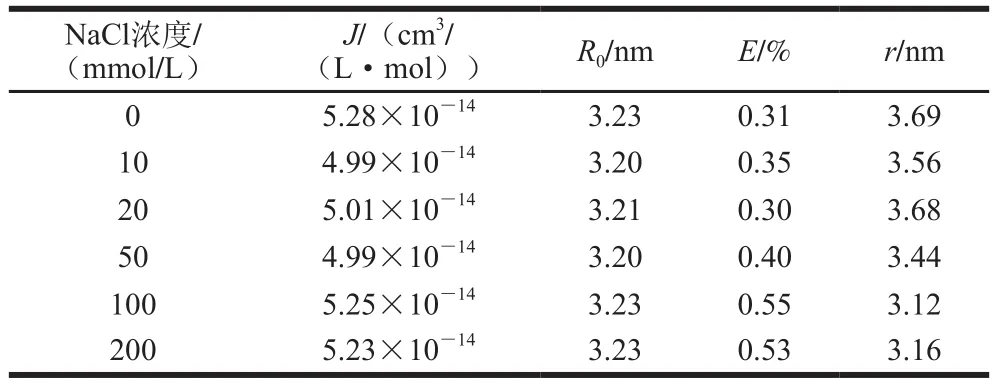
表2 不同NaCl浓度下G和Q之间的分子结合距离Table 2 Intermolecular binding distances between G and Q at different NaCl concentrations
2.7 不同NaCl浓度下Q对G结构影响的傅里叶变换红外光谱分析
通过分析蛋白质红外光谱谱带,可获取蛋白某些官能团的变化信息,确定是否有新化合物或官能团的形成,以及分子间可能存在的作用力类型。如图7所示,G在3 000~3 500、2 960、1 650~1 660、1 540~1 560、1 100 cm-1附近显示出主要特征峰。3 000~3 500 cm-1为O—H伸缩振动;2 960 cm-1为CH2伸缩振动;1 650~1 660 cm-1为酰胺I带,代表C=O拉伸振动;1 540~1 560 cm-1为酰胺II带,代表C—N拉伸与N—H弯曲振动;1 100 cm-1为C—O基团的拉伸振动[13]。

图7 不同NaCl浓度下G及其与Q复合物的傅里叶变换红外光谱图Fig. 7 FIIR spectra of G and their complexes with Q at different NaCl concentrations
NaCl浓度为0 mmol/L时,蛋白在3 000~3 500 cm-1范围的特征峰所对应波数为3 427 cm-1,随着NaCl浓度的增大,特征峰发生蓝移(在NaCl浓度为200 mmol/L时,波数为3 435 cm-1),但荷载Q后导致特征峰发生红移,表明蛋白在形成氢键的过程中受到NaCl浓度和Q的影响[27]。在荷载Q后,蛋白的酰胺II带从1 548 cm-1处,移至1 553 cm-1(0 mmol/L)、1 547 cm-1(10 mmol/L)、1 546 cm-1(50 mmol/L)、1 555 cm-1(200 mmol/L),证明Q与C—N和N—H基团发生了相互作用。同样,不同NaCl浓度蛋白在2 960 cm-1附近的吸收峰也发生了蓝移或红移,表明一定NaCl浓度下特殊的离子作用稳固偶极子而增强了疏水作用[28]。蛋白的红外光谱图在1 000~4 000 cm-1范围的波数所对应特征峰发生不同程度的红移或蓝移,表明不同NaCl浓度下蛋白质内部分子构象不同,酰胺带红外吸收峰的变化表明Q引起G的二级结构发生改变[8,25]。在特定NaCl浓度下,G与Q可能有特定的作用方式,氢键或疏水相互作用在复合物的形成中起重要作用。
2.8 不同NaCl浓度下Q对G结构影响的拉曼光谱分析
拉曼光谱可提供不同NaCl浓度下G及其复合物的构象变化和氨基酸侧链微环境变化。拉曼光谱扫描图谱中,特征峰的谱线强度与蛋白质中化学键或基团数目成正比[29]。通过样品谱线强度变化来判断化学键或基团是否变化。样品在600~3 200 cm-1范围内的拉曼光谱扫描图谱如图8A所示,谱带归一化强度如图8B、C所示。
选用对蛋白质构象或微环境变化不敏感的苯丙氨酸(1 003 cm-1)的强度作为内标归一化谱带振动强度[30]。图8A中,随着Q和NaCl的添加,酰胺I带(1 600~1 700 cm-1)、脂肪酸氨基酸C—H振动(1 448 cm-1和2 934 cm-1)、酰胺III带(1 230~1 340 cm-1)的特征峰峰型和强度发生改变,表明不同NaCl浓度及Q的引入影响蛋白结构和构象变化。图8B中酰胺I带和酰胺III带强度的变化可以表征蛋白二级结构变化,振动位置主要在1 656 cm-1和1 248 cm-1处。对于酰胺带,不同的谱带范围代表不同的蛋白质构象(α-螺旋、β-折叠和无规卷曲)。Wang Hingwan等[31]指出,蛋白质在1 667~1 673 cm-1附近的酰胺I带和1 230~1 240 cm-1附近的酰胺III带主要是β-折叠结构,而具有高比例α-螺旋结构的酰胺带处于1 650~1 660 cm-1和1 260~1 300 cm-1附近,1 665 cm-1的酰胺I带和1 245 cm-1的酰胺III带附近含有大量无规卷曲结构。因此,图8中蛋白酰胺带的位置及谱带强度表明G含有较多的α-螺旋和无规卷曲结构,与仇超颖[32]的研究结果一致。图8C中C—H键的弯曲和拉伸振动主要在1 448 cm-1和2 934 cm-1处,Sun Weizheng等[33]指出C—H键振动强度升高,表明蛋白质结构去折叠及脂肪族氨基酸侧链的暴露。Herrero等[30]将C—H键振动强度的降低归因于脂肪族氨基酸残基周围的疏水相互作用。目前,关于1 450 cm-1附近的归一化强度增强或降低的变化存在争议,但普遍认为C—H振动的变化可能引起蛋白质脂肪族氨基酸残基微环境和三级结构的变化[34]。此外,不同NaCl浓度下蛋白及其复合物的色氨酸(760 cm-1)、酪氨酸(850 cm-1和830 cm-1)对应的特征峰强度和峰型发生变化,表明色氨酸、酪氨酸残基微环境也发生了变化。以上结果表明,不同NaCl浓度下,蛋白及其复合物的二级、三级结构及氨基酸侧链微环境发生了变化,但对于具体的结构含量变化仍需进行定量分析。
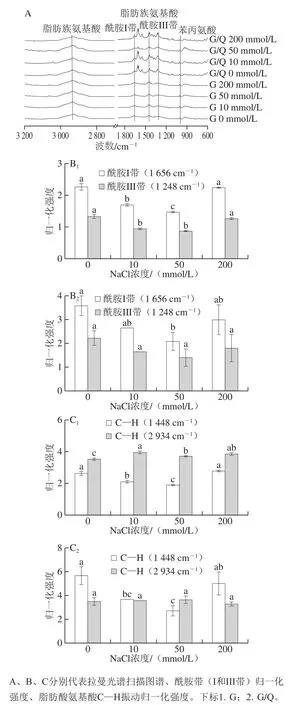
图8 不同NaCl浓度下G及其与Q复合物的拉曼光谱及归一化基团强度Fig. 8 Raman spectra and normalized group intensity of G and their complexes with Q at different NaCl concentrations
3 结 论
本实验在不同NaCl浓度下,利用光谱学技术探究了G与Q之间的相互作用。研究证明,Q能对G产生静态或动、静态结合的荧光猝灭作用。在不同NaCl浓度下G与Q通过静电相互作用、氢键和疏水相互作用相结合,在50 mmol/L NaCl浓度下以疏水相互作用为主导。Q和NaCl的加入改变了蛋白质色氨酸、酪氨酸残基的微环境。酰胺带吸收峰的变化表明Q引起G结构发生改变。本研究为了解不同NaCl浓度下G和Q的结合方式以及蛋白质的构象变化提供了参考。在食品工业中,利用相互作用,可实现对蛋白质的回收,大大提高小麦蛋白资源的利用率;但不同NaCl浓度下,蛋白及其复合物理化性质的变化(如质构特性、流变特性等)仍需进一步探究,以便更好地拓宽两者在小麦制品中的应用范围。

